Quelle est l'importance de la protéine TMEM119 dans les microglies ?
La protéine transmembranaire 119 (TMEM119) est une protéine transmembranaire de type I reconnue comme marqueur des microglies homéostatiques au repos dans le système nerveux central (SNC). Les microglies agissent comme les principales cellules immunitaires du SNC et jouent un rôle crucial dans le maintien de la santé et de l'homéostasie neuronales. Outre son rôle dans le cerveau, la TMEM119 intervient également dans la différenciation et la prolifération des ostéoblastes, ainsi que dans la minéralisation osseuse.
En 2016, deux groupes de recherche ont indépendamment identifié la TMEM119 comme un marqueur clé des microglies :
- Le groupe de Bennet et al. a identifié TMEM119 comme une protéine de surface cellulaire spécifique aux microglies dont la fonction est inconnue grâce à l'hybridation in situ (Bennett, 2016)
- Ils ont également découvert que TMEM119 servait de marqueur spécifique et fiable pour les microglies dans le SNC des souris et des humains, et qu'il n'était pas exprimé dans les macrophages, les autres cellules immunitaires ou les neurones.
- À l'aide d'un anticorps de domaine extracellulaire, ils ont mis au point une méthode permettant d'isoler des cellules microgliales non activées de grande pureté à partir du cerveau de souris.
- Le groupe de Satoh et al. a identifié que TMEM119 et Iba1 étaient exprimés dans presque tous les microglies grâce à une analyse comparative de cinq ensembles de données sur les transcriptomes des microglies de souris (Satoh, 2016). Leurs conclusions étaient les suivantes
- TMEM119 était présent dans les microglies Iba1+/CD68+ dans les cerveaux humains post-mortem, indépendamment du statut de la maladie d'Alzheimer (MA), bien que les résultats variaient pour les microglies réactives.
- TMEM119 n'a pas été détecté dans les macrophages Iba1+/CD68+ infiltrés présents dans les lésions démyélinisantes actives de la sclérose en plaques (SEP) ou dans les lésions nécrotiques résultant d'infarctus cérébraux.
- Ils ont conclu que TMEM119 est un marqueur fiable pour différencier les microglies résidentes des macrophages infiltrés dérivés du sang dans le cerveau humain.
Avant leurs publications, distinguer les microglies résidentes des macrophages circulants dans le cerveau humain représentait un défi. Les recherches de Bennet et al. et Satoh et al. ont permis à d'autres chercheurs d'évaluer le rôle des microglies dans la progression des maladies neurodégénératives et neuroinflammatoires (Bennett, 2016; Satoh, 2016).
D'autres marqueurs complémentaires sont essentiels pour l'étude des microglies :
- Le P2RY12 (récepteur purinergique P2Y 12) sert de marqueur spécifique supplémentaire pour les microglies homéostatiques chez l'être humain (Bottcher, 2019; Lier, 2021; Hashioka, 2022)
- Sa fonction consiste notamment à médier la chimiotaxie et l'extension des processus microgliaux vers les zones lésées.
- Le P2RY12 est également exprimé dans les oligodendrocytes.
- Les cellules TMEM119-positives expriment également P2RY12, et vice versa.
- Les deux marqueurs présentent une régulation négative significative ou disparaissent dans les microglies réactives.
- Iba1, CD11b, CX3CR1 et F4/80 sont des marqueurs exprimés à la fois dans les microglies et les macrophages
- Au cours de la neuroinflammation, l'expression de Iba1 et CD11b est généralement stable ou régulée à la hausse lorsque les microglies s'activent (Bottcher, 2019; Bohnert, 2020; Lier, 2021; Ruan, 2022).
- Bien que F4/80 soit présent dans les microglies de souris, il n'est pas présent chez l'homme. Ses profils d'expression peuvent varier dans les microglies réactives (Bottcher, 2019; Boche, 2022).
- Le CX3CR1 est essentiel à la communication entre les neurones et les microglies, avec une expression stable dans les microglies associées à la maladie (DAM) (Bennett, 2016; Boche, 2022)
- Veuillez consulter notre ressource Interactions entre les microglies et les neurones et maladies neurodégénératives pour plus d'informations sur CX3CR1.
Des recherches ultérieures ont étudié la spécificité et ont contribué à la compréhension de TMEM119 dans les microglies (Gonzalez Ibanez, 2019; Lier, 2021; Ruan, 2022; Vankriekelsvenne, 2022) :
- Dans des conditions physiologiques normales, TMEM119 est exclusivement exprimé par les microglies homéostatiques. Cependant, son expression est réduite dans les DAM dans diverses conditions pathologiques.
- TMEM119 est absent dans d'autres cellules résidant dans le cerveau, telles que les neurones et les astrocytes, ainsi que dans les macrophages dérivés de la périphérie qui peuvent infiltrer le SNC. Néanmoins, d'autres types de cellules, comme les cellules dendritiques folliculaires des organes lymphoïdes et du tissu adipeux brun, peuvent être marquées.
- Associé au P2RY12, le TMEM119 permet de distinguer efficacement les microglies humaines des cellules myéloïdes circulantes présentes dans le sang et le liquide céphalo-rachidien (LCR) (Bottcher, 2019).
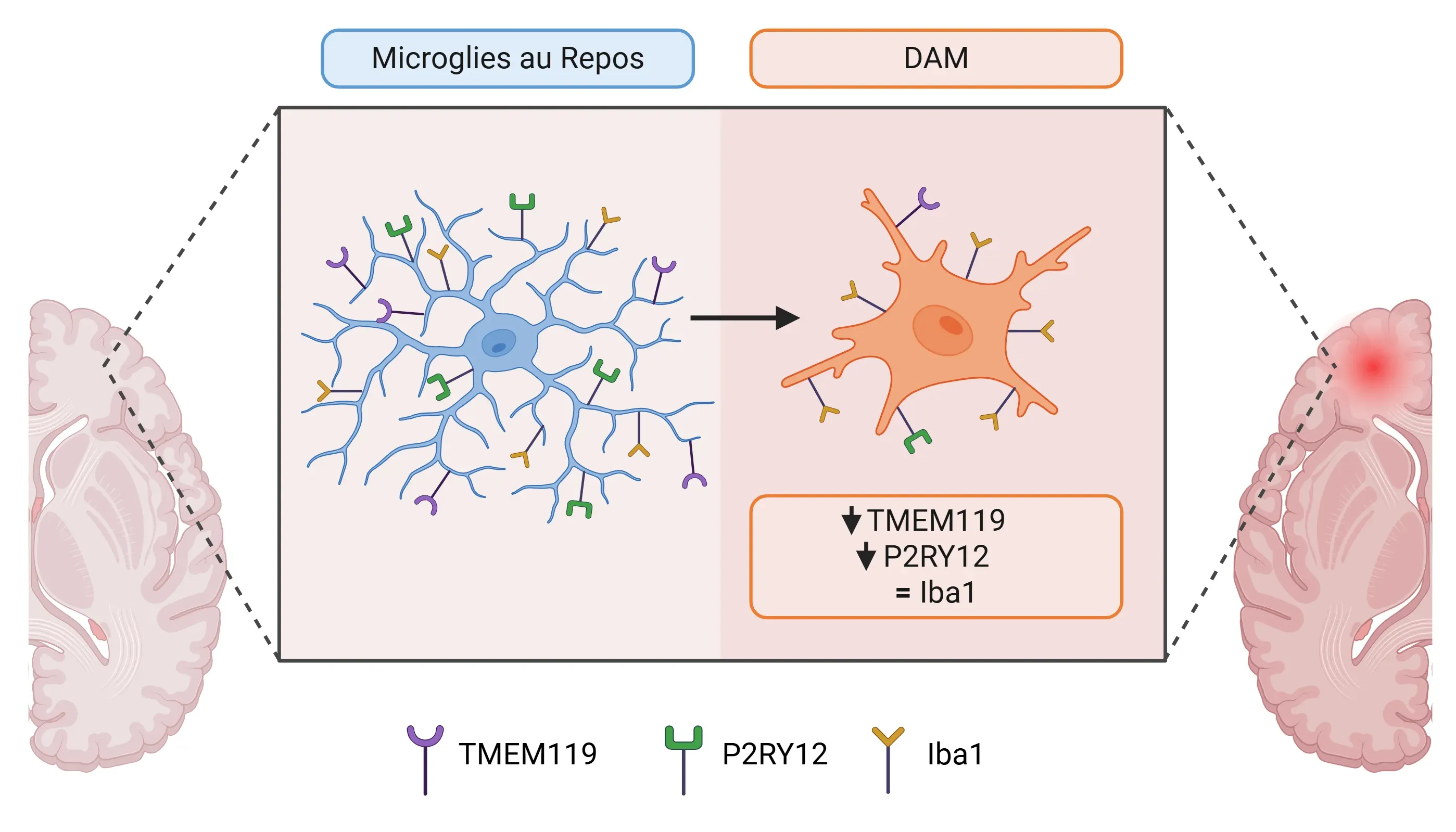
Différences dans l'expression des marqueurs entre les microglies au repos et les microglies associées à la maladie (DAM).
Quel est le rôle de TMEM119 dans la maladie d'Alzheimer ?
En plus de servir de biomarqueur pour les microglies homéostatiques, TMEM119 fait actuellement l'objet d'études sur ses implications fonctionnelles dans la MA à l'aide de modèles murins. Voici quelques informations sur ses implications :
- Liaison et élimination de l'Aβ (Liu, 2025)
- TMEM119 se lie directement aux oligomères Aβ.
- La surexpression de TMEM119 dans les microglies renforce leur capacité de phagocytose, favorisant l'absorption et la dégradation de l'Aβ in vitro et in vivo.
- TMEM119 recrute le récepteur 1 des lipoprotéines de basse densité (LRP1), qui favorise la phagocytose et la dégradation lysosomale subséquente de l'Aβ.
- Maintien de l'homéostasie microgliale (Liu, 2025)
- Une déficience en TMEM119 accélère la transition des microglies homéostatiques vers les DAM.
- Une charge accrue en Aβ réduit l'expression de TMEM119 dans les microglies, ce qui correspond à la progression de la maladie chez les souris.
- Potentiel thérapeutique (Liu, 2025)
- Il a été démontré que l'augmentation de l'expression de TMEM119 à l'aide de Kartogenin et de SRI-011381 favorise l'élimination de l'A&beta et améliore les fonctions cognitives chez les modèles murins de la MA.
Pour plus d'informations sur le rôle des microglies dans la MA, veuillez consulter nos ressources APOE4, microglies et maladie d'Alzheimer et Microglies, astrocytes et protéine tau dans les maladies neurodégénératives.
Modèles d'expression de TMEM119 dans la MA
L'étude de l'expression de TMEM119 dans le contexte de la MA est complexe. L'expression de TMEM119 est souvent réduite en réponse à diverses affections neurologiques (Masuda, 2019; Kenkhuis, 2022; Mercurio, 2022; Liu, 2025). Dans la MA, les microglies associées aux plaques amyloïdes bêta (Aβ) passent d'un état homéostatique à un phénotype neurodégénératif DAM ou microglial. Dans cet état réactif, l'expression des marqueurs homéostatiques, tels que TMEM119 et P2RY12, est considérablement réduite, ce qui complique la compréhension du rôle de TMEM119 dans la MA (Hashioka, 2022). Plus précisément, les observations suivantes ont été faites :
- Il existe une diminution significative de l'expression de TMEM119 dans les microglies situées à moins de 25 µm d'une plaque A&beta, tandis que les microglies plus éloignées (≥ 50 µm) présentent rarement une expression réduite (Liu, 2025). Veuillez consulter notre ressource « Amyloïde-&beta ; et microenvironnement inflammatoire chez les souris Alzheimer » pour plus d'informations sur l'analyse du microenvironnement.
- Chez les patients humains atteints de MA, on observe une perte globale significative des phénotypes microgliaux TMEM119-positifs, quelle que soit leur proximité avec les plaques Aβ (Kenkhuis, 2022).
- Des résultats contradictoires ont été rapportés entre les analyses tissulaires et cellulaires dans les cerveaux humains atteints de MA (Satoh, 2016; Kenkhuis, 2022)
- Les analyses tissulaires montrent une augmentation de l'expression de l'ARNm TMEM119.
- Les microglies réactives isolées présentent une expression réduite de TMEM119.
- Une perte d'expression de TMEM119, associée à une augmentation de TREM2, est une caractéristique de la réponse microgliale aux plaques Aβ
- Pour plus d'informations, veuillez vous référer à notre ressource TREM2, microglies et neuroinflammation.
Le rôle de TMEM119 dans les microglies dans le contexte de la MA fait actuellement l'objet d'études. Il reste essentiel de différencier les microglies des DAM et des autres cellules myéloïdes afin de mieux comprendre le développement de la MA et de mettre au point des traitements ciblés (Hashioka, 2022).
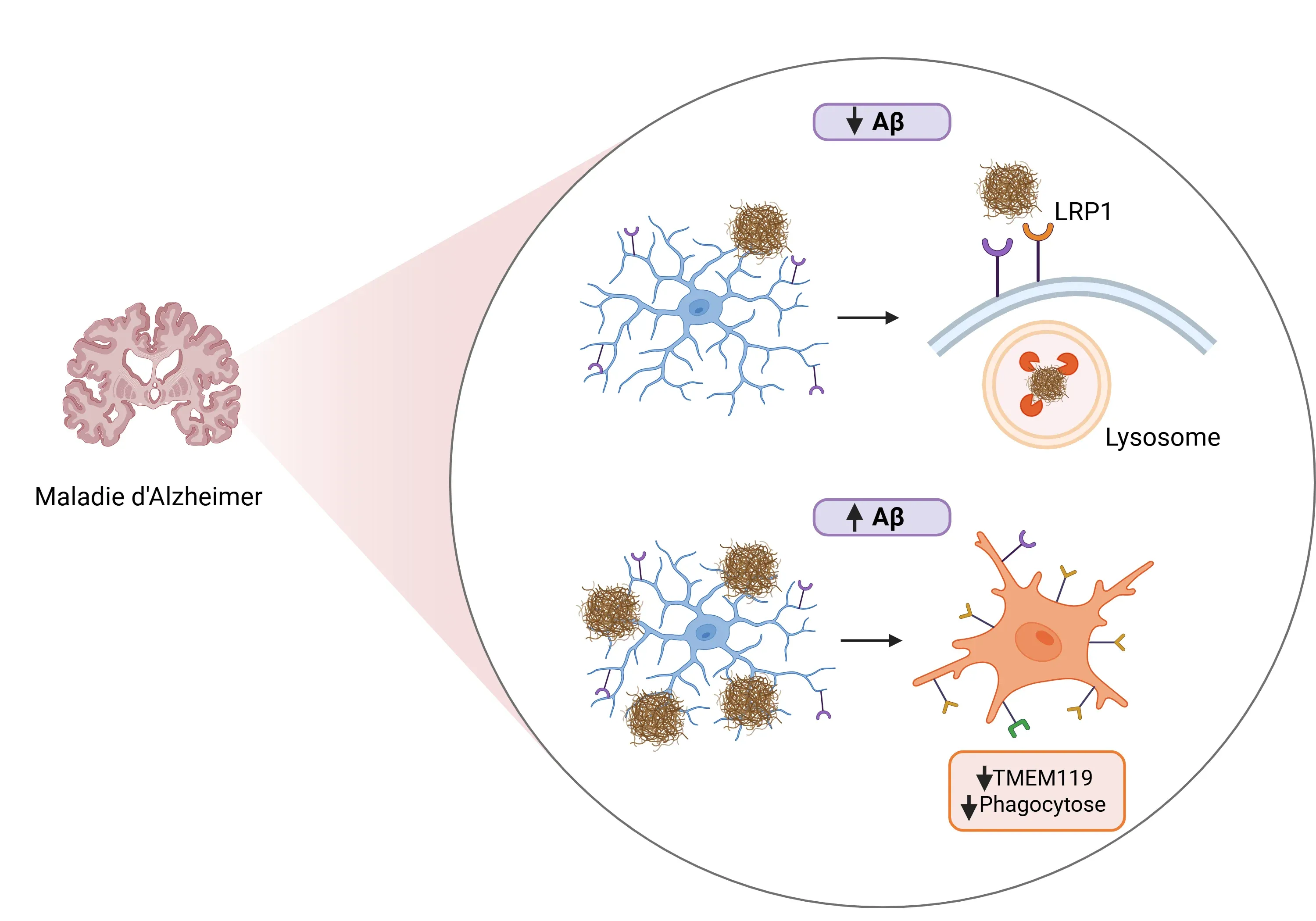
Le rôle de TMEM119 dans la maladie d'Alzheimer (MA) dans des conditions de faibles et de forts niveaux d'amyloïde bêta (Aβ).
Quel est le rôle de la protéine TMEM119 microgliale dans d'autres pathologies ?
Le rôle de la protéine TMEM119 microgliale dans les conditions pathologiques autres que la MA est principalement celui d'un marqueur spécifique des microglies. Dans les conditions où la barrière hémato-encéphalique (BHE) est compromise, le TMEM119 est exprimé de manière fiable par les microglies, mais est absent des macrophages infiltrés provenant du sang (Kempuraj, 2024). Bien que ses fonctions spécifiques restent floues, l'expression du TMEM119 peut être à la fois régulée à la hausse et à la baisse dans différentes conditions pathologiques :
- Maladies neurodégénératives
- Sclérose en plaques (SEP)
- L'immunoréactivité de TMEM119 est considérablement réduite ou absente au centre des lésions actives de la substance blanche (WML), mais reste inchangée dans les lésions de la substance grise. La régulation à la baisse des WML est corrélée à la présence de lymphocytes et de cytokines inflammatoires, comme l'IFNγ et l'IL-4 (van Wageningen, 2019).
- Dans les lésions démyélinisantes actives, les macrophages infiltrants expriment Iba1 mais sont négatifs pour TMEM119 (Satoh, 2016).
- Modèles d'encéphalomyélite auto-immune expérimentale (EAE)
- L'expression de TMEM119 diminue de manière significative parallèlement à l'augmentation de l'activation microgliale (Vankriekelsvenne, 2022).
- Sclérose en plaques (SEP)
- Traumatisme crânien (TBI)
- Le nombre de cellules TMEM119-positives est le plus élevé dans les cas de TBI aiguë, revenant à des niveaux normaux dans les cas retardés (Bohnert, 2020).
- Des résultats contradictoires ont été rapportés (Mercurio, 2022)
- Régulation à la hausse du gène TMEM119 dans le tissu cérébral après une lésion.
- Réduction des niveaux d'ARNm et de protéines dans les microglies réactives isolées.
- Accident vasculaire cérébral
- L'immunofluorescence et l'immunoréactivité du TMEM119 sont considérablement réduites dans les microglies des régions cérébrales proches de l'infarctus, y compris le noyau ischémique et la pénombre (Young, 2021).
- Les auteurs ont rapporté qu'en raison de cette régulation à la baisse dans les microglies ramifiées, TMEM119 n'est pas un marqueur stable dans les modèles précliniques d'AVC, ce qui limite son utilisation pour différencier les microglies des macrophages infiltrants dans ce contexte (Young, 2021).
- Métastases cérébrales
- L'expression génique et protéique de TMEM119 est considérablement réduite dans les microglies associées aux métastases cérébrales par rapport à celles présentes dans les tissus cérébraux sains (Ma, 2024).
- Cette régulation à la baisse sert de marqueur de l'état d'activation des microglies associées aux tumeurs (Ma, 2024).
- Cancer
- Le TMEM119 pourrait présenter des fonctions pro-tumorales, son expression étant accrue dans divers cancers, notamment l'ostéosarcome (Jiang, 2017), le cancer de l'ovaire (Sun, 2021) et le cancer du sein (Yang, 2021).
- Sa régulation à la hausse est systématiquement associée à la progression tumorale, aux métastases et à une faible survie des patients.
En conclusion, bien que TMEM119 puisse être utilisé comme marqueur des microglies, il existe des limites importantes à prendre en compte. Tout d'abord, toutes les microglies ne sont pas marquées par TMEM119 (par exemple, DAM), ce qui limite l'étude des microglies dans diverses conditions neurologiques. De plus, TMEM119 ne marque pas exclusivement les microglies. Par exemple, il peut également marquer les cellules dendritiques folliculaires dans les organes lymphoïdes et le tissu adipeux brun. Compte tenu de cette complexité, il est avantageux d'utiliser TMEM119 en combinaison avec d'autres marqueurs, tels que Iba1 et P2RY12, afin de caractériser plus précisément les divers phénotypes des microglies, tant chez les individus en bonne santé que chez ceux atteints de maladies.
Notre équipe se fera un plaisir de répondre à toutes vos questions ou de vous fournir des informations spécifiques sur les modèles de maladies neurodégénératives que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur la neuroinflammation et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de maladies neurodégénératives.
TREM2 et microglies
Présentation générale du TREM2, de son rôle dans les microglies, de ses liens avec les maladies neurodégénératives et de ses implications potentielles en matière de traitement.
APOE4, microglies et maladie d'Alzheimer
Présentation générale de l'influence de l'ApoE4 sur l'activité microgliale dans la maladie d'Alzheimer et le développement de traitements ciblés.
Microglie, astrocytes et protéine tau dans les maladies neurodégénératives
Comment la neuroinflammation induite par les cellules gliales favorise l'agrégation et la propagation de la protéine tau ainsi que la perte neuronale dans la maladie d'Alzheimer et d'autres tauopathies.
Microglie, astrocytes et α-synucléine dans la maladie de Parkinson
Comment l'α-synucléine influence les microglies et les astrocytes dans la maladie de Parkinson et d'autres synucléinopathies.
Morphologie de la microglie dans la SLA, la maladie d'Alzheimer et la maladie de Parkinson
Une vue d'ensemble de l'analyse morphologique des microglies et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.
Interactions entre les microglies et les neurones et maladies neurodégénératives
Une revue concise des interactions directes entre les microglies et les neurones, et de la manière dont ces interactions intercellulaires peuvent être affectées dans les maladies neurodégénératives.
Altération de l'autophagie de la microglia dans les maladies neurodégénératives
Comment l'altération de l'autophagie microgliale contribue à la progression des maladies neurodégénératives.
Sénescence microgliale et maladies neurodégénératives
Cette ressource fournit un aperçu de la sénescence microgliale et de son rôle dans les maladies neurodégénératives, notamment la maladie d'Alzheimer (MA) et la maladie de Parkinson (MP).