神経変性疾患においてミクログリアとアストロサイトはどのように相互作用しますか?
ミクログリアとアストロサイトは、中枢神経系(CNS)内の恒常性維持と損傷への応答に不可欠な役割を果たす、2つの主要なグリア細胞です。両細胞は脳の免疫応答に寄与し、神経変性疾患の共通特徴である神経炎症において重要な役割を果たしています。
ミクログリア
ミクログリアは、卵黄嚢マクロファージから由来し、末梢免疫細胞とは異なるCNSの主要な免疫細胞です(Ginhoux, 2010;Leavy, 2010)。彼らは高度に動的で、特異的な受容体レパートリーを用いて脳の微小環境を常に監視しています(Qin, 2023)。ミクログリアは、食作用、シナプス剪定、神経機能調節に関わるシグナル分子分泌に不可欠です(Gao, 2023)。
最近の研究進展により、ミクログリアの多様な状態が明らかになり、従来のM1(炎症促進型)とM2(炎症抑制型)の二分法を超えた分類が提案されています。代わりに、ミクログリアは環境刺激、遺伝的要因、疾患の進行に応じて変化する機能的表現型のスペクトラムを示すことが示されています。例えば、アルツハイマー病(AD)では、疾患関連ミクログリア(DAM)がアミロイド斑の近傍に局在し、アミロイドβ凝集体の除去に寄与します(Keren-Shaul, 2017;Gao, 2023)。一方、ミクログリアの持続的な活性化は、過剰なサイトカイン産生を引き起こし、シナプス機能の障害や神経細胞の損傷を悪化させます(Kwon, 2020)。ミクログリアはまた、ADではタウやアミロイドβ、パーキンソン病(PD)ではアルファシヌクレインなどの異常なタンパク質を拡散させることで神経変性を促進する細胞外小胞を放出します(Gao, 2023)。
アストロサイト
アストロサイトは中枢神経系(CNS)で最も豊富な神経細胞であり、恒常性維持、血流調節、シナプス伝達支援に不可欠です。また、血液脳関門(BBB)の調節に積極的に関与し、グリムファティックシステムの重要な構成要素であり、シナプスおよび神経細胞の機能、細胞外イオンおよび神経伝達物質のバランス制御、死細胞の除去に重要な役割を果たしています(アボット、2010 年、スウィーニー、2018 年、クォン、2020 年)。
ミクログリアと同様に、アストロサイトも保護から有害に至るまでの反応状態にあることがあります。炎症誘発性アストロサイト(A1 表現型)は、IL-1β、TNF-α、補体カスケードタンパク質などのサイトカインを放出します。これらのサイトカインは、ニューロンやシナプスに損傷を与えることが知られています。一方、抗炎症性アストロサイト(A2 表現型)は、神経栄養因子やその他の保護分子を分泌することで、神経細胞の生存と修復を促進します。アストロサイトの機能障害は、神経変性疾患でよく見られ、多くの場合、神経炎症を悪化させ、疾患の進行に寄与します(Kwon、2020)。
例えば、アルツハイマー病(AD)では、アストロサイトの活性化はグルタミン酸のクリアランス障害と関連し、興奮毒性と神経細胞死を引き起こします。さらに、ミクログリアのサイトカインによって誘導された反応性アストロサイトは、血液脳関門(BBB)を損ない、神経細胞の脆弱性をさらに悪化させます(Kwon, 2020)。同様に、筋萎縮性側索硬化症(ALS)では、C3などの毒性因子を発現する反応性アストロサイトが運動神経細胞の変性に寄与します(Gao, 2023)。
ミクログリア-アストロサイト相互作用
ミクログリアとアストロサイトは、中枢神経系(CNS)の恒常性維持に不可欠であり、損傷や疾患への応答において重要な役割を果たします。これらの相互作用は高度に動的であり、状態や環境的文脈に応じて、神経炎症や神経変性を保護的または有害な方向に影響を与える可能性があります(Liu, 2020;Kim, 2021;Gotoh, 2023)。病理学的刺激に応答して、ミクログリアは活性化し、IL-1α、TNF-α、C1qなどのプロ炎症性因子を放出します。これらの分子は、アストロサイト反応性A1フェノタイプへの移行を促進し、ミクログリアの活性化を維持する追加のプロ炎症性サイトカインの放出を引き起こします。この相互シグナル伝達は、炎症を拡大し神経変性プロセスを加速する有害なフィードバックループを確立します(Gao, 2023)。この反応状態において、ミクログリアはシナプス剪定を増加させます。このプロセスは通常、神経回路の精緻化に不可欠ですが、炎症条件下では有害となる可能性があります。同時に、アストロサイトは神経細胞に補体タンパク質の放出を刺激し、これによりミクログリアがさらに活性化され、シナプスや甚至いは神経細胞全体を貪食し、神経細胞の喪失に寄与します(Sierra, 2013)。この炎症の悪循環は、血液脳関門(BBB)を破壊し、その保護機能を弱め、B 細胞、T 細胞、単球などの末梢免疫細胞が CNS に浸潤することを可能にする。これらの浸潤細胞は、グリア細胞からのサイトカインの放出を増強することで炎症を悪化させ、神経組織にさらなる損傷を与える持続的な免疫活性化環境を作り出す(アボット、2010 年、スウィーニー、2018 年)。
こうした有害な相互作用にもかかわらず、ミクログリアとアストロサイトは、保護および再生プロセスを促進する能力も持っています。特定の条件下では、ミクログリアは IL-10 シグナル伝達を通じてアストロサイトに抗炎症性 A2 表現型を誘導し、組織損傷を制限して修復を促進する、より回復的な環境を作り出すことができます(Mohammad、2024)。中枢神経系の損傷後、アストロサイトは増殖を増やし、「グリア瘢痕」と呼ばれる物理的なバリアを形成します。このバリアは、損傷部位を封じ込め、さらなる組織損傷を防ぐ役割を果たします。この瘢痕は、神経の再生を阻害する場合もありますが、回復の初期段階において中枢神経系の環境を安定させる上で重要な役割を果たしています。瘢痕形成以外にも、ミクログリアとアストロサイトは、細胞外マトリックス(ECM)の再構築、血管新生、および血管新生をサポートする因子を放出します。これらのプロセスは、神経細胞の生存に適した環境を創出し、損傷した神経細胞を置き換えるための幹細胞の移動を促進し、失われた接続を回復するための軸索の再構築を助けます(Yang, 2019;Heithoff, 2021)。
最終的に、ミクログリアとアストロサイトの相互作用は複雑で厳密に調節されており、プロ炎症性シグナルと抗炎症性シグナルのバランスによって結果が大幅に異なる可能性があります。これらの相互作用は、損傷や疾患後に有害な炎症と神経細胞の喪失を促進する可能性がありますが、修復を促進し、CNSの恒常性を回復するためにも同様に重要です。これらの二重の役割を理解することは、神経変性損傷を軽減しつつ、CNSの固有の再生能力を強化する戦略を開発するために不可欠です。
神経炎症はタウ病とどのように関連していますか?
タウ病は、細胞内フィブリル状凝集体に過リン酸化タウタンパク質が進行性蓄積する神経変性疾患のグループです。これらの凝集体は、アイソフォームの組成、構造的コンフォメーション、局在に多様性を示し、主に神経細胞内に沈着します。タウ病は、タウ沈着が主な病理学的特徴である一次型と、二次型に分類されます。一次型には、進行性核上性麻痺(PSP)、皮質基底核変性症(CBD)、前頭側頭型認知症(FTD)など;二次性型では、アルツハイマー病(AD)におけるアミロイドβのような追加の病理学的要因が関与します;地理的型には、グアドループ型パーキンソン症候群(Lannuzel, 2007)などが含まれます。病気の進行に伴い、タウタンパク質は翻訳後修飾を受け、βシート豊富な凝集体に誤って折りたたまれ、プリオン様メカニズムを通じて元の沈着部位から解剖学的に接続された領域へ伝播します。このプロセスには、タウプロテオパシックシードがタウモノマーを募集するメカニズムが関与しています(Jucker, 2018)。グリア細胞(ミクログリアやアストロサイトを含む)は、当初、細胞外タウを貪食し保護因子を放出することで損傷を軽減しようとしますが、慢性的な曝露により反応性状態に移行します。これらの反応性状態は、NF-κB経路の活性化、炎症小体駆動型転写、過剰なサイトカイン放出、リソソームクリアランスの障害、およびシナプス剪定の異常によって特徴付けられます。このような持続的な神経炎症状態は、タウのシード形成を促進し、神経機能障害を加速し、認知機能低下と密接に関連し、タウ病の進行をさらに悪化させます。
ミクログリアは神経変性疾患におけるタウ病理にどのように関与していますか?
炎症促進性ミクログリアと機能低下性ミクログリアが、タウ病理と神経変性に異なる役割を果たすという点で、近年合意が形成されつつあります(Streit, 2014;Angelova, 2019;Odfalk, 2022)。Odfalkは、最近のレビュー「Microglia: Friend and foe in tauopathy」(Odfalk, 2022)において、このパラダイムを非常に簡潔に指摘しています。病気の初期段階では、ミクログリアは保護的な役割を果たします。彼らは変性した神経突起に向かって移動し、死滅する神経細胞から放出される可溶性および線維状のタウを貪食し、組織の恒常性回復を助ける抗炎症性メディエーターを分泌します。しかし、この有益な監視状態は脆弱です。持続的なプロテオパシーストレス、加齢に伴うプライミング、遺伝的リスクアレル、および/または合併する脳血管障害が、ミクログニアを疾患関連ミクログニア(DAM)フェノタイプへと誘導します。DAMは、恒常性マーカーの発現を低下させると同時に、パラドックス的にタウの取り込み、細胞内断片化、およびより種形成能の高いタウ種の放出を促進するファゴリソソーム系および脂質代謝関連遺伝子の発現を上昇させます。
ミクログリアのファゴサイトーシスがタウの除去に積極的な役割を果たすことは、多くの証拠によって示されています(Luo, 2015;Bolós, 2017;Leyns, 2017)。ミクログリアの表現型を変化させることで神経炎症を軽減すると、タウ病理が改善することが実験的に示されています。具体的には、TNFαの抑制(Gabbita, 2015)または3xTgADマウスにおけるIL-1シグナル伝達阻害(Kitazawa, 2011)による方法が報告されています。ミクログニアが、その恒常性機能の調節異常を含む多様なメカニズムを通じてタウ病理の進行に直接寄与する証拠もあります(Perea, 2018;2020)。例えば、ミクログニアはタウシードの細胞間伝達を促進し、その後凝集体を形成します。このメカニズムは、Asaiらによってミクログニアの除去がタウの伝播を減少させることを示した研究で支持されています(Asai, 2015)。さらに、プラーク関連ミクログリアがトランスジェニックマウスモデルにおいてタウの伝播を促進するという説得力のある証拠があります(Clayton, 2021)。
タウ病変の文脈において正常と病理的なバランスの例として、フラクタルキネ受容体CX3CR1の役割が挙げられます(Perea, 2018)。正常な状態では、ミクログニアは休眠状態にあり、神経細胞に発現するCX3Cリガンド(CX3CL1)(Jiang, 2023)とミクログニアに発現する受容体(CX3CR1)(Bhaskar, 2010;Zhan, 2014;Maphis, 2015)が相互作用し、正常な機能を維持しています。この軸は、CX3CL1の膜結合型と可溶型がミクログリア受容体CX3CR1に結合することで維持され、適切な免疫機能を確保しています。細胞外タウが存在すると、ミクログリアが活性化し、CX3CL1/CX3CR1軸の影響を受けて、過剰なタウをファゴサイトーシスにより除去しようとします。アルツハイマー病では、病理の進行と神経細胞死の増加に伴い、細胞外タウの著しい蓄積が生じ、CX3CL1/CX3CR1経路の正常な機能を妨げます。過剰なタウはCX3CL1とCX3CR1への結合を競合し、これによりミクログリアのタウ除去機能が障害されます(Bolós, 2017)。これに対し、ミクログニアは過活性化し、増殖し、CX3CL1とCX3CR1の産生を増やすことで補償を試みます。しかし、この増加にもかかわらず、CX3CL1/CX3CR1軸は機能障害を起こし、さらにタウの蓄積と疾患の進行を促進します。この機能障害を起こしたミクログニアの応答は、免疫調節の複雑な役割を浮き彫りにしています。
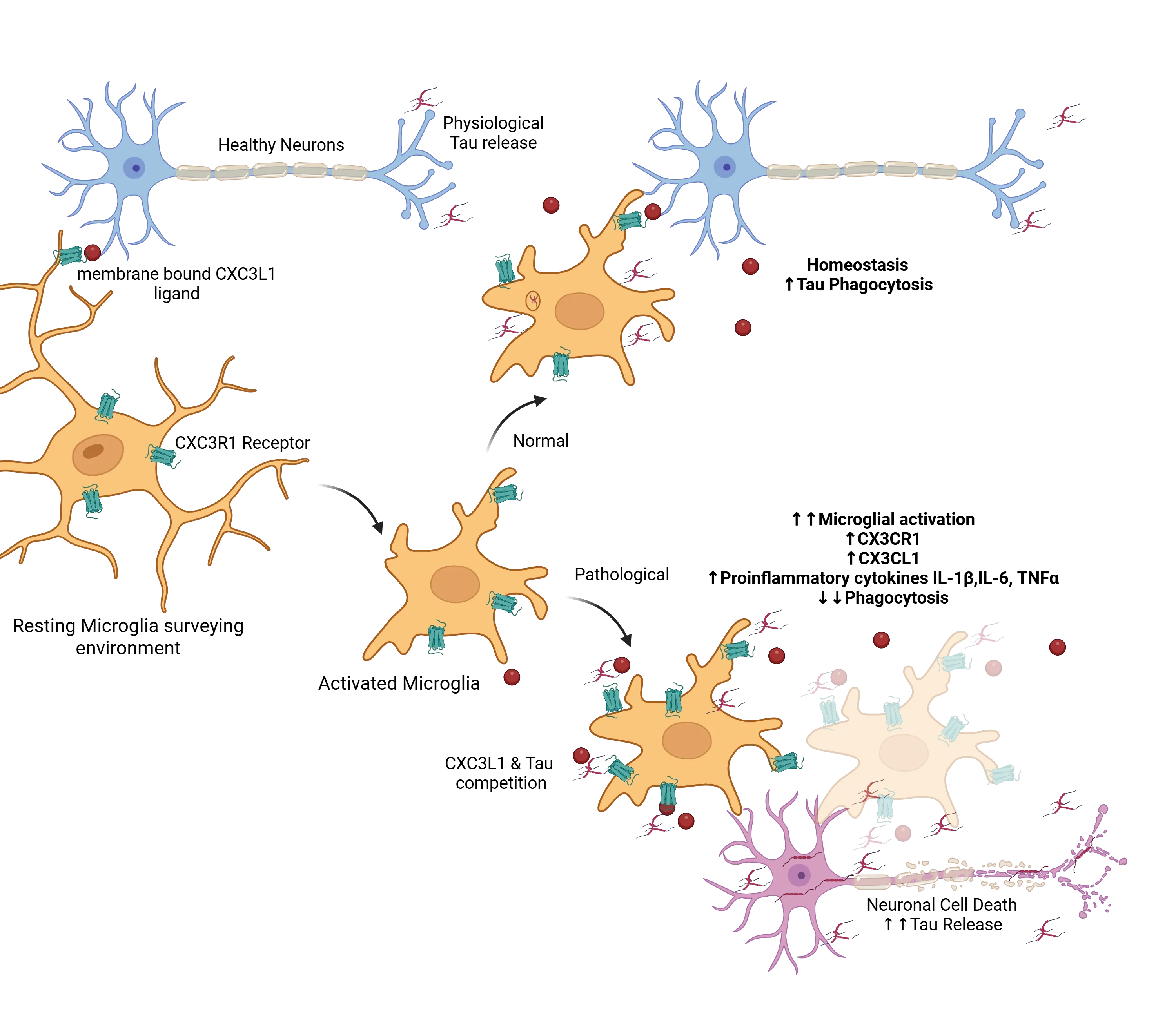
CXCL1/CXC3R1 などのシグナルは、ミクログリアが周囲の環境を監視する際に、その休眠状態を維持するのに役立ちます。細胞外タウが存在する場合、これらのミクログリアは活性化され、正常な状態ではタウを貪食し、恒常性の維持に貢献します。病理状態下では、過剰なタウがCXCL1/CXC3R1相互作用と競合し、活性化されたミクログリアを機能不全状態に押し込みます。これにより、活性化が増加し、貪食作用が低下し、タウのクリアランスが減少します。その結果、細胞外タウの蓄積が増加し、毒性サイクルがさらに悪化するのです。図はPereaら( Perea, 2018)から、 クリエイティブ・コモンズ・アトリビューション・ライセンスに基づき転載しました 。
アストロサイトはどのようにタウ病理を増幅し伝達するのでしょうか?
アストロサイトは、神経機能障害の影響を受ける受動的な成分としてではなく、タウの恒常性調節と脳領域への病理学的拡散の両方に積極的に関与する中心的な役割を果たす細胞として、ますます認識されるようになってきました。最近の研究では、アストロサイトがタウの内部取り込みに複雑なメカニズムを介して関与し、その蓄積と除去に影響を与えることが示唆されています。これらのグリア細胞は二重の役割を果たしています:一方では、細胞外タウの負荷を軽減しようとする緩衝作用を発揮し、他方では、その機能障害や過剰活性化がタウの凝集と拡散を拡大する可能性があります。この微妙な役割は、神経変性疾患におけるタウ動態の調節を目的とした治療的介入の標的としてアストロサイトが注目される理由を浮き彫りにしています(Reid, 2020)。
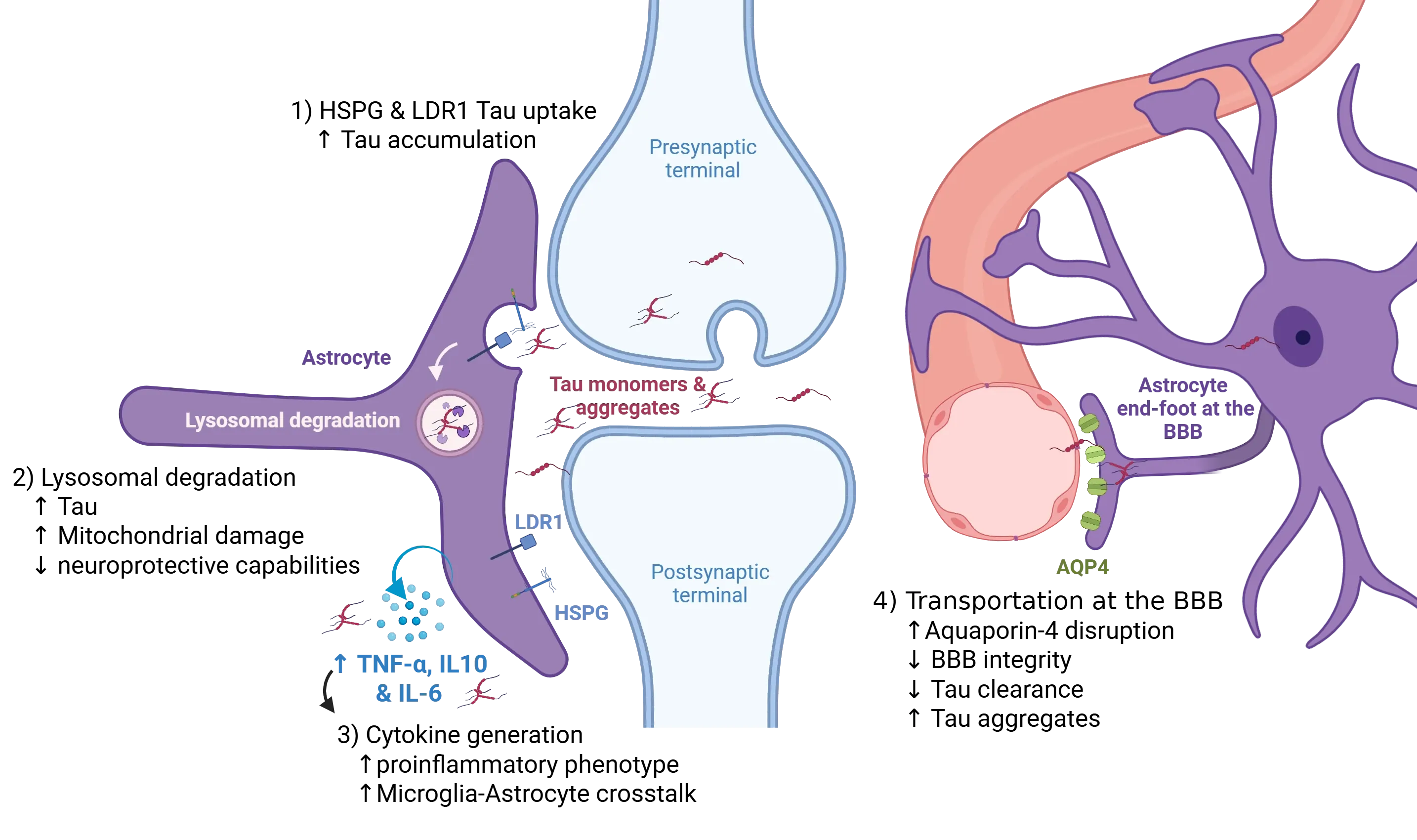
アストロサイトは、中枢神経系におけるタウ病理の伝播を調節する重要な役割を果たしています。神経細胞は、前シナプスにおける小胞分泌やシナプス放出など、複数の経路を通じてタウ種を細胞外空間に放出します。シナプス周囲のアストロサイトは、受容体介在性エンドサイトーシスを介して細胞外タウを内取り込みます。このプロセスは主に、凝集したタウを優先的に結合する特定のヘパラン硫酸プロテオグリカン(HSPGs)およびモノマーとオリゴマーの両方のタウの取り込みを仲介する低密度リポタンパク質受容体関連タンパク質1(LRP1)を介して行われます(1)。これらの経路の障害は、細胞外タウのクリアランスと蓄積のバランスを崩し、タウの拡散を促進する可能性があります。内取り込まれたタウは、リソソームへ輸送され分解されます(2);しかし、内在性過剰負荷や病理学的シグナル伝達によるリソソーム機能の障害は、細胞内タウの蓄積と種形成能を有する凝集体の形成を引き起こします。並行して、腫瘍壊死因子アルファ(TNF-α)やインターロイキンIL-10およびIL-6などのサイトカインの増加を特徴とする炎症性環境は、アストロサイトの反応性を増強し、アストロサイトとミクログリアの相互作用を促進します(3)。これにより、病原性タウ種のプールが増加し、その拡散が促進されます。さらに、血管周囲アストロサイト終末脚におけるアクアポリン-4(AQP4)の局在化が障害されると、タウのグリフマティッククリアランスが損なわれます(4)。この血管周囲のクリアランス機構の障害は、細胞外タウの進行性蓄積を引き起こし、脳実質全体へのタウ病理の拡散を悪化させます。図はReidet al.(Reid, 2020)より、クリエイティブ・コモンズ・アトリビューション・ライセンスの下で引用しました 。
シナプスにおいて、神経細胞はシナプス間隙周辺に単量体および凝集したタウを放出します。これらのタウは、アストロサイトによって受容体介在性エンドサイトーシス(Reid, 2020)を介して迅速に捕捉されます。アストロサイトは、線維状タウに対してナノモル濃度での親和性を示す高度に硫酸化されたヘパラン硫酸プロテオグリカン(HSPGs)を特有に備えており、これらはタウを効率的にエンドリソソーム分解経路へ誘導します(Puangmalai, 2020)。この能力は、リソソーム調節因子TFEBの上昇により強化され、アストロサイトの リソソームコンパートメントを拡大し、取り込んだタウの処理能力を高めます(Martini-Stoica, 2018)。注目すべきは、アストロサイトのタウ取り込みがフィブリルに限定されない点です。低密度リポタンパク質関連タンパク質-1(LRP1)はHSPGsと協調して、モノマーおよびオリゴマーのタウを内取り込み、アストロサイトが管理できるタウの種を拡大します(Reid, 2020)。このアストロサイトメカニズムは、当初はシナプスタウの除去と恒常性維持に機能しますが、皮肉なことに、細胞内タウ凝集体の貯蔵庫を形成します。これらの種形成能を有する凝集体は、その後放出され、プリオン様伝播を拡大し、アストロサイトを、シナプスタウのバランスを維持する保護者と、その病理学的拡散に寄与する双重の役割を担う存在として位置付けます。
血液脳関門におけるアストロサイトは、特にグリフマティック系との接続を通じて、タウの除去に重要な役割を果たす可能性があります。その血管周囲の終末足は、水チャンネルタンパク質アクアポリン-4(AQP4)が豊富に存在し、間質液の移動を促進し、グリフマティック交換を駆動します(Sun, 2025)。このシステムは、脳内の可溶性タウを除去し、タウ病理を軽減します。しかし、AQP4の機能障害(遺伝的欠失、局在異常、睡眠断片化、老化など)は、グリフマティック流量を阻害し、BBBの完全性を低下させ、タウの除去を減少させ、細胞外タウの蓄積と凝集を悪化させます。一方、AQP4の極性を回復したり、グリフマティック機能を強化したりする介入は、前臨床研究においてタウ負荷の軽減と認知機能の改善に有望な結果を示しています(Zhou, 2025)。例えば、行動修正、薬物療法、神経調節法など、グリフマティックポンプ機能とAQP4の発現を最適化する標的アプローチは、治療可能性を示す説得力のある証拠を提供しています(Sun, 2025)。
グリア細胞を介したタウ凝集体のクリアランスは治療的に強化できるでしょうか?
タウ凝集物のミクログリアによるクリアランスを強化する
ミクログリアは、異常なタウタンパク質のクリアランスに重要な役割を果たしています。このクリアランス機能を強化する治療法が研究されています。有望なアプローチの一つはTREM2アゴニストで、ヒトモノクローナル抗体VG-3927が代表例であり、現在第1相用量漸増試験が完了しています。TREM2をリガンドで結合させることで、この療法はミクログリアの恒常性状態を回復し、細胞外タウの貪食性除去を促進することを目的としています。別のアプローチはNLRP3炎症小体阻害で、複数の動物モデルで有望な結果を示しています(Zhang, 2020)。Quanは、NLRP3欠損がタウ転移マウスにおいて神経炎症を軽減し認知機能を改善することを示しました(Quan, 2024)
最も進んだアプローチの一つがTREM2アゴニストです。完全ヒト型IgG1抗体VG-3927は、ヒト初投与の用量漸増試験と薬理動態試験を完了し、脂質感知経路の活性化、ミクログリアの代謝回復、タウの貪食能向上を目的としています。以前の抗体(例:AlectorのAL002、DenaliのDNL-919)は第2相試験で成績が不十分でしたが、更新されたTREM2アゴニストであるNovartisのVHB937は2024年にアルツハイマー病と筋萎縮性側索硬化症(ALS)を対象とした臨床試験を開始し、このアプローチへの継続的な期待を示しています。受容体アゴニスト療法と補完的に、脳透過性小分子MCC950によるNLRP3炎症小体阻害は、IL-1βの成熟を抑制し、下流のケモカインカスケードを抑制します。薬物動態が改善された複数の次世代NLRP3阻害剤が、IND申請可能な研究段階に進展しています。
TREM2がミクログリア機能に果たす役割に関する詳細なレビューについては、以下を参照のこと:TREM2とミクログリア
免疫療法アプローチ
タウを標的とした活性免疫療法と受動免疫療法が開発中で、細胞外タウの環境を再構築することでミクログニア機能の調節に有望です(Jadhav, 2019)。ペプチドやmRNAワクチンなどの能動的免疫療法と、ヒト化抗体を含む受動的免疫療法は、可溶性タウシードを選択的に除去することを目的としています。シード能を有するコンフォーマーや断片を減少させることで、これらの療法はミクログリアの活性化を間接的に影響し、過剰な神経炎症を引き起こさずにタウ凝集体の取り込みとクリアランスを促進します。特定の病原性タウ種を標的とする第2世代抗体は、第1相~第2相臨床試験を進めており、その成功はミクログニアが抗体オプソニン化タウを処理する効率に一部依存しています。これらの戦略は依然として初期段階にありますが、進行中の研究は、タウ関連神経変性疾患の治療におけるその可能性をさらに精緻化しています。
アストロサイト標的:グリフマティックフローからプロテオスタシスへ
アストロサイトは、AQP4依存性血管周囲交換を介して間質溶質の大量クリアランスを促進し、変性タウをシャペロンする熱ショックタンパク質を分泌します(Zhou, 2025)。AQP4の極性の上昇を実験的に誘導したり、アストロサイトのTFEB(リソソーム生物合成の主要な調節因子)を薬理学的に活性化したりすると、マウスタウ病モデルにおけるタウの除去が加速され、現在、TFEBアゴニストやAQP4モジュレーターを用いた小分子化合物の探索が進められています(Verkman, 2013)。さらに、ミクログリアが放出するサイトカイン(例:IL-33駆動型脂質クリアランスプログラム)の星状細胞への変換は、双方向のグリア間クロストークを潜在的な治療アプローチとして浮き彫りにしています(Carlock, 2017;Sun, 2021)。
タウの翻訳後処理の代謝調節
炎症を超えて、タウそのものの代謝調節は、治療介入の標的として依然として魅力的です 。 O-GlcNAcase(OGA)の選択的 阻害は、タウのO-GlcNAcylationを増加させ、これにより病理学的リン酸化と凝集を立体的に阻害します(Kielbasa, 2024;Selnick, 2019;Wang, 2020)。経口投与可能な強力で選択的な小分子OGA阻害剤であるMK-8719は、PSPにおける第1相b試験に進展しましたが、早期の有効性シグナルは限定的でした。しかし、髄液(CSF)の薬力学バイオマーカーは、標的への強力な結合を確認しました。2つ目のOGA阻害剤であるセペログナスタット(旧MK-8722)は、2025年2月にイーライリリーにより、ADコホートにおける治療域未満の曝露量のため開発が中止されましたが、構造と活性の最適化は継続中です。重要な点は、これらの代謝介入は機能的なグリアプロテオスタシス機構に依存しており、ミクログリアとアストロサイトの支援が最大治療効果の必須条件であることを再確認しています。
展望
受容体アゴニスト、炎症小体阻害、免疫療法、代謝調節からのデータは、共通のテーマに収束しています。すなわち、グリア細胞は病原性タウを中和する未活用の潜在能力を有していますが、この能力はバランスの取れた恒常性フェノタイプに向けて再調整する必要があります。今後の臨床試験では、グリア状態とタウ負荷のリアルタイム変化を捉えるため、精密な分子標的化と感度の高い液体バイオマーカーおよび画像バイオマーカーを組み合わせる必要があります。単剤のグリア調節剤が臨床的に意味のある疾患進行の遅延をもたらすか、またはタウ標的抗体やアンチセンスオリゴヌクレオチドとの合理的な組み合わせで最も効果を発揮するかは、未解決の課題です。この分野は急速に進化しており、アストロサイトとミクログニアのタウ相互作用を標的とする他の治療候補が調査中である点に注意が必要です。進行中の研究は、タウ病変におけるグリアの複雑な役割を解明し、効果的な疾患修飾療法の開発を目指しています。
当社のチームは、神経変性疾患におけるミクログリア、アストロサイト、タウに関するご質問、または治療効果研究に使用しているアルツハイマー病およびタウオパチーのモデルに関する具体的な情報について、喜んでお答えいたします。
当社の神経変性疾患モデルについて詳しく見る
関連コンテンツ
神経変性疾患におけるミクログリア、アストロサイト、およびタウに関する最新情報、ならびに神経変性疾患の動物モデルにおける治療薬の評価に関するベストプラクティス。
TREM2とミクログリア
TREM2の概要、ミクログリアにおけるその役割、神経変性疾患との関連性、および潜在的な治療への示唆について。
ミクログリアとニューロンの相互作用と神経変性疾患
ミクログリアとニューロンの直接的な相互作用、およびこれらの細胞間相互作用が神経変性疾患においてどのように影響を受けるかについて簡潔にレビューします。
パーキンソン病におけるミクログリア、アストロサイト、およびα-シヌクレイン
α-シヌクレインがパーキンソン病およびその他のシヌクレイン病においてミクログリアおよびアストロサイトに及ぼす影響。
神経変性疾患におけるTNF-αとミクログリア
ミクログリアにおける腫瘍壊死因子-α(TNF-α)の機能と、神経変性進行への寄与についての概要。
NLRP3インフラマソームと神経変性疾患
NLRP3インフラマソームの概要と、アルツハイマー病、パーキンソン病、ALSなどの神経変性疾患におけるその役割について。