什么是预先形成的纤维?
蛋白质聚集是多种神经退行性疾病的核心病理特征,包括 阿尔茨海默病(AD)、 帕金森病(PD)、 额颞叶痴呆(FTD)、 肌萎缩侧索硬化症(ALS)、 进行性核上性麻痹(PSP)、 皮质基底节变性、 多系统萎缩(MSA)以及 亨廷顿病(HD)。
在病理状态下, tau蛋白、 β淀粉样蛋白、 α-突触核蛋白、TDP-43 蛋白及亨廷顿蛋白等会发生错误 折叠,从天然状态 转变为具有毒性的寡聚体和纤维状结构 (Wilson, 2023)。这种错误折叠通过成核聚合或"种子效应"过程实现,即聚集体通过单体逐步添加而生长。
当聚集体规模超过临界阈值——从微小可溶性寡聚体到高度有序的β-片层富集纤维状聚集物——单体进一步添加便具有能量优势 (Koga, 2021)。该过程催生出毒性聚集物,成为 多种神经退行性疾病中 受累 神经元 与胶质细胞内病理性包涵体的主要成分 。
在各类蛋白质聚集形态中,纤维状结构具有显著的动态特性和致病性。纤维通过招募可溶性单体蛋白实现快速延伸,同时作为模板驱动后续聚集反应 (Powers, 2006)。 关键在于,成熟纤维并非静态终产物,而是能自发碎裂为较短的纤维片段。这些片段仍保留作为"种子"的能力, 可在宿主细胞内 诱导 内源性蛋白质的新聚合 (Powers, 2007)。这些种子可通过多种机制在细胞间传播,包括:
- 胞吐作用
- 内吞作用
- 隧道纳米管
- 突触传递
这种自我传播的朊病毒样行为,现已被公认为多种神经退行性疾病中病理现象在互联脑区渐进扩散的统一机制 (Yamaguchi, 2017;Gibbons, 2019)。
预形成纤维(PFFs)是 体外 生成的纤维状集合体,能够在细胞和动物模型中重现疾病相关聚集体的结构和生化特性。PFFs具有强大的种子活性,使其能够招募内源性可溶性蛋白质,并在引入生物系统时诱导细胞内聚集体的形成 (Uemura, 2025)。
因此,基于PFF的模型能重现人类神经退行性病理的关键特征,包括疾病相关蛋白的错误折叠、种子形成、聚集与传播,以及下游神经毒性和神经炎症 (Majid, 2023)。
开发准确、可靠且具有生理相关性的疾病模型,对于阐明驱动神经退行的分子机制、评估治疗干预的有效性及候选药物的安全性至关重要。相较于依赖基因过表达、化学诱导或物理损伤的传统方法,PFF诱导模型具有显著优势:
- 相较于 需长期成熟期的转基因动物模型,能更快速诱导神经退行性病变进程
- 更忠实地再现人类疾病中自然发生的种子形成与扩散过程。
- 可通过明确的时间和空间特征实现病理诱导的精准调控。
- 建立与维护成本低于转基因动物的培育繁殖
- PFF形成过程可标准化并 通过硫黄素T检测、透射电镜或原子力显微镜等手段验证,确保质量与结构的一致性。
- PFF诱导可与转基因或毒素诱导模型结合,更全面地再现疾病的分子与行为特征。
- 适用于从培养神经元、iPSC衍生物到动物实验的 体外 及 体内 系统。
因此,基于PFF的建模为研究神经退行性疾病中蛋白质聚集的起始、传播及后果提供了强大而创新的策略 (Stroo, 2017)。
|
特点 |
Tau PFFs |
β淀粉样蛋白PFFs |
α-突触核蛋白PFFs |
TDP-43 PFFs |
亨廷顿蛋白PFFs |
|
蛋白质类型 | 微管相关蛋白 | 小肽(Aβ 40–42 氨基酸) | 突触前神经元蛋白 | RNA结合蛋白 | 多聚谷氨酰胺扩张蛋白 |
|
疾病模型
|
阿尔茨海默病、额颞叶痴呆及其他tau蛋白病 | 阿尔茨海默病 | 帕金森病、多系统萎缩、路易体痴呆 | 肌萎缩侧索硬化症与额颞叶痴呆 |
亨廷顿病 |
|
| 多种异构体(3R/4R)、突变(P301S、P301L) | 主要为Aβ40/42肽 | 野生型及家族性突变体(A53T) | 野生型与病理性突变体 | 外显子1中的多聚谷氨酰胺扩张 |
|
纤维形态
| 成对螺旋丝(PHFs)、直丝 | 淀粉样斑块/纤维 | 路易体样纤维 | 胞质内包涵体 | 核内及胞浆内包涵体纤维 |
|
种子效率
| 中等,依赖菌株 | 高,快速Aβ聚集 | 高,尺寸依赖性 | 中等至低 | 可变,取决于多聚谷氨酰胺链长度 |
|
细胞靶点
| 神经元、轴突 | 细胞外斑块、神经元突触、神经元 | 神经元突触、神经元 | 神经元与胶质细胞 | 神经元、核与胞质区室 |
本表比较了用于建模多种神经退行性疾病的特征,包括蛋白质类型、建模疾病、蛋白质同工型/突变、纤维形态、种子效率及细胞靶点。
用于研究PFF诱导的种子形成 与 扩散的细胞模型有哪些 ?
PFF细胞模型通常指 体外 细胞系统,其中PFF被用于诱导内源性蛋白质聚集,模拟神经退行性疾病的病理过程 (Volpicelli-Daley, 2014)。在细胞模型中,PFF的形成与传播通常通过以下步骤实现:
- 首先将重组单体组装成纤维状结构,其形态与病理包涵体中的纤维相似。
- 随后PFF经超声处理分解为短片段,再施加于培养细胞。
- 在培养的神经元和胶质细胞内,PFFs会诱导细胞内天然聚集蛋白的聚集。
- 根据PFF类型及其模拟的病理机制,该聚集过程可能引发翻译后修饰(如磷酸化),并形成与疾病状态中相似的致病性包涵体(Stroo, 2017)。
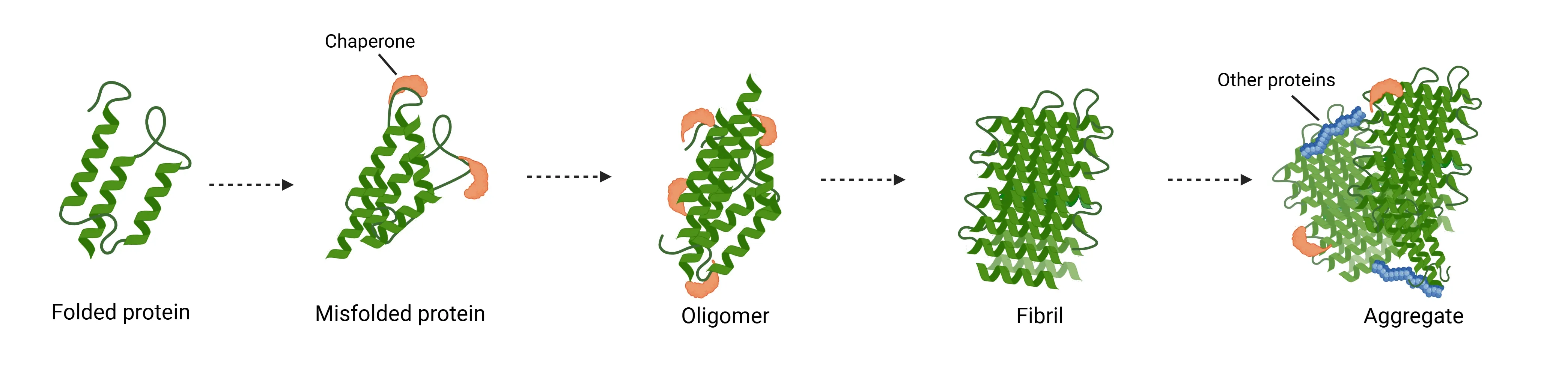
神经退行性疾病中蛋白质聚集的机制。
以帕金森病为例,PFF细胞模型被广泛应用,因为它们无需依赖α-突触核蛋白的过量表达;相反,它们能在生理蛋白水平下诱导聚集,使其更接近人体病理状态 (Benskey, 2016; Uemura, 2025)。
这些模型可用于研究α-突触核蛋白聚集、传播及其相关细胞功能障碍的机制。常用细胞系包括:
- SH-SY5Y人神经母细胞瘤细胞
- 啮齿类动物分离原代神经元
- 人诱导多能干细胞衍生的神经元
这些模型中形成的病理性聚集物具有稳定性,可通过细胞传代持续扩增,重现了突触核蛋白病的关键特征。
目前,在不同缓冲液条件下可生成源自小鼠或人类蛋白质的α-突触核蛋白PFFs(包括野生型和突变型)。 人类α-突触核蛋白纤维亦可通过"接种"反应制备——即添加帕金森病患者样本以促进致病构象扩增 (Wu, 2024)。这些模型在研究细胞摄取途径、炎症反应及检测聚集抑制剂方面发挥了关键作用,并广泛应用于细胞和动物模型以探索帕金森病机制,支持全球药物研发进程。
然而,PFF制备方法或超声处理参数的差异可能影响纤维的致病性,这是该系统的局限性。尽管存在这一潜在限制,基于PFF的细胞模型仍是研究α-突触核蛋白错误折叠及其在神经退行性疾病中细胞后果的强大工具 (Dovonou, 2023)。
为评估PFF诱导的种子形成与传播,研究者采用多种方法在疾病相关细胞模型中解析病理性纤维传播的机制、动力学及调控因子。
|
实验读数 |
描述 |
主要检测方法 |
|
细胞内聚集物形成 |
检测新形成的细胞内聚集物(如磷酸化tau蛋白、pSer129-α-突触核蛋白) |
免疫组织化学(IHC)、免疫荧光(IF)、基于ELISA的聚集诱导发射检测 |
|
纤维素摄取与内化 |
监测蛋白质纤维聚集体(PFFs)的内化及早期种子事件 |
免疫荧光显微镜、生化分级、Western blot |
|
细胞存活率 |
评估PFF处理对细胞健康产生的细胞毒性效应 |
MTT测定、乳酸脱氢酶释放测定、活/死细胞染色 |
|
结晶能力 |
测量经处理细胞的裂解物或培养基在单体底物中诱导纤维形成的能力。 |
硫黄素T(ThT)荧光检测、接种ELISA、滤膜捕获法 |
|
细胞间传播 |
评估聚集体从供体细胞向未感染细胞的传播。 |
共培养检测、条件培养基转移、荧光显微镜 |
|
病理共定位分析 |
检测聚集物与自噬、泛素化或应激通路标记物的重叠情况。 |
免疫荧光共染色、共聚焦显微镜、Western blot |
|
共聚焦成像 |
定量分析细胞或培养物内聚集物的形成及空间分布。 |
共聚焦激光扫描显微镜 |
本表比较了评估PFF诱导的蛋白质聚集、传播和毒性的实验读数,包括细胞内聚集物形成、纤维摄取和纤维化、细胞活力、播种能力、细胞间传播、病理共定位和共聚焦成像。
哪些动物模型被用于模拟PFF诱导的种子形成 与 扩散?
在神经退行性疾病的动物模型中,常通过模拟疾病过程中蛋白质错误折叠、种子形成及扩散的自然过程,利用PFF构建更符合生理特征的病理模型 (Gibbons, 2019)。
通过体外 培养病原性蛋白(如tau蛋白或α-突触核蛋白) 生成 的PFFs, 可在体内 重现神经退行性病变的关键特征 ,包括:
- 大脑中病原性蛋白质聚集物的更精确播种与扩散。
- 相较于传统转基因或毒素诱导动物模型,能更快且更可重复地诱导分子病理学变化。
- 对病理启动的时间、位置和程度实现更精确的控制。
- 适用于多种蛋白病的多功能且经济高效的方法。
- 为测试旨在抑制蛋白质聚集、扩散或下游神经退行性病变的候选疗法提供了稳健的实验平台。
总体而言,在动物模型中使用PFFs提供了一种强大且灵活的方法,能够在时空控制下真实再现神经退行性疾病的分子和病理特征,从而促进机制研究和治疗开发。
用于研究PFF诱导的种子形成与扩散的动物模型主要涉及啮齿类动物(尤其是小鼠和大鼠),其关键模型及特征如下:
人源蛋白过表达转基因小鼠:
- 此类小鼠注射PFF后会加速发展蛋白病及行为/运动功能障碍。常用模型包括:
- M83小鼠(过表达含A53T突变的人源α-突触核蛋白,用于帕金森病模型)
- PS19小鼠:表达含P301S突变的人源Tau蛋白 ,用于tau病模型。
- APP/PS1小鼠:表达嵌合小鼠/人类淀粉样前体蛋白(Mo/HuAPP695swe)及突变型人类早老素1(PS1-dE9),两者均定位于神经元,用于阿尔茨海默病模型。
- 表达人类突变亨廷顿蛋白的转基因小鼠亦用于亨廷顿病建模。
野生型(非转基因)啮齿动物:
野生型小鼠或大鼠可通过注射重组蛋白纤维(α-突触核蛋白、 tau蛋白、 β淀粉样蛋白)诱导内源性蛋白聚集与病理变化,无需转基因过表达。该模型可研究正常生理蛋白在蛋白聚集起始与传播过程中的作用。
在Biospective, 我们通过立体定位技术将超声处理的重组人tau PFFs或脑组织提取物注入PS19小鼠海马区及覆盖皮层 ,相较于未注射的PS19小鼠中随年龄自然发展的病理进程,该方法能加速并同步tau病理的发生。
作为临床前神经科学CRO,我们还提供 帕金森病的α-突触核蛋白PFF小鼠模型:通过立体定位接种重组人α-突触核蛋白PFF至M83转基因小鼠,或接种小鼠源α-突触核蛋白至野生型(B6-C3H)小鼠实现。
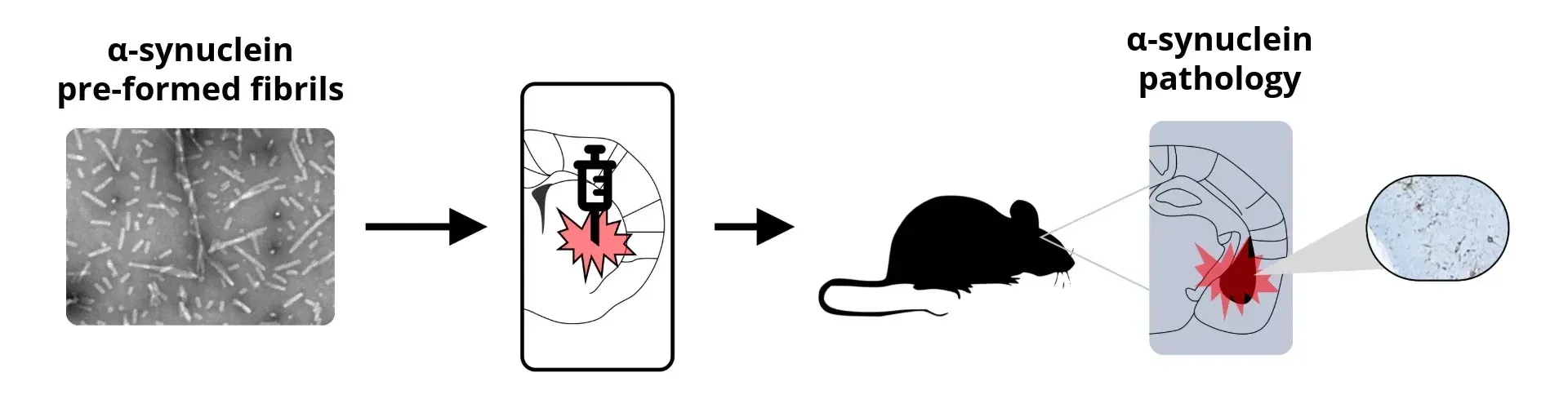
α-突触核蛋白PFF动物模型构建的总体 方案。
这些动物模型具有高度可重复性,tau蛋白和α-突触核蛋白PFF的播种成功率接近100%。 PFF播种与扩散的有效性还可通过多种 体内评估指标进行验证 ,包括:
- 组织病理学分析: 通过免疫组化或多重免疫荧光 技术,对脑部区域随时间推移的蛋白质聚集物及疾病相关翻译后修饰进行检测。
- 生化分析: 提取并通过Western blot或ELISA定量检测不溶性蛋白聚集体。
- 时空扩散: 通过PFF注射后沿神经解剖通路绘制病理扩散图谱以评估传播过程。
- 行为表型分析: 评估与模型疾病相关的运动、认知及感觉功能 ,以关联病理变化与功能缺损。
- 神经退行性变与脑萎缩: 通过 体积磁共振成像(MRI) 或受累脑区突触标记物染色,定量评估 神经元丧失及脑萎缩程度 。
- 体内 成像: 利用报告动物或 成像示踪剂纵向监测聚集物形成与扩散过程。
- 体液生物标志物: 在PFF小鼠模型血浆和脑脊液(CSF)中检测到神经退行性病变标志物水平升高 ——如 神经丝轻链(NfL) 和促炎细胞因子(IL-1β、 TNF-α)。这些标志物反映了PFF诱导病理相关的细胞损伤。
深入了解我们对多种PFF诱导的神经退行性疾病模型的表征研究、经验证的评估方法,以及我们提供的临床前神经科学合同研究组织(CRO)服务。
了解更多关于我们的神经退行性疾病模型
相关内容
关于神经炎症的最新信息,以及在神经退行性疾病动物模型中评估治疗药物的最佳实践。
帕金森病模型中的神经丝轻链
神经丝轻链(NfL;NF-L)水平如何作为帕金森病小鼠和大鼠模型的血液(血浆;血清)和脑脊液生物标志物。