この資料では以下の内容について説明しております:
プリフォームドフィブリルとは何でしょうか?
タンパク質の凝集は、 アルツハイマー病(AD)、 パーキンソン病(PD)、 前頭側頭型認知症(FTD)、 筋萎縮性側索硬化症(ALS)、 進行性核上性麻痺(PSP)、 皮質基底核変性症、 多系統萎縮症(MSA)、 ハンチントン病(HD)など、 幅広い神経変性疾患の中心的な病理学的特徴です 。
病的な状態では、 タウ、 アミロイドベータ、 α-シヌクレイン、 TDP-43、 ハンチントンなどのタンパク質が 、本来の構造から誤って折りたたまれ、 有毒なオリゴマーや線維構造に集合します (ウィルソン、2023)。この誤った折りたたみは、核生成重合、すなわち「シード」のプロセスを通じて発生し、その過程で、単量体が段階的に付加されることで凝集体が成長します。
クラスターが、小さな可溶性オリゴマーから、高度に秩序化されたβシートが豊富な線維状凝集体に至るまでの臨界サイズを超えて拡大すると、それ以上の単量体の付加はエネルギー的に有利になります (Koga、2021)。このプロセスにより 、複数の神経変性疾患において、 影響 を受けた ニューロンやグリア細胞に見られる病理学的封入体の主要成分である有毒な凝集体が形成されます 。
こうした集合体の中でも、線維状形態は特に動的で病原性の高いタンパク質凝集状態を表します。線維は可溶性単量体タンパク質を動員することで急速に伸長し、さらなる凝集を促進する鋳型として機能します (Powers, 2006)。 重要なことに、成熟した線維は静的な最終生成物ではなく、 受容細胞内で内因性タンパク質の 新規 凝集を 誘導する「種」としての能力を保持した短い線維断片へ自発的に断片化することがあります (Powers, 2007)。これらの種は、以下のような様々なメカニズムを介して細胞間で拡散することが可能です:
- ・エキソサイトーシス
- エンドサイトーシス
- トンネルナノチューブ
- シナプス伝達
この自己増殖的なプリオン様挙動は、現在、広範な神経変性疾患において相互接続された脳領域全体に病理が進行的に広がる基盤となる統一的なメカニズムとして認識されています (Yamaguchi, 2017;Gibbons, 2019)。
プレフォーメッドフィブリル(PFF)は 、細胞および動物モデルにおいて疾患関連凝集体の構造的・生化学的特性を再現可能な、 in vitroで生成される線維状集合体です。PFFは強力なシード活性を有し、生物学的系に導入されると内因性の可溶性タンパク質を動員し、細胞内凝集体形成を誘導します (Uemura, 2025)。
その結果、PFFベースのモデルは、疾患関連タンパク質の誤折り畳み、シード作用、凝集、伝播、ならびに下流の神経毒性や神経炎症など、ヒトの神経変性病理の重要な側面を再現します (Majid, 2023)。
正確で信頼性が高く、生理学的に関連性のある疾患モデルの開発は、神経変性を駆動する分子メカニズムの解明、治療介入の有効性評価、および薬剤候補の安全性評価に不可欠です。遺伝子過剰発現、化学的誘導、または物理的損傷に依存する従来の方法と比較して、PFF誘導モデルには以下のような明確な利点があります:
- トランスジェニック動物モデルが長い成熟期間を必要とするのに対し 、神経変性プロセスの誘導がより迅速であること 。
- ヒト疾患で観察される自然発生的な種形成および拡散過程をより忠実に再現できること。
- 時間的・空間的特性が定義された病態の制御された誘導。
- トランスジェニック動物の生成・飼育と比較して、確立および維持コストが低いこと。
- PFFの形成は標準化および検証が可能(例: チオフラビンTアッセイ、透過型電子顕微鏡、原子間力顕微鏡による)であり、一貫した品質と構造が得られます。
- PFF誘導は、遺伝子組み換えモデルや毒素誘導モデルと組み合わせることで、疾患の分子的側面と行動的側面の両方をより良く再現することが可能です。
- 培養神経細胞やiPS細胞由来細胞から動物実験に至るまで、 in vitroおよび in vivo システムの両方で有用です。
したがって、PFF ベースのモデリングは、神経変性疾患におけるタンパク質凝集の開始、伝播、および結果を研究するための強力かつ革新的な戦略となります (Stroo、2017)。
|
特徴 |
タウPFF |
アミロイドβ PFF |
α-シヌクレインPFF |
TDP-43 PFF |
ハンチントンPFF |
|
タンパク質の種類 | 微小管関連タンパク質 | 小ペプチド(Aβ 40–42 アミノ酸) | シナプス前神経細胞タンパク質 | RNA結合タンパク質 | ポリQ拡張タンパク質 |
|
疾患モデル
|
アルツハイマー病、前頭側頭型認知症、その他のタウ病 | アルツハイマー病 | パーキンソン病、多系統萎縮症、レビー小体型認知症 | 筋萎縮性側索硬化症(ALS)および前頭側頭型認知症(FTD) |
ハンチントン病 |
|
| 様々なアイソフォーム(3R/4R)、変異(P301S、P301L) | 主にAβ40/42ペプチド | 野生型および家族性変異体(A53T) | 野生型および病理学的変異体 | エクソン1におけるポリQ拡張 |
|
線維形態
| ペア状らせん状フィラメント(PHFs)、直線状フィラメント | アミロイド斑/線維 | レビー小体様線維 | 細胞質封入体 | 核内および細胞質内封入体線維 |
|
シード効率
| 中程度、株依存性 | 高い、迅速なAβ凝集 | 高い、サイズ依存性あり | 中程度から低程度 | 変動あり、ポリQ長に依存します |
|
細胞内標的
| ニューロン、軸索 | 細胞外プラーク、神経細胞のシナプス、神経細胞 | 神経細胞のシナプス、神経細胞 | ニューロンおよびグリア細胞 | ニューロン、核および細胞質コンパートメント |
この表は、様々な神経変性疾患のモデル化に使用される特徴を比較したものです。比較項目には、タンパク質の種類、モデル化された疾患、タンパク質アイソフォーム/変異体、線維形態、シード効率、細胞標的が含まれます。
PFFによるシード形成 と 拡散の研究には、どの細胞モデルが用いられていますか ?
PFFの細胞モデルとは、一般的に 、PFFを用いて内因性タンパク質の凝集を誘導し、神経変性疾患の病態を模倣するin vitro細胞系 を指します(Volpicelli-Daley, 2014)。細胞モデルにおけるPFFの形成と伝播は、通常、以下の段階を経て進行します:
- まず、組換えモノマーが、病理学的封入体に見られるものと構造的に類似したフィブリルに組み立てられます。
- 次に、PFFは超音波処理によりより短い断片に分解され、培養細胞に添加されます。
- 培養されたニューロンおよびグリア細胞内において、PFFは細胞固有の凝集性タンパク質の凝集を核形成します。
- PFFの種類および模倣対象の病態に応じて、この凝集は翻訳後修飾(リン酸化など)を引き起こし、疾患状態で観察されるものと類似した病原性封入体の形成に至る場合があります(Stroo, 2017)。
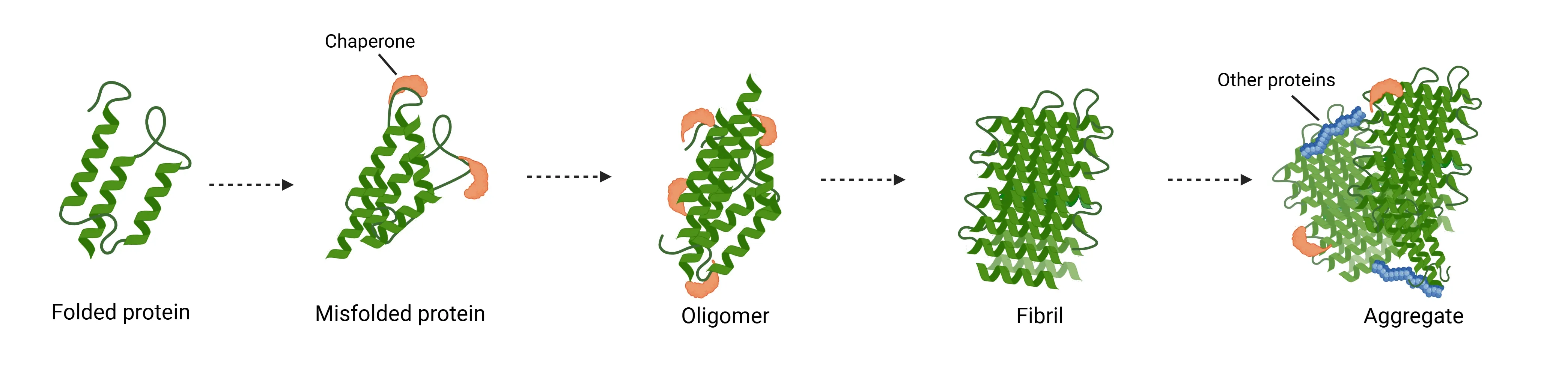
神経変性疾患におけるタンパク質凝集のメカニズム
例えばパーキンソン病においては、PFF細胞モデルが広く用いられています。これはα-シヌクレインの過剰発現に依存せず、生理的タンパク質レベルで凝集を誘導するため、ヒトの状態により近いモデルとなるからです (Benskey, 2016; Uemura, 2025)。
これらのモデルにより、α-シヌクレインの凝集・伝播メカニズムおよび関連する細胞機能障害の研究が可能となります。一般的に使用される細胞株には以下が含まれます:
- SH-SY5Yヒト神経芽腫細胞
- げっ歯類由来初代ニューロン
- ヒトiPS細胞由来ニューロン
これらのモデルで形成される病理学的凝集体は安定しており、細胞継代を通じて伝播させることが可能で、シナプシン病の主要な特徴を再現します。
現在、マウスまたはヒト由来のα-シヌクレインPFF(野生型および変異型を含む)は、様々な緩衝液条件下で生成されています。 ヒトα-シヌクレイン線維は、「シード法」反応によっても生成可能です。この方法では、病原性構造の増幅を促進するためにパーキンソン病患者のサンプルが添加されます (Wu, 2024)。これらのモデルは、細胞内取り込み経路や炎症反応の解明、凝集阻害剤の試験において極めて有用です。また、パーキンソン病のメカニズム研究や世界的な創薬活動を支援するため、細胞モデルや動物モデルで広く活用されています。
しかしながら、PFFの調製法や超音波処理パラメータのばらつきが線維体の病原性に影響を与える可能性があり、これが本システムの限界点となります。この潜在的な制約にもかかわらず、PFFベースの細胞モデルは、神経変性疾患研究におけるα-シヌクレインの誤折り畳みとその細胞内影響を研究する強力なツールであり続けています (Dovonou, 2023)。
PFFによるシード形成と拡散を評価するため、疾患関連細胞モデルにおいて病理学的フィブリル伝播のメカニズム、動態、および調節因子を評価する複数の手法が用いられています。
|
実験的評価指標 |
説明 |
主な検出方法 |
|
細胞内凝集体の形成 |
新たに形成された細胞内凝集体(例:リン酸化タウ、pSer129-α-シヌクレイン)を検出します |
免疫組織化学(IHC)、免疫蛍光法(IF)、ELISAベースの凝集誘導発光アッセイ |
|
フィブリル取り込みおよび内部化 |
PFFの取り込みおよび初期のシード形成イベントをモニタリングします |
免疫蛍光顕微鏡法、生化学的分画、ウエスタンブロット |
|
細胞生存率 |
PFF処理による細胞への細胞毒性効果を評価します。 |
MTTアッセイ、LDH放出アッセイ、生細胞/死細胞染色 |
|
播種能 |
処理した細胞の溶解液または培地が、単量体基質において線維形成を誘導する能力を測定します。 |
チオフラビンT(ThT)蛍光アッセイ、シードELISA、フィルタートラップアッセイ |
|
細胞間拡散 |
ドナー細胞から未感染細胞への凝集体の伝播を評価します。 |
共培養アッセイ、条件培養液移送、蛍光顕微鏡観察 |
|
病理学的コロカライゼーション |
凝集体と、オートファジー、ユビキチン化、またはストレス経路のマーカーとの重なりを調べます。 |
免疫蛍光二重染色法、共焦点顕微鏡、ウエスタンブロット |
|
共焦点イメージング |
細胞内または培養細胞内における凝集体の形成および空間的分布を定量します。 |
共焦点レーザー走査顕微鏡 |
本表は、PFF によるタンパク質凝集、伝播、毒性を評価するための実験的測定値を比較したものです。これには、細胞内凝集体の形成、線維の取り込みと線維化、細胞生存率、シード能力、細胞間拡散、病理学的共局在、および共焦点イメージングが含まれます。
PFFによるシード形成 と 拡散をモデル化するために、どのような動物モデルが使用されていますか ?
神経変性疾患の動物モデルにおいて、PFFは疾患で生じるタンパク質の異常折り畳み、シード形成、拡散といった自然過程を模倣することで、より生理学的に正確な病理モデルを生成するために頻繁に用いられます (Gibbons, 2019)。
タウタンパク質やα-シヌクレインなどの病原性タンパク質から in vitroで生成される PFFは、 in vivoにおける 神経変性の重要な特徴を再現します 。具体的には:
- 脳内における病原性タンパク質凝集体のより正確なシード形成と拡散。
- 従来のトランスジェニック動物モデルや毒素誘導モデルと比較して、分子病理の誘導がより迅速かつ再現性が高いこと。
- 病理発生のタイミング、部位、レベルをより精密に制御可能。
- 複数のタンパク質病変に適用可能な、より汎用的で費用対効果の高いアプローチ。
- 生体内における凝集、拡散、あるいは下流の神経変性を抑制することを目的とした候補治療法の試験のための堅牢なプラットフォームを提供します。
総じて、動物モデルにおけるPFFsの利用は、時間的・空間的制御のもとで神経変性疾患の分子的・病理学的側面を忠実に再現する強力かつ柔軟なアプローチを提供し、機序解明研究と治療法開発を促進します。
PFFによるシード形成と拡散の研究に用いられる動物モデルは、主にげっ歯類、特にマウスとラットが対象であり、以下の主要モデルと特徴があります:
ヒトタンパク質を過剰発現するトランスジェニックマウス:
- これらのマウスは、PFFsの注入後に加速されたタンパク質病変および行動・運動障害を発症します。一般的に使用されるモデルには以下が含まれます:
- パーキンソン病モデル:A53T変異を有するヒトα-シヌクレインを過剰発現するM83マウス。
- タウ病モデル用:P301S変異を有するヒトタウを発現するPS19マウス 。
- APP/PS1マウス:キメラ型マウス/ヒトアミロイド前駆体タンパク質(Mo/HuAPP695swe)と変異型ヒトプレセニリン1(PS1-dE9)を発現し、いずれも神経細胞に標的化されたアルツハイマー病モデル用。
- ハンチントン病モデルには、ヒト変異ハンチントンタンパク質を発現するトランスジェニックマウスも使用されます。
野生型(非トランスジェニック)げっ歯類:
野生型マウスまたはラットには、組換えPFF(α-シヌクレイン、 タウ、 アミロイドβ)を注入することで、トランスジーンの過剰発現なしに内因性タンパク質の凝集と病理を誘導できます。このモデルにより、正常な生理的タンパク質が種形成と伝播において果たす役割の研究が可能となります。
バイオスペクティブ社では、 PS19マウスに対し、超音波処理した組換えヒトタウPFFまたは脳抽出物を海馬および上皮皮質へ定位注入することで 、非注入のPS19マウスで観察される自然発生的な加齢依存性病態進行と比較し、本モデルにおけるタウ病理の発症を加速・同期化させる支援をしております。
前臨床神経科学CROとして、当社は パーキンソン病のα-シヌクレインPFFマウスモデルも提供しております 。これは、M83トランスジェニックマウスへの組換えヒトα-シヌクレインPFFの、あるいは野生型(B6-C3H)マウスへのマウスα-シヌクレインの、定位的接種を用いて作成されます。
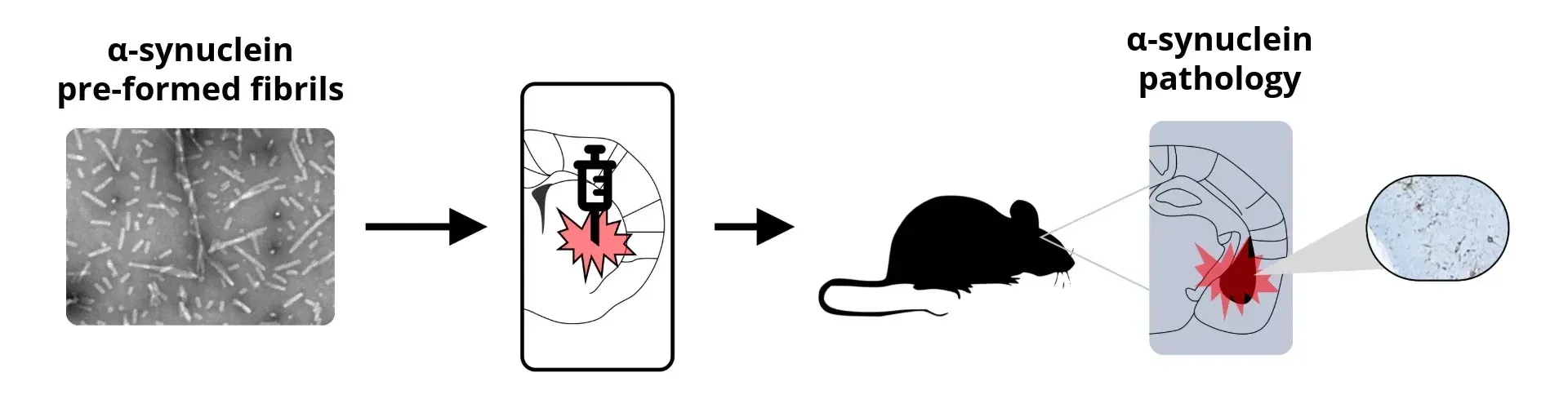
シナプシンPFF動物モデル作製のための一般的な スキーム
これらの動物モデルは再現性が高く、タウおよびα-シヌクレインのプリセットフィラメント(PFF)形成の成功率はほぼ100%です。 PFFの形成と拡散の有効性は 、以下の様々な 生体内アウトカム指標を用いて検証することも可能です :
- 組織病理学的解析: 免疫組織化学法または多重免疫蛍光法 による、時間経過に伴う脳領域におけるシードされたタンパク質凝集体および疾患関連翻訳後修飾の検出。
- 生化学的解析: 不溶性凝集タンパク質画分の抽出、およびウエスタンブロットまたはELISAによる定量。
- 空間的・時間的拡散: PFF注入後の神経解剖学的経路に沿った病理学的拡散のマッピングによる伝播評価。
- 行動表現型解析: モデル疾患に関連する運動機能、認知機能、感覚機能の評価を行い、 病理と機能障害の相関関係を明らかにします。
- 神経変性および脳萎縮:体積測定磁気共鳴画像法(MRI) または影響を受けた脳領域におけるシナプスマーカーの染色 による 、 神経細胞喪失および脳萎縮の定量化 。
- 生体内 イメージング: レポーター動物または イメージングトレーサーを用いた凝集体の形成と拡散の経時的モニタリング。
- 体液バイオマーカー: PFFマウスモデルにおいて、ニューロフィラメント軽鎖(NfL) や炎症性サイトカイン(IL-1β、 TNF-α)など 、神経変性のバイオマーカー値の上昇 が血漿および脳脊髄液(CSF)で検出されています。これらのバイオマーカーは、PFF誘発病理に伴う細胞損傷を反映しています。
当社が開発した各種PFF誘導型神経変性疾患モデルの特徴解析、検証済み測定法、ならびに前臨床神経科学CROサービスについて、詳細をご確認ください。
当社の神経変性疾患モデルについて、さらに詳しくご覧ください
関連コンテンツ
神経炎症に関する最新情報と、神経変性疾患の動物モデルにおける治療薬評価に関連するベストプラクティスについて。
パーキンソン病モデルにおけるニューロフィラメント軽鎖
神経フィラメント軽鎖(NfL;NF-L)レベルが、パーキンソン病のマウスおよびラットモデルにおける血液(血漿;血清)およびCSFバイオマーカーとして使用できる方法。