Qu'est-ce que la sénescence microgliale?
Les microglies sont une population hétérogène de cellules du système nerveux central (SNC), qui servent de cellules immunitaires résidentes du cerveau. Elles jouent un rôle essentiel dans le maintien de l'homéostasie, la réponse aux blessures et aux infections, et l'élimination des débris cellulaires. Représentant environ 10 à 15% de la population totale de cellules cérébrales, les microglies jouent un rôle essentiel dans l'orchestration des réponses neuroinflammatoires et contribuent à des processus tels que la myélinisation (Greenwood, 2021; Malvaso, 2023). En outre, elles participent à la surveillance immunitaire et au remodelage synaptique (Ng, 2023). Des études récentes suggèrent que la microglie subit une sénescence avec le vieillissement, entraînant des changements fonctionnels non seulement dans le vieillissement normal, mais aussi dans divers troubles, y compris les maladies neurodégénératives (Ng, 2023).
La sénescence microgliale implique l'acquisition d'un phénotype sécrétoire associé à la sénescence (SASP) et se caractérise par un arrêt irréversible du cycle cellulaire (Greenwood, 2021; Malvaso, 2023). Cet état se caractérise par plusieurs changements clés, notamment une augmentation de la sécrétion d'espèces réactives de l'oxygène (ERO) et de cytokines pro-inflammatoires, un dysfonctionnement mitochondrial et des niveaux élevés d'accumulation de fer et de ferritine. En conséquence, les microglies sénescentes présentent une morphologie altérée, avec des caractéristiques telles que la déramification des processus, des gonflements anormaux, la cytorhexis et la vacuolisation (Malvaso, 2023). Une caractéristique de la sénescence microgliale est la réduction de l'activité phagocytaire et la diminution de la motilité, qui entravent leur capacité à éliminer les débris et à migrer vers les sites de lésion. Si l'accumulation de microglies sénescentes dépasse un certain seuil, peut-être en raison de la propagation paracrine de la sénescence, elle peut accélérer la progression des maladies liées à l'âge, créant une boucle de rétroaction qui augmente le nombre de microglies sénescentes (Chaib, 2022).
Il est difficile de définir la sénescence microgliale en raison d'un manque de consensus sur ses caractéristiques et de l'absence d'un marqueur spécifique. De plus, le phénotype de la microglie sénescente se confond avec d'autres états cellulaires, tels que l'état dystrophique, qui sont souvent utilisés de manière interchangeable (Ng, 2023). La microglie sénescente partage également des caractéristiques avec la microglie associée à la maladie (DAM), notamment le raccourcissement des télomères, la microglie sénescente étant considérée comme un sous-ensemble distinct de la DAM (Hu, 2021; Samuel Olajide, 2024). Malgré ces difficultés, le rôle de la sénescence microgliale dans les maladies neurodégénératives liées au vieillissement est devenu un sujet de recherche, avec la possibilité d'être ciblé pour des interventions thérapeutiques.
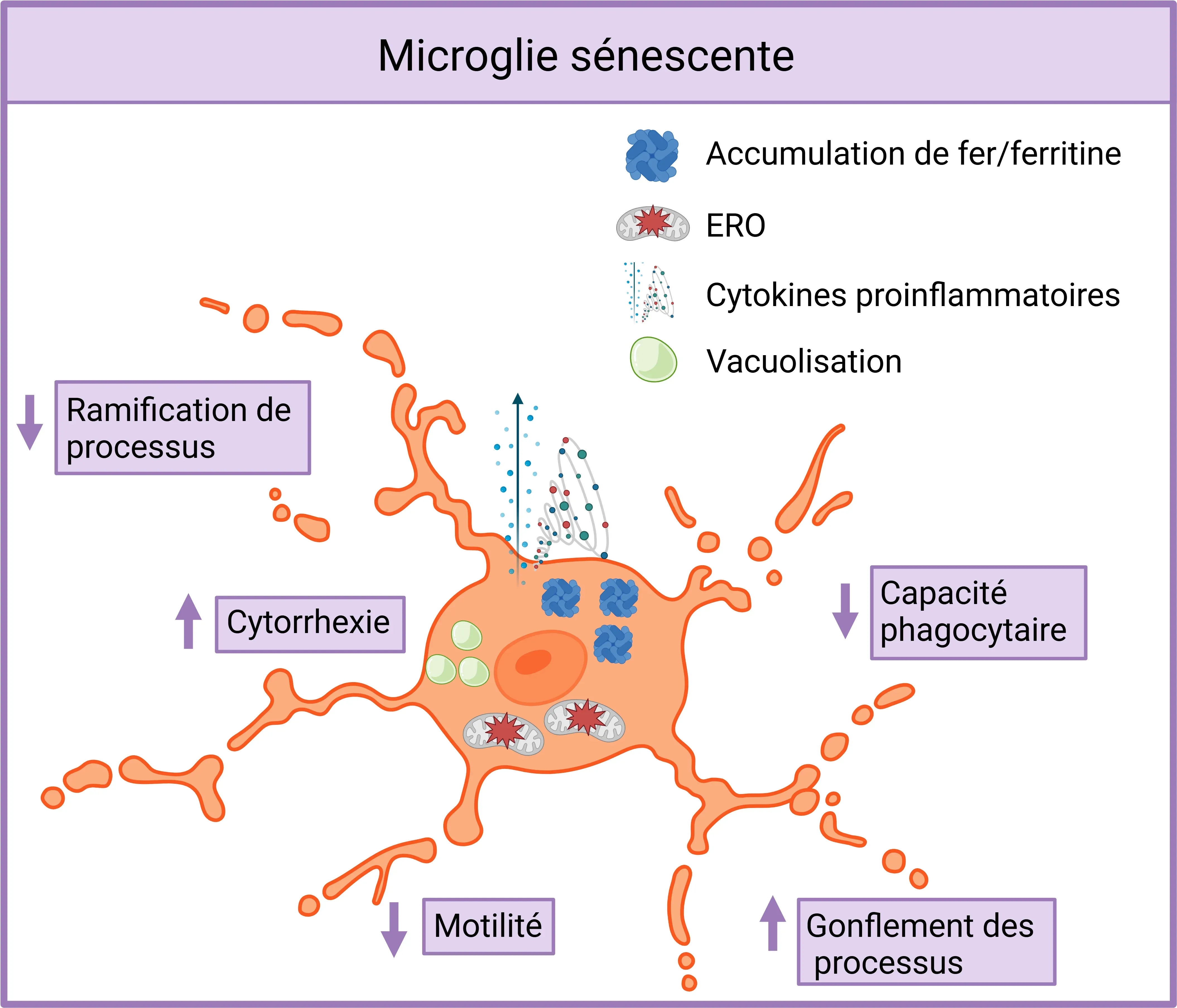
Les microglies sénescentes présentent une ramification et une motilité réduites des processus, un gonflement et une cytorrhexis accrus, ainsi qu'une fragmentation cytoplasmique avec vacuolisation. Elles accumulent plus de fer, présentent une expression plus élevée de la ferritine et une production accrue de ROS, et libèrent plus de cytokines pro-inflammatoires. Leur capacité phagocytaire à éliminer les débris et les protéines toxiques est considérablement altérée. Figure et légende adaptées de Malvaso et al. (Malvaso, 2023) sous licence Creative Commons Attribution.
Cliquez pour copier le lien
Quel rôle joue la sénescence microgliale dans la MA et la MP?
Avec le vieillissement de la population mondiale, l'incidence des maladies neurodégénératives liées à l'âge, y compris les protéinopathies, devrait augmenter. Le vieillissement est un facteur de risque majeur pour les protéinopathies, qui se caractérisent par l'accumulation de protéines mal repliées telles que la protéine bêta-amyloïde (Aβ), la protéine tau, la protéine TDP-43 (transactive response DNA binding protein of 43 kDa) et la α-synucléine (α-syn). Il existe donc une demande croissante de thérapies ciblées visant à ralentir ou à prévenir la progression de ces maladies.
Étant donné que la microglie sénescente s'accumule dans le cerveau et la moelle épinière à la fois lors du vieillissement normal et des maladies neurodégénératives, elle est devenue une cible clé pour des interventions thérapeutiques potentielles. Les médicaments sénolytiques, conçus pour éliminer sélectivement les cellules sénescentes, visent à atténuer ou à inverser les effets du vieillissement et de l'inflammation. Ces médicaments ont donné des résultats prometteurs dans des études précliniques et sont actuellement testés dans des essais cliniques de phase précoce pour évaluer leur efficacité dans le traitement des affections liées à l'âge, y compris les maladies neurodégénératives.
La maladie d'Alzheimer (MA)
La maladie d'Alzheimer est une maladie neurodégénérative progressive qui entraîne principalement un déclin cognitif, des troubles de la mémoire et des changements de comportement et d'humeur. L'accumulation de plaques Aβ et d'enchevêtrements neurofibrillaires tau hyperphosphorylés est au cœur de la pathogenèse de la maladie d'Alzheimer. Au-delà de ces caractéristiques, la microglie joue un rôle important dans le processus pathologique.
Un mécanisme proposé pour la progression de la maladie dans les protéinopathies implique une boucle de rétroaction positive entre le vieillissement, la maladie, les protéines mal repliées et la microglie sénescente (Lau, 2023). Dans cette boucle, le vieillissement favorise l'accumulation de protéines mal repliées, un processus qui est particulièrement accéléré dans des maladies comme la MA. Cette accumulation de protéines mal repliées induit à son tour la sénescence microgliale, ce qui exacerbe encore l'accumulation de protéines mal repliées. Des études ont montré que les microglies exposées à des niveaux élevés de protéine tau adoptent un phénotype sénescent, caractérisé par un arrêt du cycle cellulaire, une clairance de la protéine tau altérée et la formation d'un SASP (Karabag, 2023). Ces microglies sénescentes s'accumulent dans les régions du cerveau touchées par la AD, où elles déclenchent la sénescence des microglies environnantes par signalisation paracrine (Lau, 2023). Cette cascade intensifie l'accumulation de protéines neurotoxiques, la neurodégénérescence et la neuroinflammation, et accélère la progression de la maladie, car la fonction phagocytaire des microglies sénescentes diminue (Lau, 2023; Miao, 2023).
La maladie de Parkinson (MP)
La maladie de Parkinson, deuxième maladie neurodégénérative la plus répandue après la maladie d'Alzheimer, se caractérise principalement par des symptômes moteurs tels que la rigidité musculaire, la bradykinésie et les tremblements au repos. Bien qu'elle soit souvent négligée, la maladie de Parkinson est également associée à des symptômes non moteurs, notamment des troubles de l'humeur et de l'affect tels que l'apathie et la dépression, ainsi que des dysfonctionnements cognitifs et des troubles du comportement. La perte progressive des neurones dopaminergiques dans la substance noire compacte (SNc) et l'accumulation de corps de Lewy, qui contiennent des agrégats de α-syn, sont des caractéristiques de la PD. Bien que l'on sache que les microglies contribuent à la progression de la MP, le rôle spécifique des microglies sénescentes dans la PD reste moins bien compris que dans la AD (Rim, 2024).
Les recherches indiquent que la microglie s'accumule dans le cerveau vieillissant, y compris dans le SNc (Shaerzadeh, 2020). En outre, les souris plus âgées présentent des niveaux plus élevés de α-syn par rapport aux souris plus jeunes après des injections intra-striatales de α-syn (Hong, 2024). Cette augmentation de la α-syn est aggravée par un retard de sa clairance lié à l'âge, probablement dû à un dysfonctionnement du système autophagie-lysosome (Hong, 2024). En outre, une accumulation de fer a été observée dans les régions touchées par la PD, telles que le SNc, une exposition excessive au fer étant liée à un risque plus élevé de développer la maladie (Angelova, 2019).
En conclusion, bien que la ADet la PD aient des caractéristiques pathologiques distinctes, elles partagent plusieurs mécanismes sous-jacents communs, en particulier le dysfonctionnement de la microglie. Dans les deux maladies, la microglie contribue à la progression de la maladie en favorisant l'inflammation et en altérant l'élimination des protéines neurotoxiques. Bien que des progrès significatifs aient été réalisés dans la compréhension du rôle de la sénescence microgliale dans les maladies neurodégénératives, des défis subsistent dans le développement de thérapies efficaces. Néanmoins, les recherches en cours sur les traitements sénolytiques sont prometteuses pour le traitement de ces maladies liées à l'âge.
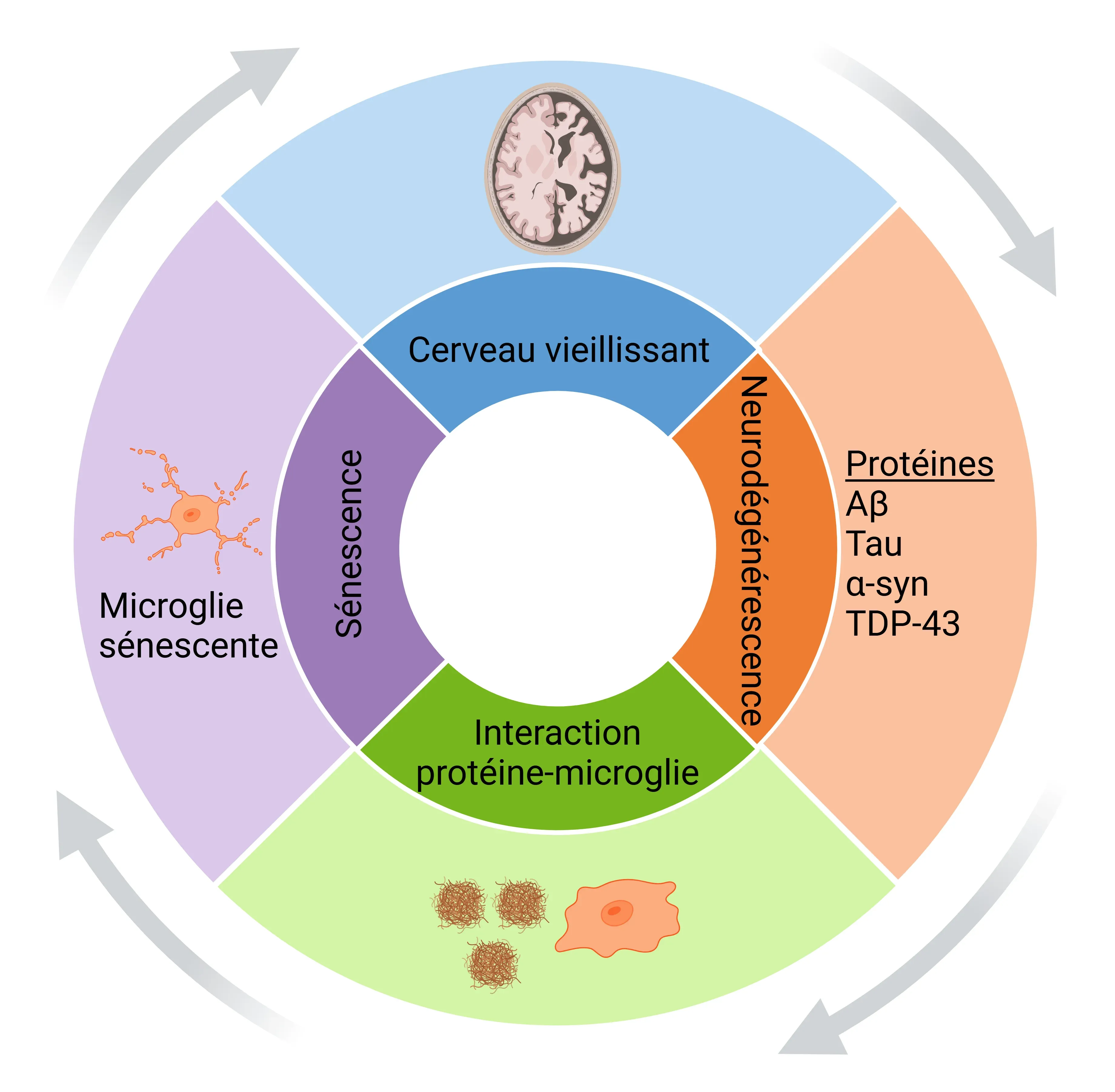
Vue d'ensemble schématique d'un mécanisme proposé de progression de la maladie dans les protéinopathies. L'accumulation d'agrégats de protéines mal repliées se produit avec le vieillissement et est exacerbée dans les conditions pathologiques. Ces protéines interagissent avec la microglie, contribuant à l'induction de la sénescence microgliale, ce qui intensifie encore l'accumulation de protéines neurotoxiques et accélère la neurodégénérescence et la progression de la maladie dans une boucle de rétroaction positive. Figure et légende adaptées de Samuel Olajide et al. (Samuel Olajide, 2024) sous licence Creative Commons Attribution.
Quels sont les modèles et marqueurs actuellement utilisés pour étudier la sénescence microgliale?
À mesure que la recherche sur le rôle de la sénescence microgliale dans les maladies neurodégénératives progresse, le développement de stratégies thérapeutiques ciblées devient plus urgent. Cependant, les progrès de ces thérapies sont entravés par le manque de méthodes précises pour détecter la microglie sénescente, en particulier in vivo. Par conséquent, l'identification de marqueurs fiables de la microglie sénescente est essentielle pour faire progresser ces efforts thérapeutiques.
L'un des marqueurs les plus utilisés pour la sénescence microgliale est l'activité de la β-galactosidase associée à la sénescence (SA-β-gal), qui reste un indicateur clé. En outre, les inhibiteurs de la kinase cycline-dépendante tels que p21 (également connu sous le nom de WAF1/CIP1) et p16INK4a sont fréquemment utilisés comme marqueurs en raison de leur forte association avec l'arrêt du cycle cellulaire, une caractéristique de la sénescence. Les modèles animaux ont joué un rôle déterminant dans l'étude de la sénescence microgliale, notamment les modèles p16luc (un modèle rapporteur de luciférase), les souris p16 knockout et les souris p16 knockout spécifiques aux microglies. Ces modèles ont été essentiels pour explorer le rôle de p16INK4a dans le vieillissement microglial et sa contribution aux maladies neurodégénératives liées à l'âge.
Une accumulation de ferritine a également été observée dans la microglie sénescente, bien que son rôle ne soit pas aussi bien compris que celui d'autres marqueurs. Le noir du Soudan B, un agent de coloration de la lipofuscine, est apparu comme une alternative potentielle au SA-β-gal (Ng, 2023). La lipofuscine, qui s'accumule dans les cellules vieillissantes comme la microglie, peut être détectée à l'aide du noir de soudan B, ce qui constitue une méthode prometteuse pour identifier la microglie âgée, bien qu'elle n'ait pas encore été largement adoptée. En outre, l'expression des cytokines SASP, telles que le TNF-α, l'IL-6 et l'IL-1β, est une autre caractéristique des cellules sénescentes. Ces cytokines pro-inflammatoires sont libérées par les microglies sénescentes et contribuent à la neuroinflammation, qui joue un rôle dans diverses maladies neurodégénératives. Malgré le nombre croissant de preuves reliant ces marqueurs à la sénescence microgliale, aucun marqueur définitif unique n'a été établi. Par conséquent, une approche multi-marqueurs, combinant plusieurs de ces indicateurs, est actuellement considérée comme la méthode la plus fiable pour identifier les microglies sénescentes.
Les recherches ont mis en évidence l'importance de marqueurs tels que p16INK4a, qui s'est avéré particulièrement significatif dans les études sur la sénescence microgliale. Par exemple, des recherches sur des souris ont montré que les microglies, en particulier dans la substance blanche, sont parmi les premières cellules du système nerveux central à subir une sénescence au cours du vieillissement (Matsudaira, 2023). Ces études ont confirmé que la sénescence microgliale se produit à la fois dans le cerveau et la moelle épinière, la sénescence étant particulièrement prononcée dans la DAM (Matsudaira, 2023). Dans les modèles de tauopathies, tels que la souris MAPT P301S (PS19), on a constaté que les microglies sénescentes exprimant p16INK4a s'accumulaient avec le temps (Bussian, 2018). Le ciblage de ces cellules sénescentes a montré un potentiel thérapeutique. Il a été démontré que l'élimination des microglies sénescentes empêche l'agrégation de la protéine tau et le dépôt d'enchevêtrements neurofibrillaires, réduit la neurodégénérescence et contribue à préserver les fonctions cognitives. En outre, il a été démontré que l'utilisation de sénolytiques permet de moduler l'agrégation de la protéine tau. Ces découvertes mettent en évidence le potentiel de ciblage des microglies sénescentes en tant qu'approche thérapeutique pour le traitement des tauopathies, soulignant le lien entre la sénescence microgliale et la progression des maladies neurodégénératives (Bussian, 2018).
En améliorant notre capacité à identifier et à cibler la microglie sénescente, les chercheurs ouvrent la voie à de nouvelles interventions thérapeutiques dans les maladies neurodégénératives. L'utilisation continue de ces marqueurs et modèles est essentielle pour faire progresser notre compréhension de la sénescence microgliale et de ses implications dans le traitement des affections neurologiques liées à l'âge.
Notre équipe se fera un plaisir de répondre à vos questions sur la sénescence microgliale et les maladies neurodégénératives ou de vous fournir des informations spécifiques sur les modèles de MA et MP que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur la sénescence microgliale et les maladies neurodégénératives, ainsi que sur les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de maladies neurodégénératives.
Microglie, astrocytes et α-synucléine dans la maladie de Parkinson
Comment l'α-synucléine influence les microglies et les astrocytes dans la maladie de Parkinson et d'autres synucléinopathies.
TNF-α et microglie dans les maladies neurodégénératives
Un aperçu de la fonction du facteur de nécrose tumorale alpha (TNF-α) dans la microglie et de sa contribution à la progression de la neurodégénérescence.
Inflammasome NLRP3 et maladies neurodégénératives
Un aperçu de l'inflammasome NLRP3 et de son rôle dans les maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson et la SLA.
Morphologie de la microglie dans la SLA, la maladie d'Alzheimer et la maladie de Parkinson
Une vue d'ensemble de l'analyse morphologique des microglies et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.
Dysfonctionnement lysosomal dans les microglies et les astrocytes
Un aperçu du dysfonctionnement lysosomal dans la microglie et les astrocytes, et de son rôle dans les maladies neurodégénératives.