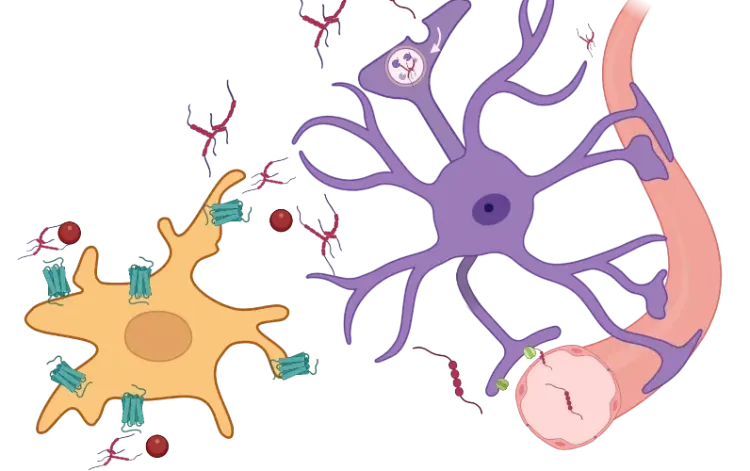
Cette ressource décrit:
- Pourquoi étudier les interactions directes entre les microglies et les neurones?
- Où se produisent les interactions directes entre les microglies et les neurones sur les neurones?
- Comment les interactions directes entre les microglies et les neurones évoluent-elles dans les maladies neurodégénératives?
Pourquoi étudier les interactions directes entre les microglies et les neurones?
Les microglies sont les principales cellules immunitaires du système nerveux central et jouent un rôle crucial dans le maintien de la santé cérébrale et la réponse aux maladies. Dans les maladies neurodégénératives, les microglies présentent des fonctions doubles complexes, avec des effets à la fois positifs et négatifs sur la progression de la maladie (Gao, 2023). Elles contribuent à éliminer les protéines mal repliées, mais elles facilitent également, sans le vouloir, la propagation de ces protéines, exacerbant ainsi la pathologie. Les microglies fournissent un soutien trophique et favorisent un environnement anti-inflammatoire au début de la maladie. Cependant, après une réactivité prolongée, elles peuvent libérer des facteurs inflammatoires neurotoxiques.
Afin de mieux comprendre et distinguer les rôles complexes des microglies dans les maladies neurodégénératives, ainsi que la manière dont les traitements thérapeutiques potentiels pourraient influencer les microglies, il est important de mesurer les phénotypes microgliaux et leurs interactions avec d'autres cellules. Bien que les microglies interagissent à la fois directement et indirectement avec la plupart des types de cellules du cerveau, cette ressource se concentrera sur les interactions directes entre les microglies et les neurones, qui peuvent être facilement mesurées à l'aide de l'immunofluorescence multiplexe, et sur la manière dont ces interactions peuvent être influencées dans les maladies neurodégénératives.
À quel endroit les interactions directes entre les microglies et les neurones se produisent-elles sur les neurones?
Synaptiques
Les interactions directes entre les microglies et les neurones au niveau de la synapse sont bien établies. Au cours du développement, les microglies contribuent à l'élagage synaptique (Paolicelli, 2011 ; Schafer, 2012; Weinhard, 2018) et au développement des synapses via la signalisation du complément (Paolicelli, 2011; Hoshiko, 2012; Zhan, 2014) et la signalisation fractalkine (CXCL3-CXCR1) (Schafer, 2012). À l'âge adulte, elles contribuent à l'élimination des synapses (Trapp, 2007; Yamada, 2008; Tremblay, 2010) et au remodelage des épines dépendant de l'activité (Parkhurst, 2013). De plus, les microglies régulent la synchronisation du réseau local, le courant post-synaptique, le dimensionnement synaptique et la plasticité (Rogers, 2011; Pfeiffer, 2016; Akiyoshi, 2018; Wang, 2020). Les synapses apoptotiques peuvent exprimer la phosphatidylsérine, également connue sous le nom de molécule de signalisation «eat-me», qui induit l'élimination des microglies par le biais du facteur 8 de la globule de graisse du lait (MFG-E8) ou des récepteurs TAM (Nonaka, 2019). Les synapses peuvent être marquées pour une élimination ciblée avec le C1q, qui est reconnu par le CR3 microglial (signalisation du complément) (Stevens, 2007; Schafer, 2012).
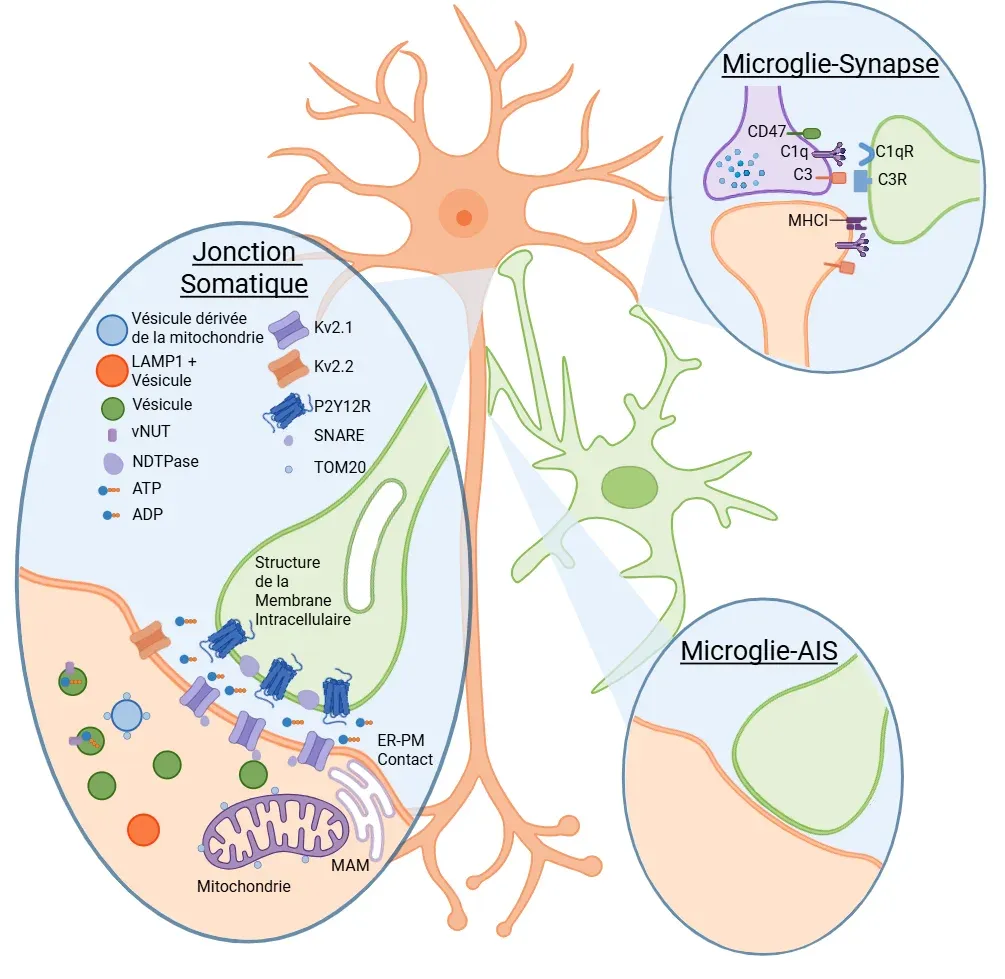
Représentation schématique des interactions directes entre les microglies et les synapses neuronales, le soma et les axones, ainsi que les voies moléculaires impliquées. Adapté de Cserép et al. (Cserép, 2020) sous licence Creative Commons Attribution.
Soma
Les interactions entre les processus microgliaux et le soma neuronal font l'objet d'une attention croissante de la part des chercheurs (Cserép, 2021). Des études montrent que les microglies peuvent phagocyter les neurones lors de la neurodégénérescence, de lésions cérébrales aiguës et d'infections (Sierra, 2010; Fekete, 2018; Janda, 2018). Il est intéressant de noter que les microglies et les astrocytes phagocytent différentes parties des neurones mourants. Plus précisément, les microglies migrent et engloutissent le soma et les dendrites apicales, tandis que les astrocytes engloutissent les petits corps apoptotiques dendritiques (Damisah, 2020).
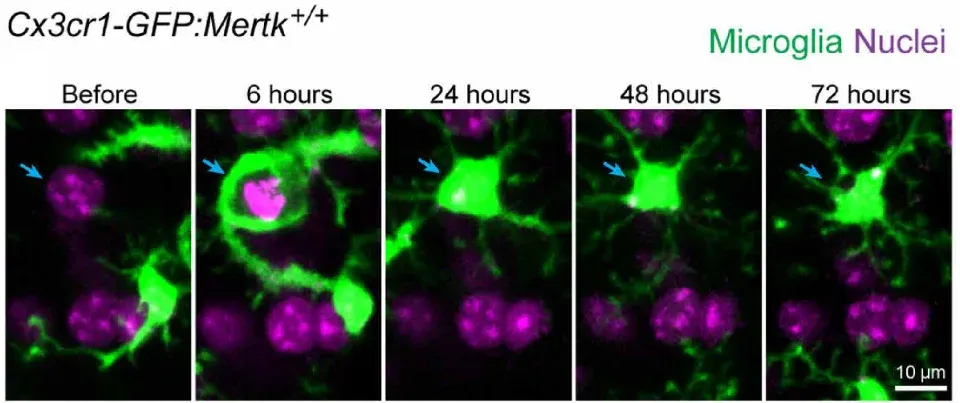
Imagerie en accéléré de la phagocytose microgliale d'un neurone mourant chez une souris vivante. Les microglies sont représentées en vert (Cx3cr1-GFP) et les noyaux (DAPI) en violet. Le noyau du neurone mourant est indiqué par une flèche bleue. Figure reproduite à partir de Damisah et al. (Damisah, 2020) sous licence Creative Commons Attribution.
Pour phagocyter spécifiquement les neurones endommagés, les microglies doivent être capables de détecter l'état de santé des neurones. Cserép et al. ont proposé un site pour évaluer la santé neuronale au niveau d'une jonction spécialisée présente dans la plupart des neurones, située entre les processus microgliaux et le soma neuronal, appelée jonction purinergique somatique (Cserép, 2020, 2021). Du côté des microglies, ces jonctions sont enrichies en récepteurs purinergiques P2Y12R, nécessaires à leur formation. Du côté neuronal, les jonctions sont enrichies en clusters Kv2.1, connus pour jouer un rôle dans l'exocytose et associés aux mitochondries, à la membrane associée aux mitochondries (MAM), à la protéine 1 associée à la membrane lysosomale (LAMP1) et au transporteur vésiculaire de nucléotides (vNUT). La longueur de ces contacts est trois fois plus longue que celle des contacts entre les processus et les neurites. Ils sont liés à la fois à l'activité mitochondriale neuronale et à l'activité neuronale. Dans un modèle de lésion cérébrale aiguë, des études montrent une augmentation de la fréquence de ces interactions. De plus, lorsque ces interactions sont éliminées par le blocage du P2Y12R, la pathologie s'aggrave, ce qui suggère un rôle neuroprotecteur de ces interactions. En outre, ces jonctions somatiques sont également présentes dans le cerveau en développement, où l'inactivation du P2Y12R entraîne une perturbation de la cytoarchitecture corticale (Cserép, 2022).
Les mitochondries neuronales, avec leurs rôles diversifiés, offrent non seulement un indicateur potentiel de l'état cellulaire, mais aussi une opportunité pour les microglies d'influencer des fonctions neuronales clés. Celles-ci comprennent le seuil de décharge, la prolifération, l'homéostasie calcique, les décisions relatives au destin cellulaire et le métabolisme (Hall, 2012; Rugarli, 2012; Chandel, 2014; Kasahara, 2014; Tepikin, 2018; Styr, 2019). Si le rôle des jonctions somatiques dans les maladies neurodégénératives reste à élucider, on sait que la fonction mitochondriale est altérée dans de nombreuses maladies neurodégénératives, ce qui suggère que ces jonctions pourraient être altérées dans ces conditions.
Axonale
Les microglies interagissent également avec les neurones au niveau de l'axone et du segment initial de l'axone (AIS). Si les gradients de facteurs sécrétés sont les principaux moteurs de la guidage axonal, les microglies jouent également un rôle dans ce processus, notamment en agissant comme des repères (Squarzoni, 2014). À l'âge adulte, les microglies migrent vers les axones neuronaux hyperactifs, facilitant la repolarisation membranaire (Kato, 2016). La clairance des axones dégénérés par les microglies favorise la régénération neuronale (Bechmann, 2001; Neumann, 2009), et les microglies jouent un rôle pro-régénératif dans les processus de remyélinisation (Lloyd, 2019). Les interactions entre les microglies et l'AIS commencent tôt au cours du développement, se poursuivent tout au long de la vie et sont conservées chez différentes espèces (Baalman, 2015). De plus, les microglies interagissent avec les axones diffusément lésés à la suite d'un traumatisme crânien (Lafrenaye, 2015), et leurs interactions avec l'AIS sont associées à une perturbation de l'intégrité de l'AIS dans l'encéphalomyélite auto-immune expérimentale (Clark, 2016).
Comment les interactions directes entre les microglies et les neurones évoluent-elles dans les maladies neurodégénératives?
Maladie d'Alzheimer (MA)
Dans la MA, les microglies contribuent à la neurodégénérescence par engloutissement synaptique et phagocytose via la signalisation du complément (C1q, C3) (Hong, 2016; Shi, 2017; Rajendran, 2018; Vogels, 2019) et la signalisation du récepteur déclencheur exprimé sur les cellules myéloïdes 2 (TREM2) (Fracassi, 2023). Il est intéressant de noter que ces interactions directes entre les microglies et les neurones semblent être médiées par les interactions entre les microglies et les astrocytes. L'élimination de l'APOE4 astrocytaire diminue la phagocytose microgliale de la perte synaptique induite par les synapses et la protéine tau (Wang, 2021). Sokolova et al. (Sokolova, 2024) ont découvert un sous-type d'astrocytes présentant une morphologie unique, appelés astrocytes «bulbeux», qui sécrètent le modulateur phagocytaire MFG-E8, nécessaire et suffisant pour l'engloutissement des synapses par les microglies dans leur environnement local. La suppression spécifique de Mfge8 chez les astrocytes réduit la perte synaptique et l'engloutissement des synapses par les microglies dans deux modèles murins différents de la MA.
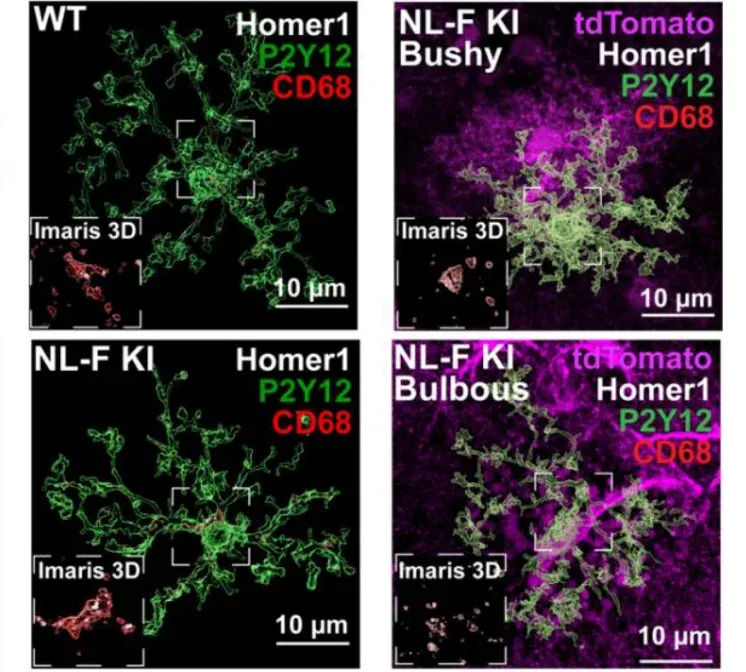
Enveloppement de synapses par des microglies à proximité d'astrocytes bulbeux. Images de Homer1 post-synaptique excitateur (blanc), de lysosomes CD68 (rouge), d'astrocytes (violet) et de microglies P2Y12 (vert). Figure reproduite à partir de Sokolova et al. (Sokolova, 2024) sous licence Creative Commons Attribution.
Les réseaux périneuronaux (PNN) sont une matrice extracellulaire (MEC) spécialisée qui entoure le soma et les processus de certains neurones, principalement des interneurones inhibiteurs exprimant la parvalbumine (PV+) qui jouent un rôle essentiel dans la cognition (Reichelt, 2019). Les PNN jouent un rôle vital dans la plasticité synaptique en stabilisant les synapses après la période de plasticité accrue pendant le développement. On pense également qu'elles jouent un rôle protecteur en agissant comme une barrière physique pour les neurones qu'elles entourent. Crapser et al. (Crapser, 2020) ont montré que les PNN diminuent dans un modèle murin de la MA ainsi que dans le cerveau humain atteint de MA. Cette diminution des PNN est suivie d'une perte d'interneurones PV+. Les microglies engloutissent le matériel des PNN et leur déplétion empêche la perte des PNN. Comme il a été rapporté que les PNN protègent les neurones contre les agrégats de tau et d'amyloïde (Brückner, 1999; Miyata, 2007; Suttkus, 2016; Reichelt, 2019), cette interaction entre les microglies et les neurones pourrait constituer un autre axe de neurodégénérescence.
von Saucken et al. (von Saucken, 2020) ont découvert qu'avant l'accumulation de plaques, les microglies présentent des changements morphologiques et s'engagent préférentiellement avec les neurones contenant de l'amyloïde bêta. Ces contacts directs entre les microglies et les neurones sont mesurés entre les processus et le soma, entre le soma et le soma, et entre les processus et les neurites. La phagocytose microgliale des neurites est plus importante dans les régions où la charge en bêta-amyloïde est plus élevée. Si le TREM2 est nécessaire aux changements morphologiques, il n'est pas indispensable à l'engagement préférentiel des neurones porteurs d'amyloïde ni à la différence de phagocytose des neurites. Il est intéressant de noter que dans un modèle murin MPTP de la maladie de Parkinson (MP), une augmentation des contacts soma-soma se produit avant l'engloutissement et la phagocytose des neurones par les microglies (Barcia, 2012), ce qui suggère que ce processus pourrait faire partie du modèle amyloïde bêta.
Puigdellívol et al. ont découvert un rôle pour la phagocytose microgliale des neurones dans les modèles de MA avec injection d'amyloïde bêta et de souris P301S tau (Puigdellívol, 2021). La suppression du récepteur P2Y6 (P2Y6R) des microglies, qui est nécessaire à la phagocytose des neurones par les microglies, empêche à la fois la perte neuronale et la perte de mémoire.
Tauopathies
De même, les microglies engloutissent les synapses dans le modèle murin transgénique tau-P301S de la MA, ce qui entraîne une diminution de la densité synaptique (Dejanovic, 2018). Le marquage par C1q est corrélé à l'accumulation de phospho-tau dans les densités postsynaptiques (PSD), et un anticorps bloquant C1q réduit l'engloutissement des synapses par les microglies et augmente la densité synaptique.
En plus de la tau extracellulaire, les microglies phagocytent les neurones vivants contenant des agrégats de tau (Brelstaff, 2018). La sécrétion de MFG-E8 par les microglies est nécessaire à la phagocytose des neurones porteurs d'agrégats dans les co-cultures cellulaires, mais pas à la localisation des microglies vers ces neurones dans un modèle murin de tauopathie. De plus, dans des extraits de cerveau humain provenant de patients atteints de FTDP-17 et de démence frontotemporale de Pick (FTD), on observe une augmentation des niveaux de MFG-E8, mais pas chez les patients atteints de FTD C9orf72.
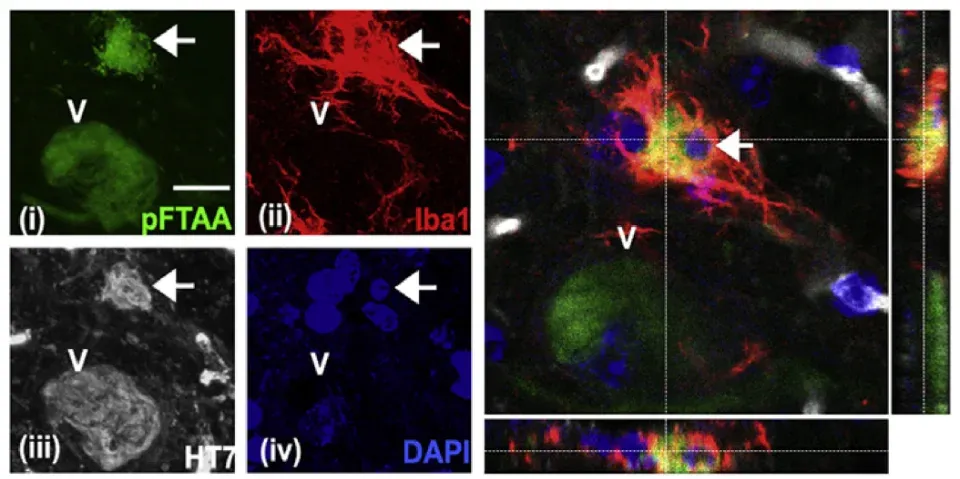
Engloutissement d'un neurone contenant des agrégats de tau (pFTAA, en vert) par des microglies (Iba-1, en rouge) chez des souris P301S âgées de 5 mois, avec la tau P301S humaine (HT7) représentée en blanc et les noyaux (DAPI, en bleu). Une image confocale en empilement Z montre l'engloutissement complet du neurone (indiqué par une flèche blanche) par les microglies. Figure reproduite à partir de Brelstaff et al. (Brelstaff, 2018) sous licence Creative Commons Attribution.
L'interaction directe entre le CX3CL1 lié à la membrane neuronale et le CX3CR1 des microglies permettrait de réduire l'inflammation et de maintenir les microglies dans un état de surveillance (Szepesi, 2018). En conséquence, les knock-outs de CX3CL1 (Lee, 2014; Bemiller, 2018) ou de CX3CR1 (Bhaskar, 2010) augmentent la phosphorylation de la protéine tau et la neuroinflammation chez des modèles murins. Le ligand soluble clivé CX3CL1 ne permet pas de sauver les knock-out (Lee, 2014; Bemiller, 2018), ce qui indique que ces interactions se produisent de manière juxtacrine. On ignore actuellement dans quel(s) compartiment(s) ces interactions se produisent. Cependant, les jonctions purinergiques somatiques pourraient constituer un site intéressant, car la durée de vie de ces interactions s'est avérée plus de trois fois plus longue que sur les neurites, ce qui offrirait davantage d'opportunités pour la transmission du signal.
Sclérose latérale amyotrophique (SLA) et démence frontotemporale (DFT)
Les agrégats de TDP-43 sont une caractéristique de la SLA, et environ la moitié des patients atteints de DFT présentent des agrégats de TDP-43. Dans la SLA, les changements dans l'expression génétique des microglies surviennent avant ceux des neurones (Maniatis, 2019). Les microglies deviennent également réactives, et la microgliose est corrélée aux scores cliniques des motoneurones supérieurs des patients (Brettschneider, 2012). À l'aide du modèle murin inductible TDP-43NLS, Xie et al. (Xie, 2024) montrent une augmentation de l'hyperactivité corticale neuronale au début de l'évolution de la maladie. Cette hyperactivité corticale est suivie de l'apparition de microglies en forme de bâtonnets, qui atteignent leur pic trois semaines après l'arrêt du dox et diminuent ensuite. Les microglies en forme de bâtonnets interagissent étroitement avec les dendrites, en particulier les dendrites apicales des neurones pyramidaux, s'alignant le long de leurs axes et phagocytant largement les synapses excitatrices. La suppression de TREM2 réduit la fraction de microglies non ramifiées (y compris celles en forme de bâtonnets), augmentant l'hyperactivité neuronale et les déficits moteurs, et réduisant la survie.
Les modèles de DFT familiale et de SLA apportent également des éclaircissements sur les interactions entre les microglies et les neurones. La déficience en progranuline due à des mutations du gène GRN est l'une des principales causes de la DFT génétique. Les souris Grn-/- présentent une protéinopathie TDP-43 dépendante de l'âge ainsi qu'une réactivité microgliale (Lui, 2016; Zhang, 2020). Ce modèle subit également un élagage synaptique et une neurodégénérescence dépendants des microglies, qui sont sauvés par la suppression de C1q et/ou C3 (Lui, 2016; Zhang, 2020).
Les expansions répétées du gène C9orf72 sont une cause génétique de la DFT et de la SLA. La déficience en C9orf72 chez la souris fait passer les microglies d'un état homéostatique statique à un état inflammatoire (Lall, 2021). Les souris C9orf72-/- présentent un élagage synaptique cortical dépendant de l'âge et des déficiences dans les comportements d'apprentissage et de mémoire. L'élagage synaptique accru est reproduit en inactivant spécifiquement C9orf72 dans les microglies. En outre, un modèle murin de MA présentant une déficience en C9orf72 (5XFAD/C9orf72-/-) montre également un élagage synaptique accru, mais avec une charge plaque réduite.
Notre équipe se fera un plaisir de répondre à toutes vos questions concernant les interactions entre les microglies et les neurones et les maladies neurodégénératives, ou de vous fournir des informations spécifiques sur les modèles de de maladies neurodégénératives que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur la neuroinflammation et les meilleures pratiques en matière d'évaluation des agents thérapeutiques dans les modèles animaux de maladies neurodégénératives.
Morphologie de la microglie dans la SLA, la maladie d'Alzheimer et la maladie de Parkinson
Une vue d'ensemble de l'analyse morphologique des microglies et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.
Microglie, astrocytes et protéine tau dans les maladies neurodégénératives
Comment la neuroinflammation induite par les cellules gliales favorise l'agrégation et la propagation de la protéine tau ainsi que la perte neuronale dans la maladie d'Alzheimer et d'autres tauopathies.
Dysfonctionnement mitochondrial dans les microglies et les astrocytes
Le rôle du dysfonctionnement mitochondrial dans les microglies et les astrocytes dans les maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson et la SLA.
Activation microgliale dans un modèle de souris PFF à α-synucléine
Nous avons quantifié l'activation microgliale, sur la base de la morphologie, dans un modèle murin d'ensemencement et d'étalement de fibrilles préformées d'α-synucléine (PFF) de la maladie de Parkinson.
Amyloïde-β et microenvironnement inflammatoire chez la souris Alzheimer
Nous avons analysé les relations spatiales complexes entre les plaques β-amyloïdes, la microglie activée et au repos, et les astrocytes dans un modèle transgénique APP/PS1.