Cette ressource décrit:
Qu'est-ce que l'autophagie de la microglie?
Les microglies sont des cellules immunitaires résidentes du système nerveux central (SNC) qui jouent un rôle essentiel dans le maintien de l'homéostasie cérébrale. Ces cellules très dynamiques contribuent à réguler la barrière hémato-encéphalique (BHE), à éliminer les synapses et à coordonner les réponses immunitaires. En surveillant en permanence leur environnement, les microglies détectent et éliminent les agents pathogènes, les débris cellulaires et les agrégats protéiques, souvent par l'intermédiaire de récepteurs tels que les récepteurs Toll (TLR).
Lorsque des agrégats de protéines neurotoxiques s'accumulent, ils stimulent la libération de cytokines pro-inflammatoires telles que l'interleukine-1β (IL-1β) et le facteur de nécrose tumorale-alpha (TNF-alpha). Cette situation crée un environnement pro-inflammatoire qui accélère le mauvais repliement et l'agrégation des protéines, alimentant un cercle vicieux de neuroinflammation et de lésions neuronales. Bien que la plupart des recherches se soient concentrées sur les neurones, les agrégats protéiques s'accumulent également dans les cellules gliales, y compris les microglies, ce qui les implique dans la pathologie neurodégénérative.
L'autophagie et la phagocytose sont deux processus cellulaires clés de dégradation. La phagocytose élimine principalement les débris extracellulaires, tandis que l'autophagie cible les composants intracellulaires, tels que les organites endommagés et les protéines mal repliées, et les dirige vers les lysosomes pour y être dégradés. Dans les microglies, l'autophagie contribue non seulement au contrôle de la qualité intracellulaire, mais aussi à la régulation de l'activité immunitaire. Cette fonction devient de plus en plus importante avec le vieillissement, car l'efficacité de l'autophagie diminue, ce qui est une caractéristique reconnue du vieillissement.
L'autophagie se présente sous trois formes principales (Jülg, 2021). La microautophagie implique l'engloutissement direct de matériel cytosolique par les lysosomes. L'autophagie médiée par des chaperons cible sélectivement des protéines spécifiques sur la base de la reconnaissance des chaperons. La macroautophagie, le type le plus étudié, implique la formation d'autophagosomes à double membrane qui engloutissent des composants cellulaires et fusionnent ensuite avec les lysosomes pour former des autolysosomes en vue de leur dégradation.
La macroautophagie est étroitement régulée par des protéines liées à l'autophagie (ATG). Ce processus comprend l'activation du complexe ULK1, la formation du complexe Beclin1-PIK3C3 et la conversion de LC3-I en LC3-II (Jülg, 2021). Les principaux régulateurs comprennent le complexe 1 de la cible mammalienne de la rapamycine (mTORC1), qui inhibe l'autophagie, et la protéine kinase activée par l'AMP (AMPK), qui la favorise. Une autophagie adéquate dépend du maintien d'un équilibre entre ces signaux opposés (Lin, 2023; Ou-Yang, 2023). Dans les microglies, d'autres voies de régulation comprennent la signalisation p38 MAPK et la protéine adaptatrice p62, souvent utilisée comme marqueur de l'altération de l'autophagie (Lin, 2023; Ou-Yang, 2023).
De nouvelles preuves soulignent le rôle de l'autophagie microgliale dans la régulation de l'inflammation du SNC (Zhu, 2022). Lorsque l'autophagie est perturbée, les fonctions essentielles des microglies, telles que la phagocytose et la régulation immunitaire, sont altérées, ce qui entraîne une neuroinflammation chronique (Zhu, 2022). La neuroinflammation étant une caractéristique déterminante de nombreuses maladies neurodégénératives, l'autophagie agit comme un mécanisme protecteur en éliminant les médiateurs inflammatoires avant qu'ils n'atteignent des niveaux nocifs. Lorsque ce système échoue, une inflammation persistante et des lésions neuronales s'ensuivent (Lin, 2023).
Une fonction anti-inflammatoire centrale de l'autophagie microgliale est la suppression de l'inflammasome NLRP3, un complexe multiprotéique qui active les cytokines pro-inflammatoires. Une autophagie altérée entraîne une activation accrue du NLRP3, contribuant à la neurotoxicité. Cette relation est réciproque : l'activité du NLRP3 peut également perturber l'autophagie, formant une boucle de rétroaction qui joue un rôle clé dans la dérégulation immunitaire du SNC.
Bien que les études axées sur les neurones aient dominé la recherche sur l'autophagie, de plus en plus de données soutiennent l'hypothèse selon laquelle le dysfonctionnement de l'autophagie microgliale contribue de manière significative aux maladies neurodégénératives. L'amélioration de l'activité autophagique dans les microglies fait actuellement l'objet de recherches en tant qu'approche thérapeutique. En améliorant l'élimination des protéines mal repliées et en atténuant l'inflammation chronique, la restauration de l'autophagie dans les microglies pourrait ralentir ou prévenir la progression des troubles causés à la fois par l'agrégation des protéines et le déséquilibre immunitaire.
Comment l'autophagie de la microglie est-elle altérée dans les maladies neurodégénératives telles que la MA, la MP et la SLA?
La maladie d'Alzheimer (MA)
La MA, la maladie neurodégénérative la plus répandue, se caractérise par un déclin cognitif progressif et l'accumulation de plaques amyloïdes bêta (Aβ) extracellulaires et d'enchevêtrements tau intracellulaires. Les microglies jouent un double rôle dans la MA, participant à la fois à l'élimination des agrégats pathologiques et à l'inflammation (Cho, 2014).
Les principaux régulateurs liés à l'autophagie impliqués dans la fonction microgliale dans la MA comprennent PPAR-α, Atg1, Map1lc3b et BECN1. L'activation de PPAR-α renforce l'autophagie dans les microglies humaines et les modèles murins de MA, ce qui entraîne une réduction de la charge en plaques Aβ, une amélioration des performances cognitives et une augmentation de l'activité gliale à proximité des plaques (Luo, 2020). À l'inverse, l'inhibition de Atg1 ou Map1lc3b altère la dégradation de A&beta et augmente la signalisation inflammatoire dans des modèles expérimentaux (Cho, 2014)
La perte partielle de la fonction BECN1 chez la souris entraîne une augmentation de l'activité de l'inflammasome NLRP3 microglial et une production accrue d'IL-1β et d'IL-18 (Houtman, 2019). Chez les souris APP/PS1 présentant une expression réduite de BECN1 , on observe une activation plus importante de NLRP3 et de la caspase-1. Des études d'imagerie à super-résolution confirment la colocalisation de NLRP3 avec des vésicules LC3-positives, ce qui suggère que l'autophagie pourrait dégrader directement les composants de l'inflammasome (Houtman, 2019).
Ces résultats sont corroborés par des données humaines. Les microglies isolées chez des patients atteints de la MA présentent des taux réduits de Beclin1, ce qui contribue probablement à une altération de la clairance de l'A&beta en raison d'une formation et d'une fonction phagocytaire compromises des autophagosomes (Lucin, 2013). Après la phagocytose de l'A&beta, les microglies le dégradent par un mécanisme impliquant la LC3-II et la protéine adaptatrice optineurine (OPTN), régulé par la voie STK11/LKB1-AMPK&alpha. Ces découvertes renforcent le rôle essentiel de l'autophagie intacte dans la limitation de l'accumulation de l'A&beta et de l'inflammation dans la MA.
La maladie de Parkinson (MP)
La MP est la deuxième maladie neurodégénérative la plus courante, caractérisée par la dégénérescence progressive des neurones dopaminergiques dans la substance noire compacte (SNc). Sur le plan clinique, la MP se manifeste par des symptômes moteurs, tels que des tremblements, une rigidité, une bradykinésie et une instabilité posturale, ainsi que par des symptômes non moteurs, notamment un déclin cognitif et des troubles du sommeil. La caractéristique pathologique est l'accumulation d'alpha-synucléine dans les corps de Lewy et les neurites.
L'autophagie microgliale est essentielle à la régulation de l'inflammation et à l'élimination de l'alpha-synucléine. Un excès d'alpha-synucléine perturbe le flux autophagique et induit un stress oxydatif. Le gène DJ-1, lié à la MP familiale, régule l'autophagie microgliale. Sa délétion altère l'élimination de l'alpha-synucléine et amplifie l'inflammation (Nash, 2017). La suppression de l'Atg5 dans les microglies augmente l'activation du NLRP3 et aggrave la perte neuronale dans le modèle MPTP (Qin, 2021). L'inhibition pharmacologique de la Drp1 rétablit l'autophagie et réduit l'accumulation d'alpha-synucléine (Fan, 2019).
L'alpha-synucléine extracellulaire inhibe l'autophagie par le biais des voies de signalisation p38 et Akt/mTOR médiées par TLR4. Le blocage de l'une de ces voies contribue à restaurer la fonction autophagique (Tu, 2021). Les microglies participent également à la « synucléinephagie », un processus autophagique sélectif de dégradation de l'alpha-synucléine libérée par les neurones, qui dépend de la signalisation TLR4 et de l'induction de p62 par NF-κB (Choi, 2020).
Le vieillissement aggrave ces altérations. Les souris âgées retiennent l'alpha-synucléine plus longtemps que les souris jeunes après injection d'alpha-synucléine humaine, ce qui indique un déclin de l'efficacité autophagique lié à l'âge qui contribue à la progression de la maladie (Hong, 2024).
Sclérose latérale amyotrophique (SLA)
La SLA est une maladie neurodégénérative progressive et mortelle caractérisée par la perte de motoneurones. Elle se caractérise par des inclusions cytoplasmiques de TDP-43 et est génétiquement liée à des mutations des gènes C9ORF72 et SOD1. L'activation et le dysfonctionnement des microglies sont importants dans la pathologie de la SLA, bien que le rôle spécifique de l'autophagie soit moins bien compris.
Les cellules de type microglial dérivées de cellules souches pluripotentes induites humaines (hiPSC-MG) présentant des mutations du gène PFN1 présentent une altération de l'autophagie et de la phagocytose (Funes, 2024). Ces déficits sont inversés par la rapamycine, ce qui indique un mécanisme dépendant de l'autophagie (Funes, 2024). Les microglies dérivées de hiPSC présentant des mutations C9ORF72 montrent une autophagie réduite et une activité immunitaire accrue, tandis que la stimulation pharmacologique de l'autophagie améliore la survie des motoneurones (Banerjee, 2023).
Chez les sourisSOD1G93A ALS croisées avec des lignées de rapporteurs LC3, le flux microglial et astrocytaire augmente pendant les phases symptomatiques, bien que cette réponse soit absente chez les oligodendrocytes (Perera, 2025). De plus, le dysfonctionnement autophagique apparaît plus tôt dans la moelle épinière que dans le cortex moteur, ce qui indique une spécificité régionale et cellulaire dans la progression de la maladie (Perera, 2025).
Ensemble, les données issues de la MA, de la MP et de la SLA suggèrent l'existence d'un mécanisme commun dans lequel l'autophagie microgliale altérée favorise l'accumulation de protéines et l'inflammation chronique, accélérant ainsi la dégénérescence neuronale. L'amélioration de l'autophagie dans les microglies pourrait donc constituer une stratégie viable pour ralentir la progression de la maladie.
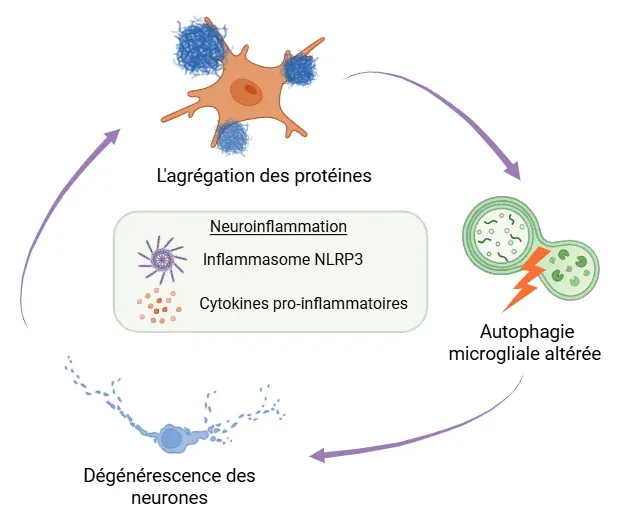
Illustration d'une boucle de rétroaction entre l'accumulation de protéines mal repliées, l'autophagie microgliale altérée et la dégénérescence neuronale. Au centre du cycle se trouve la neuroinflammation, provoquée par l'activation de l'inflammasome NLRP3 et la libération de cytokines pro-inflammatoires.
Comment cibler l'autophagie de la microglie à des fins thérapeutiques dans le traitement des maladies neurodégénératives?
Le ciblage de l'autophagie microgliale offre une voie thérapeutique prometteuse pour le traitement des maladies neurodégénératives telles que la MA, la MP et la SLA. Bien qu'il n'existe actuellement aucun traitement approuvé qui module sélectivement l'autophagie microgliale, de plus en plus de preuves précliniques soutiennent l'idée que le renforcement de l'activité autophagique peut améliorer l'élimination des protéines pathologiques, réduire l'inflammation et favoriser l'homéostasie du SNC.
Plusieurs agents pharmacologiques ont été étudiés. La rapamycine, un inhibiteur de mTOR, induit l'autophagie et réduit l'expression de l'alpha-synucléine médiée par TLR2 (Dzamko, 2017). Cependant, dans les modèles de SLA, la rapamycine a exacerbé la perte de motoneurones (Zhang, 2011), et les essais cliniques n'ont pas encore démontré de bénéfices significatifs (Mandrioli, 2023). La metformine, qui active l'AMPK, a montré des effets neuroprotecteurs dans des modèles de la maladie de Parkinson en réduisant l'agrégation de l'alpha-synucléine, bien que son impact direct sur l'autophagie microgliale reste incertain (Lu, 2016). La fluoxétine améliore l'autophagie microgliale en augmentant les niveaux de LC3-II et la formation d'autophagosomes, avec un potentiel de réduction de l'inflammation et d'élimination des agrégats (Park, 2021). Le kaempférol stimule l'autophagie dans les microglies et supprime l'activation du NLRP3, réduisant ainsi la sécrétion de cytokines dans les microglies (Han, 2019). Le tréhalose, un inducteur de l'autophagie, s'est révélé prometteur dans les premières études sur la SLA, mais les résultats d'essais cliniques récents n'ont pas été concluants (HEALEY ALS Platform Trial, 2025).
Compte tenu de ces résultats mitigés, les chercheurs développent des stratégies d'administration spécifiques à chaque type de cellule. Les nanoparticules qui traversent la BHE et ciblent les microglies, telles que les NP MCPZFS, ont démontré leur capacité à améliorer la clairance de l'A&beta et à réduire la libération de cytokines. Ces particules pourraient rediriger la dégradation des protéines de l'autophagie vers les voies protéasomales (Liu, 2019). Toutefois, des défis tels que la pénétration de la BHE, la précision du ciblage et la variabilité des nanoparticules demeurent (Lin, 2023).
L'oxyde de graphène (GO), un nanomatériau à base de carbone, favorise l'autophagie en inhibant la signalisation mTOR par l'activation de l'AMPK. Il a été démontré que le GO améliore la clairance microgliale de l'A&beta et réduit la neurotoxicité dans des modèles de maladie (Li, 2020).
Des approches de thérapie génique sont également à l'étude. Les vecteurs adéno-associés (AAV) avec des promoteurs spécifiques aux cellules gliales permettent une régulation ciblée des gènes de l'autophagie dans les microglies (O'Carroll, 2021). Cette approche présente des avantages par rapport aux médicaments systémiques, notamment en raison de la difficulté à traverser la BHE.
La combinaison d'inducteurs de l'autophagie et d'inhibiteurs de l'inflammasome pourrait apporter des avantages synergiques. Le ciblage simultané des deux voies s'est avéré plus efficace pour supprimer l'accumulation de protéines et l'inflammation que l'une ou l'autre intervention seule (Wang, 2023).
En résumé, si la plupart des stratégies visant à moduler l'autophagie microgliale en sont encore à un stade précoce de développement, le domaine progresse rapidement. Des travaux supplémentaires sont nécessaires pour affiner les systèmes d'administration, améliorer la spécificité cellulaire et établir la sécurité à long terme. Les thérapies qui restaurent l'autophagie dans les microglies sont très prometteuses pour ralentir la neurodégénérescence en agissant à la fois sur la protéinopathie et la dérégulation immunitaire.
Notre équipe se fera un plaisir de répondre à toutes vos questions concernant l'autophagie microgliale altérée dans les maladies neurodégénératives ou de vous fournir des informations spécifiques sur les modèles que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur la neuroinflammation et les meilleures pratiques en matière d'évaluation des agents thérapeutiques dans les modèles animaux de maladies neurodégénératives.
Dysfonctionnement lysosomal dans les microglies et les astrocytes
Un aperçu du dysfonctionnement lysosomal dans la microglie et les astrocytes, et de son rôle dans les maladies neurodégénératives.
Autophagie, maladie de Parkinson et neurones dopaminergiques
Une vue d'ensemble de la façon dont une autophagie déficiente peut conduire à des changements pathologiques et à la neurodégénérescence des neurones dopaminergiques dans la maladie de Parkinson.
Autophagie et maladies neurodégénératives
An overview of how cellular autophagy plays a role in brain health and neurodegeneration.
Inflammasome NLRP3 et maladies neurodégénératives
Un aperçu de l'inflammasome NLRP3 et de son rôle dans les maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson et la SLA.
TNF-α et microglie dans les maladies neurodégénératives
Un aperçu de la fonction du facteur de nécrose tumorale alpha (TNF-α) dans la microglie et de sa contribution à la progression de la neurodégénérescence.
Autophagie et facteur de transcription EB (TFEB)
Aperçu du facteur de transcription EB (TFEB) et de son rôle dans l'autophagie et les maladies neurodégénératives.
