Cette ressource décrit:
- Comment l'alpha-synucléine, les microglies et les astrocytes contribuent-ils au développement de la maladie de Parkinson?
- Comment les modèles murins sont-ils utilisés pour étudier l'interaction entre la pathologie de l'alpha-synucléine et la neuroinflammation?
- Quelles stratégies thérapeutiques sont en cours de développement pour cibler l'alpha-synucléine et la neuroinflammation?
Comment l'alpha-synucléine, les microglies et les astrocytes contribuent-ils au développement de la maladie de Parkinson?
Caractéristiques cliniques et pathologiques de la maladie de Parkinson
La maladie de Parkinson (MP) est la maladie neurodégénérative liée au mouvement la plus courante et la deuxième maladie neurodégénérative la plus répandue, touchant 2 à 3 % des personnes âgées de plus de 65 ans (Poewe, 2017). Avec l'augmentation de l'espérance de vie mondiale, le fardeau de la MP devrait s'alourdir considérablement.
Cette maladie est classée parmi les α-synucléinopathies (ou synucléinopathies), un groupe hétérogène de maladies caractérisées par l'accumulation d'α-synucléine mal repliée. L'α-synucléine se compose de trois domaines : une extrémité N-terminale, un domaine non amyloïde β (NAC) et une extrémité C-terminale. Dans des conditions normales, l'alpha-synucléine intervient dans le transport vésiculaire et la libération des neurotransmetteurs, notamment par son rôle dans l'assemblage du complexe SNARE (Calabresi, 2023). Cependant, lorsque sa synthèse ou son élimination est perturbée, l'alpha-synucléine peut se mal replier et s'agréger en oligomères et en fibrilles. Ces formes agrégées d'alpha-synucléine se propagent selon un schéma stéréotypé dans les régions du cerveau (Braak, 2003), formant des corps de Lewy (LB) et des neurites de Lewy (LN). Il est intéressant de noter que la présence et la distribution de la pathologie de Lewy ne sont pas toujours corrélées à la gravité clinique, ce qui suggère que l'agrégation de l'alpha-synucléine est un élément d'un processus pathologique plus large. Si le facteur déclenchant de l'agrégation de l'alpha-synucléine reste incertain, des facteurs tels que la neuroinflammation, le dysfonctionnement mitochondrial et le stress oxydatif semblent contribuer à ce processus (Borsche, 2021; Chen, 2023).
La MP se manifeste par des symptômes moteurs et non moteurs. Les symptômes moteurs caractéristiques (bradykinésie, tremblements au repos et rigidité) sont principalement attribués à la perte progressive de neurones dopaminergiques dans la substance noire compacte (SNc). Les symptômes non moteurs comprennent la dépression, les troubles cognitifs, les troubles du sommeil et les dysfonctionnements gastro-intestinaux. Le diagnostic précoce de la MP est difficile, car les symptômes moteurs n'apparaissent généralement qu'après une perte importante de neurones dopaminergiques. Le diagnostic est encore compliqué par le chevauchement des caractéristiques cliniques avec d'autres troubles, tels que l'atrophie multisystématisée (AMS) et la paralysie supranucléaire progressive (PSP). Ces difficultés diagnostiques soulignent la nécessité de disposer de biomarqueurs validés à un stade précoce afin d'améliorer la détection de la maladie et la stratification thérapeutique.
Les mécanismes sous-jacents de la neurodégénérescence dans la MP restent mal compris, bien que divers facteurs, notamment génétiques, environnementaux et liés au vieillissement, aient été associés à la pathogenèse de la maladie. En outre, la dérégulation des réponses immunitaires innées et adaptatives pourrait jouer un rôle essentiel dans la pathogenèse de la MP. Par conséquent, le ciblage des voies inflammatoires pour le traitement de la MP a suscité un intérêt considérable (Li, 2021; Chen, 2023).
Rôle de la neuroinflammation dans la MP
La neuroinflammation est de plus en plus reconnue comme un facteur clé de la pathogenèse de la MP. L'activation chronique des réponses immunitaires au sein du système nerveux central (SNC), impliquant en particulier les cellules gliales telles que les microglies et les astrocytes, joue un rôle central dans la progression de la maladie. Les astrocytes et les microglies jouent un rôle majeur dans la réponse immunitaire, mais ils contribuent également au fonctionnement de la barrière hémato-encéphalique (BHE), à l'homéostasie du SNC, à la phagocytose, à la fonction synaptique, à l'équilibre ionique et au soutien métabolique. En réponse à des agressions environnementales, telles que des toxines, des infections ou des lésions, les cellules gliales adoptent un phénotype réactif et pro-inflammatoire et peuvent libérer des cytokines pro-inflammatoires, telles que l'interleukine-1 β (IL-1β) et le facteur de nécrose tumorale alpha (TNF-α).
L'inflammasome NLRP3, un complexe multiprotéique qui répond aux signaux de stress cellulaire, notamment l'accumulation de protéines mal repliées et agrégées comme l'alpha-synucléine, est un médiateur majeur de l'inflammation induite par les cellules gliales. Une fois activé, l'inflammasome NLRP3 favorise la libération de cytokines pro-inflammatoires, notamment l'IL-1β et l'interleukine-18 (IL-18), exacerbant ainsi la neuroinflammation et les lésions neuronales.
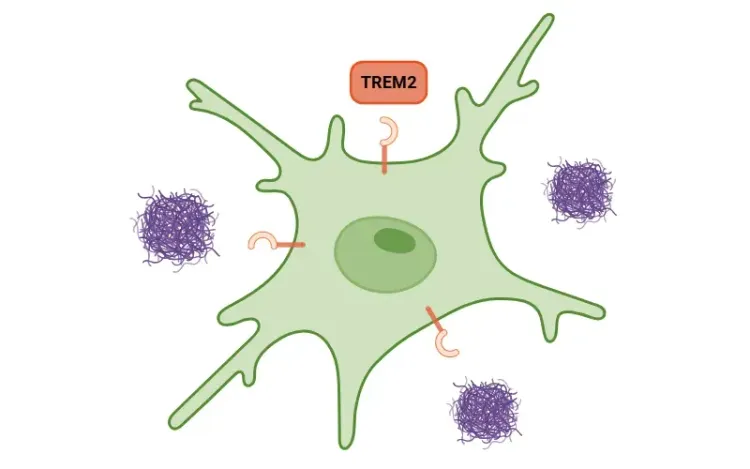
Des preuves soutiennent l'implication précoce de la neuroinflammation et de la réactivité microgliale dans la SN des patients atteints de la MP, suggérant une fenêtre d'intervention thérapeutique (Gerhard, 2006; Edison, 2013). La réactivité microgliale dans la MP est associée à une réduction du récepteur déclencheur exprimé sur les cellules myéloïdes 2 (TREM2), un récepteur exprimé dans la microglie qui est impliqué dans la neuroinflammation et la phagocytose (Huang, 2021). Des études montrent que l'augmentation des niveaux de TREM2 renforce l'autophagie, diminue la mort des neurones dopaminergiques et améliore la motricité chez des modèles murins de MP (Huang, 2021). De plus, il a été démontré que la déficience en TREM2 active l'inflammasome NLRP3, dont l'activation a été détectée dans la SNc de cerveaux atteints de la maladie de Parkinson (Gordon, 2018; Huang, 2024). Dans des modèles murins de la maladie de Parkinson, l'inhibition de NLRP3 réduit la perte de neurones dopaminergiques, diminue la sécrétion de cytokines pro-inflammatoires, améliore la fonction motrice et prévient la pathologie de l'alpha-synucléine en soulageant l'autophagie (Gordon, 2018; Lee, 2019; Ou, 2021).
Pour une analyse approfondie du rôle du TREM2 dans la fonction microgliale, voir: TREM2 et microglies
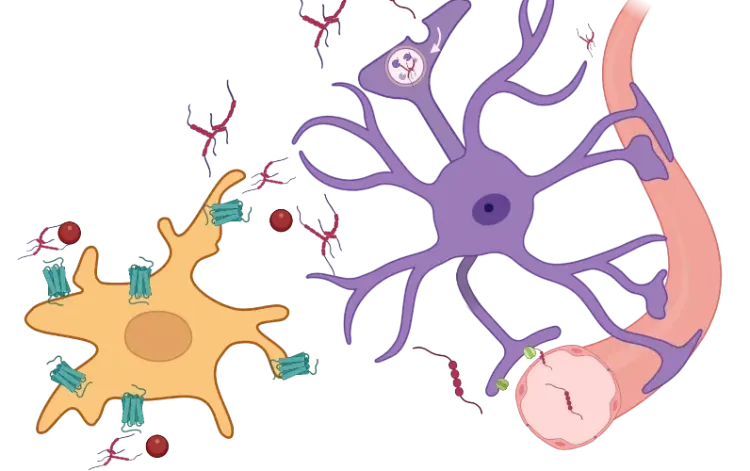
L'alpha-synucléine agrégée joue un rôle central dans cette cascade inflammatoire (Wang, 2016). l'alpha-synucléine active les microglies via les récepteurs Toll-like (TLR), en particulier TLR2 et TLR4, ce qui entraîne l'activation de NF-kappaB et la transcription de cytokines pro-inflammatoires, telles que l'IL-1 et le TNF-alpha (Karpenko, 2018; Feng, 2019). Le NF-κB régule également l'expression de l'inflammasome NLRP3 dans les microglies, ce qui entraîne une libération supplémentaire de cytokines (Wang, 2024). Ces cytokines endommagent non seulement directement les neurones, mais stimulent également les astrocytes à devenir réactifs et à adopter un état pro-inflammatoire. De plus, l'alpha-synucléine interagit avec les composants mitochondriaux, altérant la fonction, la dynamique et la biogenèse mitochondriales, induisant des espèces réactives de l'oxygène (ERO) et contribuant à la mort cellulaire (Grünewald, 2019; Jeon, 2020). Cette boucle de rétroaction positive amplifie la neuroinflammation dans la MP et contribue à la perte progressive des neurones dopaminergiques dans la SNc (Calabresi, 2023).

L'alpha-synucléine mal repliée et agrégée active les astrocytes et les microglies, déclenchant la transcription médiée par NF-kappaB de cytokines pro-inflammatoires (par exemple, IL-1 et TNF-alpha) et l'amorçage de l'inflammasome NLRP3 dans les microglies. L'activation ultérieure de l'inflammasome entraîne une libération supplémentaire de cytokines. Ces facteurs de stress favorisent l'agrégation de l'alpha-synucléine, le dysfonctionnement mitochondrial et les lésions neuronales, perpétuant ainsi un cycle auto-amplificateur de neuroinflammation chronique et de neurodégénérescence dopaminergique dans la SNc.
Outre le système immunitaire inné, la réponse immunitaire adaptative est également impliquée dans la MP. Des lymphocytes T cytotoxiques ont été observés dans la SN de patients atteints de MP, ce qui suggère une infiltration immunitaire périphérique dans le SNC. Des lymphocytes T CD4+ et CD8+ ont été détectés dans les régions cérébrales touchées chez des patients et dans des modèles animaux (Brochard, 2009). Il est intéressant de noter que l'inhibition du NLRP3 réduit l'infiltration des lymphocytes T CD4+ et CD8+ dans la SNc, ce qui confirme le rôle de l'inflammasome NLRP3 dans l'inflammation adaptative (Grotemeyer, 2023). Il convient de souligner que la déplétion des lymphocytes T CD4+ dans des modèles murins réduit la mort des neurones dopaminergiques, ce qui confirme le rôle pathogène de l'immunité adaptative dans la MP (Brochard, 2009).
Les recherches soulignent également le rôle potentiel de l'axe intestin-cerveau dans la modulation de la neuroinflammation (Houser, 2017). Des altérations de la composition du microbiote intestinal et de la perméabilité intestinale peuvent favoriser l'inflammation via des médiateurs inflammatoires circulants provenant de l'intestin. Ces résultats suggèrent que l'inflammation systémique originaire de l'extérieur du SNC pourrait jouer un rôle dans l'apparition ou la progression de la MP et pourrait refléter l'une des premières manifestations de la pathologie de la MP (Houser, 2017).
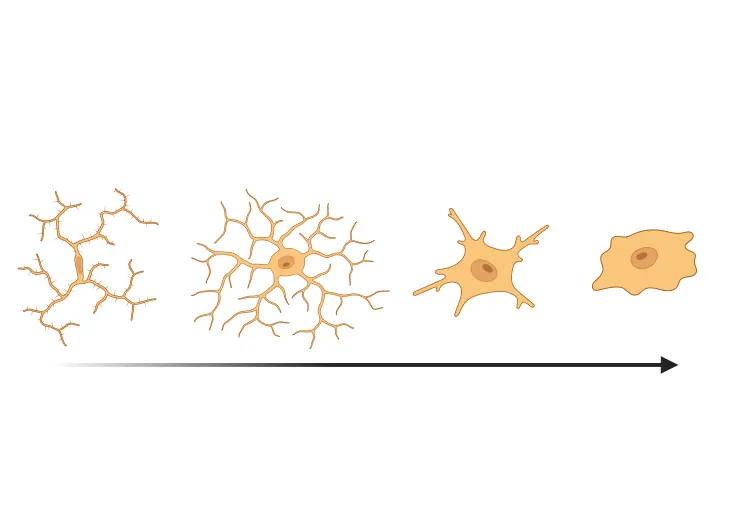
En outre, le vieillissement, principal facteur de risque de la MP, est associé à la sénescence microgliale et à une neuroinflammation chronique. Les microglies sénescentes s'accumulent dans le cerveau vieillissant, y compris dans la SNc, et adoptent un phénotype réactif et pro-inflammatoire (Shaerzadeh, 2020). Les microglies sénescentes présentent une libération accrue de ROS et de cytokines pro-inflammatoires (par exemple, TNF-α et IL-1β), une accumulation de fer et une capacité phagocytaire réduite (Hong, 2024). Il est important de noter que les souris âgées présentent des niveaux plus élevés d'alpha-synucléine et une clairance plus lente de l'alpha-synucléine, probablement en raison d'un dysfonctionnement lié à l'âge du système autophagique-lysosomal (Hong, 2024). Cette capacité réduite de clairance de l'alpha-synucléine liée à l'âge pourrait avoir un impact critique sur la pathologie de la MP, en entretenant la neuroinflammation et la vulnérabilité des neurones dopaminergiques.
En conclusion, la neuroinflammation représente un mécanisme central dans la pathologie de la MP, avec des composants immunitaires innés et adaptatifs contribuant à la progression de la maladie. Une détection précoce grâce à des biomarqueurs neuroinflammatoires pourrait permettre un diagnostic plus précis (Chen, 2023; Youssef, 2023). Ces biomarqueurs pourraient également orienter le développement de thérapies immunomodulatrices ciblées visant à stopper ou à ralentir la progression de la maladie.
Facteurs génétiques influençant l'interaction entre l'α-synucléine et les cellules gliales
Les contributions génétiques à la MP sont bien reconnues, notamment plusieurs mutations connues dans les gènes SNCA, DJ-1, PRKN, PINK1, GBA1 et LRRK2. Le gène SNCA, qui code pour l'alpha-synucléine, est un facteur majeur de la MP familiale. Les mutations du gène SNCA (par exemple A53T et A30P), ainsi que les duplications ou triplications, sont associées à des formes autosomiques dominantes de la maladie. En outre, les variants du gène SNCA figurent parmi les facteurs de risque génétiques les plus importants identifiés dans les études d'association pangénomique de la MP idiopathique (Edwards, 2010). Les facteurs génétiques contribuant à la MP sont également liés à un dysfonctionnement mitochondrial et à une neuroinflammation (Saijo, 2009; Yao, 2023). Par exemple, les mutations du gène LRRK2 (leucine-rich repeat kinase 2) sont associées à un dysfonctionnement mitochondrial, notamment un dysfonctionnement des voies lysosomales et une altération de la mitophagie (Borsche, 2021). Dans des modèles murins, l'inactivation du gène LRRK2 réduit l'activation microgliale et la perte neuronale, tandis que l'inhibition pharmacologique de LRRK2 diminue à la fois la neuroinflammation et la neurodégénérescence (Daher, 2014, 2015). Par conséquent, l'identification d'un «sous-type mitochondrial» de la MP grâce au profilage des biomarqueurs a conduit au développement de thérapies géniques spécifiques, qui pourraient permettre des stratégies de traitement plus personnalisées (Borsche, 2021).
Comment les modèles murins sont-ils utilisés pour étudier l'interaction entre la pathologie de l'alpha-synucléine et la neuroinflammation?
Plusieurs modèles murins de la MP ont été développés, notamment des approches transgéniques, knock-in, knock-out, neurotoxiques, induites par des fibrilles préformées d'alpha-synucléine (PFF) et induites par des vecteurs viraux. Plusieurs de ces modèles reproduisent certaines des principales caractéristiques pathologiques et déficits comportementaux associés à la MP. Cependant, les modèles animaux qui vont au-delà des principales caractéristiques pathologiques et élucident le rôle de la neuroinflammation et du dysfonctionnement mitochondrial dans la MP constituent une ressource particulièrement précieuse (Dovonou, 2023).
Les modèles neurotoxiques sont largement utilisés dans la recherche sur la MP, en particulier le MPTP, qui induit une neurotoxicité dopaminergique aiguë et des troubles moteurs importants. L'un des avantages de ce modèle est qu'il produit une activation microgliale robuste, l'activation de l'inflammasome NLRP3 et la libération de cytokines pro-inflammatoires dans la SN (Lee, 2019). De même, les lésions du système dopaminergique induites par injection intracrânienne de 6-hydroxydopamine (6-OHDA) entraînent à la fois des troubles moteurs et des phénotypes non moteurs. Cependant, la pertinence des modèles neurotoxiques est limitée par l'absence d'agrégation de l'alpha-synucléine ou de formation d'inclusions de type corps de Lewy. Malgré ces limites, les modèles neurotoxiques sont adaptés à l'étude des processus de stress oxydatif et de la neuroinflammation (Dovonou, 2023).
Des souris transgéniques surexprimant des mutations humaines de type sauvage (WT) ou liées à la MP dans différents gènes sous divers promoteurs sont également largement utilisées. Ces modèles sont importants pour étudier la fonction des gènes liés à la MP. Par exemple, des modèles transgéniques exprimant les mutations WT, A53T, A30P ou E46K du gène SNCA ont été utilisés pour reproduire la pathologie de la MP in vivo. Il convient de noter que certains modèles transgéniques, tels que le modèle murin surexprimant le gène LRRK2 G2019S, présentent une neuroinflammation et un dysfonctionnement mitochondrial (Dovonou, 2023). Cependant, malgré leurs avantages, il a été suggéré que les modèles qui induisent directement le mauvais repliement et l'ensemencement de l'alpha-synucléine pourraient reproduire plus fidèlement les mécanismes pathologiques liés à la MP (Calabresi, 2023).
Une approche pertinente sur le plan pathologique consiste à injecter des PFF d'alpha-synucléine dans des régions spécifiques du cerveau. Ces fibrilles ensemencent l'alpha-synucléine endogène et propagent la pathologie, imitant la progression spatio-temporelle de la pathologie de la MP. Il convient de noter que les injections de PFF déclenchent de fortes réponses microgliales et une signalisation pro-inflammatoire, reliant directement le mauvais repliement de l'alpha-synucléine à l'activation immunitaire, tout en réduisant le TREM2, en augmentant le TLR4 et en renforçant la libération de cytokines, ce qui confirme la relation entre la pathologie de l'alpha-synucléine et la neuroinflammation (Thomsen, 2021; Niskanen, 2025).
Les modèles basés sur des vecteurs viraux, en particulier ceux utilisant des virus adéno-associés (AAV), permettent l'expression localisée de l'alpha-synucléine humaine WT ou mutée dans des régions spécifiques du cerveau, telles que la SNc. Cette approche permet de déclencher une pathologie de type PD étendue impliquant l'agrégation de l'alpha-synucléine, un dysfonctionnement neuronal et la mort cellulaire, qui se développe progressivement au fil du temps (Ulusoy, 2010; Lundblad, 2012; Bourdenx, 2015; Phan, 2017). En outre, la surexpression de l'alpha-synucléine humaine induite par l'AAV entraîne l'activation des microglies dans le SN, le recrutement du système immunitaire adaptatif et la production de cytokines pro-inflammatoires (Theodore, 2008; Sanchez-Guajardo, 2010). Ainsi, les modèles AAV fournissent des informations précieuses sur la pathologie de la MP, y compris la neuroinflammation, tout en permettant un ciblage spécifique à une région.
En résumé, les modèles murins restent essentiels pour étudier l'interaction entre la pathologie de l'alpha-synucléine et la neuroinflammation dans la MP. Bien que chaque modèle présente à la fois des avantages et des limites, ils fournissent collectivement des informations précieuses sur les mécanismes de la maladie et les cibles thérapeutiques. Il convient de noter que les modèles PFF de l'alpha-synucléine et les modèles à vecteur viral reproduisent fidèlement les principales caractéristiques pathologiques et immunitaires, ce qui justifie leur utilisation dans les essais précliniques de thérapies modificatrices de la maladie.
Quelles stratégies thérapeutiques sont en cours de développement pour cibler l'alpha-synucléine et la neuroinflammation?
Le traitement actuel de la MP consiste principalement à prendre en charge les symptômes moteurs à l'aide de thérapies dopaminergiques, la lévodopa (L-DOPA) restant la référence. Les schémas thérapeutiques associent souvent la lévodopa à des agonistes de la dopamine, des inhibiteurs de la COMT ou des inhibiteurs de la MAO-B afin d'optimiser la disponibilité dopaminergique. Cependant, bien qu'efficace au début, leur utilisation à long terme est associée à des complications telles que des dyskinésies, des fluctuations motrices et divers effets secondaires non moteurs.
Contrairement à ces traitements symptomatiques, les stratégies modificatrices de la maladie constituent un axe de recherche majeur. Parmi celles-ci, les immunothérapies et les agents anti-agrégants ciblant l'alpha-synucléine occupent une place particulièrement importante (Chatterjee, 2019; Alfaidi, 2024). Ces approches visent à interférer avec l'accumulation et la propagation pathologique de l'alpha-synucléine, ainsi qu'avec les réponses inflammatoires déclenchées dans les cellules gliales.
Approches immunitaires
Les stratégies d'immunisation passive et active se sont révélées prometteuses à un stade précoce. Les agents d'immunisation active sont conçus pour provoquer une réponse immunitaire contre l'alpha-synucléine. Les vaccins à base de peptides, AFFITOPE® PD01A et PD03A, sont des vaccins actifs conçus pour générer une réponse immunitaire contre les formes oligomériques de l'alpha-synucléine, dans le but de réduire son agrégation et sa propagation. Ces vaccins ont fait l'objet d'une série d'essais cliniques de phase 1 qui ont démontré leur innocuité et leur efficacité, le PD03A générant des titres d'anticorps plus faibles que le PD01A (Volc, 2020; Poewe, 2021). Le PD01A a depuis été reformulé et rebaptisé ACI-7104.056. Il fait actuellement l'objet d'un essai de phase 2 (NCT06015841). UB-312, un autre vaccin à base de peptides synthétiques conçu pour induire une immunité active contre l'alpha-synucléine pathogène, est actuellement en phase 1b d'essai (NCT05634876) après une phase 1a qui a montré une réduction significative de l'alpha-synucléine dans le LCR chez un sous-groupe de patients (Eijsvogel, 2024).
Dans le domaine de l'immunisation passive, le PRX002 (prasinezumab), un anticorps monoclonal IgG1 humanisé ciblant le C-terminal de l'alpha-synucléine agrégée, a démontré une affinité élevée pour les formes pathologiques par rapport aux monomères. Les données de phase 1b ont montré qu'il était sûr, bien toléré et qu'il réduisait l'alpha-synucléine libre dans le sérum (Jankovic, 2018). Bien qu'un essai de phase 2 (NCT03100149) n'ait pas atteint son critère d'efficacité principal, des analyses exploratoires ont suggéré un ralentissement des symptômes moteurs chez certains sous-groupes de patients (Pagano, 2022; 2024). D'autres anticorps monoclonaux ont donné des résultats mitigés. Le BIIB054 (cinpanemab), un anticorps monoclonal qui cible l'alpha-synucléine agrégée, n'a pas démontré d'efficacité clinique ou radiologique dans un essai de phase 2 (Lang, 2022). En revanche, le BAN0805 (exidavnemab), un anticorps monoclonal conçu pour se lier sélectivement à l'alpha-synucléine agrégée et l'éliminer, a montré une réduction dose-dépendante de l'alpha-synucléine plasmatique et une bonne tolérance en phase 1. Il est actuellement en phase 2a d'évaluation (NCT06671938) (Boström, 2024).
Le ciblage de la voie neuroinflammatoire NLRP3 est une autre stratégie prometteuse. Le VTX3232, un inhibiteur de l'inflammasome NLRP3 pénétrant dans le cerveau, vise à supprimer l'activation microgliale et la libération de cytokines en aval. Il fait actuellement l'objet d'un essai de phase 2a chez des patients atteints de la maladie de Parkinson à un stade précoce (NCT06556173). De même, le VENT-02, un inhibiteur de NLRP3 pénétrant dans le cerveau, fait actuellement l'objet d'un essai de phase 1b, après un essai de phase 1a qui a montré une inhibition significative de l'IL-1β dans le sang (NCT06822517).
Obstacles et progrès dans le développement de traitements modificateurs de la maladie
L'un des principaux défis dans le développement de traitements modificateurs de la maladie est la difficulté à diagnostiquer la MP de manière précoce et précise. À ses stades prodromiques, les symptômes de la MP se confondent souvent avec ceux d'autres troubles parkinsoniens, ce qui complique la stratification des essais et le choix du moment opportun pour le traitement. L'absence de biomarqueur fiable pour suivre la progression de la maladie limite encore davantage la capacité à évaluer l'efficacité du traitement.
Pour relever ces défis, des techniques telles que l'imagerie cérébrale avancée et les biomarqueurs liquides, comme la chaîne légère des neurofilaments, sont à l'étude afin de faciliter le diagnostic précoce, de suivre la neurodégénérescence et d'améliorer la conception des essais cliniques. Des efforts importants ont également été déployés pour identifier des biomarqueurs liés à l'alpha-synucléine et à la neuroinflammation. Ces biomarqueurs pourraient offrir une fenêtre thérapeutique avant qu'une perte neuronale importante ne se produise. Les biomarqueurs basés sur des marqueurs neuroinflammatoires semblent prometteurs pour la détection précoce de la MP, et la combinaison de plusieurs marqueurs, y compris des marqueurs inflammatoires, pourrait améliorer la précision du diagnostic (Chen, 2023; Youssef, 2023).
Les futurs traitements de la MP combineront probablement des traitements ciblant l'alpha-synucléine avec des agents qui modulent l'inflammation et la fonction mitochondriale. Des approches personnalisées basées sur des profils génétiques ou des biomarqueurs pourraient améliorer l'efficacité, tandis que les progrès en matière d'administration des médicaments et d'intervention précoce pourraient améliorer les résultats.
Notre équipe se fera un plaisir de répondre à toutes vos questions concernant les microglies, les astrocytes et l'alpha-synucléine dans la maladie de Parkinson, ou de vous fournir des informations spécifiques sur les modèles de MP que nous utilisons pour nos études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur la neuroinflammation et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans des modèles animaux de maladies neurodégénératives.
TREM2 et microglies
Présentation générale du TREM2, de son rôle dans les microglies, de ses liens avec les maladies neurodégénératives et de ses implications potentielles en matière de traitement.
Microglie, astrocytes et protéine tau dans les maladies neurodégénératives
Comment la neuroinflammation induite par les cellules gliales favorise l'agrégation et la propagation de la protéine tau ainsi que la perte neuronale dans la maladie d'Alzheimer et d'autres tauopathies.
Activation microgliale dans un modèle de souris PFF à α-synucléine
Nous avons quantifié l'activation microgliale, sur la base de la morphologie, dans un modèle murin d'ensemencement et d'étalement de fibrilles préformées d'α-synucléine (PFF) de la maladie de Parkinson.
Modèles AAV d'α-synucléine pour le développement de médicaments contre la maladie de Parkinson
Vue d'ensemble des modèles de souris et de rats à α-synucléine induite par un vecteur du virus adéno-associé (AAV), à utiliser dans les études précliniques de thérapeutiques modificatrices de la maladie.
Autophagie, maladie de Parkinson et neurones dopaminergiques
Une vue d'ensemble de la façon dont une autophagie déficiente peut conduire à des changements pathologiques et à la neurodégénérescence des neurones dopaminergiques dans la maladie de Parkinson.
Dysfonctionnement mitochondrial dans les microglies et les astrocytes
Le rôle du dysfonctionnement mitochondrial dans les microglies et les astrocytes dans les maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson et la SLA.
Sénescence microgliale et maladies neurodégénératives
Cette ressource fournit un aperçu de la sénescence microgliale et de son rôle dans les maladies neurodégénératives, notamment la maladie d'Alzheimer (MA) et la maladie de Parkinson (MP).
Inflammasome NLRP3 et maladies neurodégénératives
Un aperçu de l'inflammasome NLRP3 et de son rôle dans les maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson et la SLA.
TNF-α et microglie dans les maladies neurodégénératives
Un aperçu de la fonction du facteur de nécrose tumorale alpha (TNF-α) dans la microglie et de sa contribution à la progression de la neurodégénérescence.