Qu'est-ce que le NLRP3?
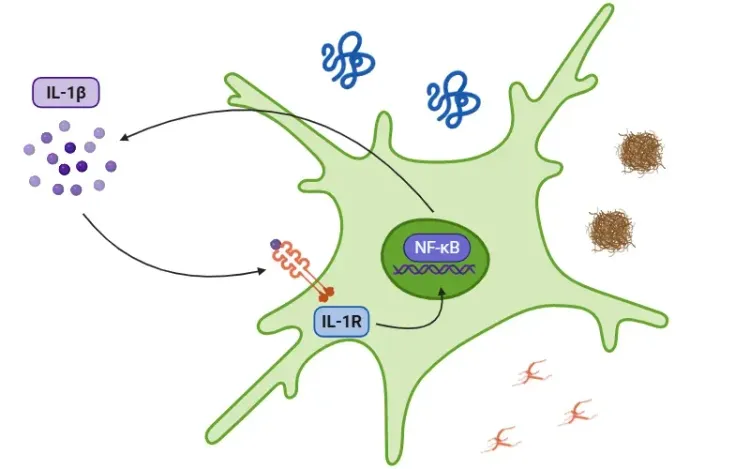
Le NLRP3 (protéine 3 contenant le domaine pyrine du récepteur NOD), également appelé cryopyrine, est une protéine cytosolique qui agit comme un capteur de signaux nocifs ou liés au stress dans le système immunitaire inné. Il détecte divers signaux de danger, tels que des dommages cellulaires ou un stress, et déclenche la formation d'un complexe protéique plus important, appelé « inflammasome ».
Ce processus commence lorsque NLRP3 recrute ASC (une molécule adaptatrice) et la pro-caspase-1. Ensemble, ils forment l'inflammasome, et leur assemblage conduit à l'activation de la caspase-1, une enzyme clé de la réponse inflammatoire. La caspase-1 clive ensuite les cytokines pro-inflammatoires telles que l'IL-1β et l'IL-18 en leurs formes actives, qui sont libérées par la cellule et favorisent l'inflammation. L'activation de NLRP3 peut également entraîner le clivage de la gasdermine D (GSDMD) par la caspase-1, déclenchant la pyroptose, une forme de mort cellulaire programmée qui amplifie encore l'inflammation.
Le NLRP3 est activé par les PAMP (motifs moléculaires associés aux pathogènes) et les DAMP (motifs moléculaires associés aux dommages), qui sont des signaux provenant de microbes ou de cellules endommagées.
Exemples de stimuli activant NLRP3:
- Toxines bactériennes ou ARN viral (PAMP)
- ATP extracellulaire, cristaux d'acide urique ou agrégats protéiques tels que la bêta-amyloïde (Aβ) (DAMP)
Si l'inflammasome NLRP3 est essentiel à la défense de l'hôte, son activation persistante peut entraîner une inflammation chronique et contribuer à des lésions tissulaires.
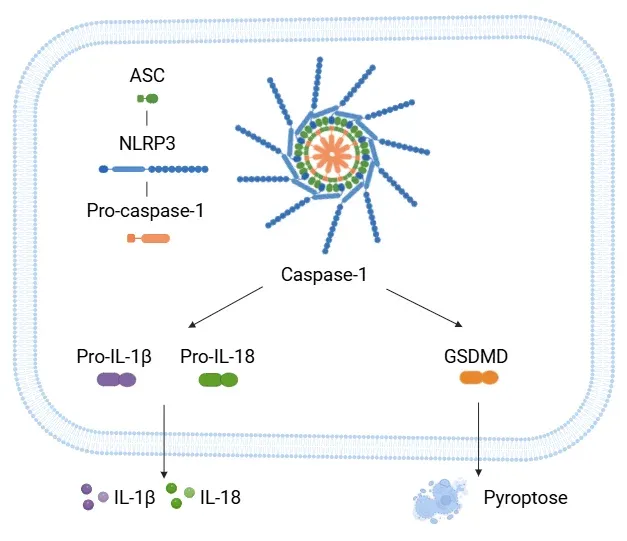
Voie d'activation du NLPR3.
L'inflammasome NLRP3 est composé de NLRP3, ASC et pro-caspase-1. Lors de son activation, le complexe favorise la scission de la pro-caspase-1 en caspase-1 active, qui à son tour transforme la pro-IL-1β et la pro-IL-18 en leurs formes actives de cytokines. La caspase-1 clive également le GSDMD, entraînant la pyroptose.
Le NLRP3 est le membre le plus étudié de la famille des inflammasomes, mais il fait partie d'un réseau plus vaste qui comprend d'autres capteurs formant des inflammasomes, tels que le NLRP1, l'AIM2 et le NLRC4. Ces récepteurs réagissent chacun à différents types de stress cellulaire. Le NLRP1 a été associé à des maladies auto-immunes et à des inflammations cutanées, l'AIM2 détecte l'ADN cytosolique et est impliqué dans des maladies inflammatoires, et le NLRC4 réagit à la flagelline bactérienne et intervient dans les inflammations gastro-intestinales. Il est essentiel de comprendre l'interaction entre ces inflammasomes, car de nombreuses maladies impliquent plusieurs voies.
Quel rôle jouent le NLRP3 et d'autres inflammasomes dans les maladies neurologiques et systémiques?
Les inflammasomes contribuent à un large éventail de maladies touchant à la fois le système nerveux central (SNC) et les organes et tissus périphériques. Dans le SNC, leur activation chronique est de plus en plus reconnue comme un facteur déterminant de la neurodégénérescence.
Dans la maladie d'Alzheimer (MA), la maladie de Parkinson (MP) et la sclérose latérale amyotrophique (SLA), des protéines mal repliées telles que Aβ, tau, α-synucléine et TDP-43 agissent comme des DAMPs, activant NLRP3 (Holbrook, 2021; Singh, 2023; Wang, 2024). Cette activation entraîne une inflammation persistante et des lésions neuronales. Des études de knockout chez des souris dépourvues de composants NLRP3 montrent une réduction de la pathologie et un ralentissement de la progression de la maladie, ce qui confirme l'utilité de l'inhibition de NLRP3 comme intervention thérapeutique pour les maladies neurodégénératives (Heneka, 2013; Qiao, 2017; Ising, 2019; Lee, 2019).
Consultez notre ressource, Inflammasome NLRP3 et maladies neurodégénératives, pour une analyse détaillée du rôle de l'inflammasome NLRP3 dans les maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson et la sclérose latérale amyotrophique.
Autres inflammasomes impliqués dans les maladies du SNC:
- AIM2 : surexprimé dans la MA et la MP (Yang, 2024)
- NLRP1 : associé à la mort neuronale pyroptotique dans les modèles de MA (Singh, 2023)
En dehors du SNC, NLRP3 contribue à plusieurs maladies inflammatoires et métaboliques chroniques. Dans le diabète de type 2, l'activation de NLRP3 est associée à une résistance à l'insuline, en particulier dans le tissu adipeux (Nițulescu, 2023). Dans les maladies cardiovasculaires, l'activation de NLRP3 favorise la formation de plaques dans l'athérosclérose (Tanase, 2023). Dans la goutte, l'acide urique est le déclencheur (Kim, 2022). NLRP3 joue également un rôle dans la réponse inflammatoire aux maladies infectieuses, notamment la COVID-19 et la grippe (Li, 2024).
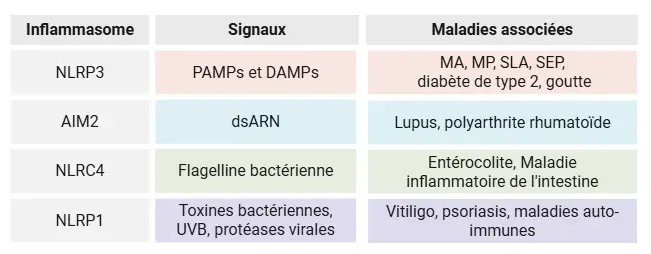
Tableau mettant en évidence la diversité des capteurs inflammasomes, les types de stimuli externes qui les activent et leurs rôles dans diverses affections inflammatoires, neurodégénératives, auto-immunes et métaboliques.
Est-il possible de cibler l'inflammasome NLRP3 et les voies associées pour traiter des maladies?
Compte tenu de son rôle dans de nombreuses maladies, l'inflammasome NLRP3 constitue une cible thérapeutique importante. Les chercheurs explorent activement des médicaments capables de supprimer l'activité de NLRP3 en toute sécurité sans compromettre la défense immunitaire (Blevins, 2022).
Les stratégies thérapeutiques comprennent:
- Inhibiteurs directs : le MCC950 est un inhibiteur sélectif de NLRP3 qui réduit l'inflammation dans des modèles animaux de maladies neurodégénératives (Gordon, 2018; Blevins, 2022; Grotemeyer, 2023). Des agents oraux, tels que le dapansutrile (OLT117) et l'usnoflast (ZYIL1), sont en cours de développement clinique.
- Bloqueurs en aval : le VX-765 inhibe sélectivement la caspase-1, tandis que le disulfirame bloque la gasdermine D afin de réduire l'inflammation et la mort cellulaire. L'IC100, un inhibiteur de l'ASC, vise à empêcher l'assemblage de l'inflammasome (Wang, 2024).
Certaines maladies impliquent plusieurs inflammasomes fonctionnant en parallèle. Ce scénario a suscité un intérêt pour les inhibiteurs doubles ou à large spectre, en particulier pour des affections complexes telles que la SLA (Clénét, 2023).
Malgré les progrès réalisés, des défis majeurs subsistent. L'administration d'agents thérapeutiques à travers la barrière hémato-encéphalique constitue un obstacle majeur pour les maladies neurologiques. En outre, une immunosuppression à long terme peut augmenter le risque d'infection, et la redondance des voies inflammatoires signifie que l'inhibition de NLRP3 peut ne pas être efficace dans tous les contextes pathologiques.
Notre équipe se fera un plaisir de répondre à toutes vos questions concernant le NLRP3 ou de vous fournir des informations spécifiques sur les modèles de maladies neurodégénératives que nous utilisons pour nos études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur la neuroinflammation et les meilleures pratiques en matière d'évaluation des agents thérapeutiques dans les modèles animaux de maladies neurodégénératives.
Qu'est-ce qu'un inflammasome?
Présentation générale des inflammasomes, notamment leurs mécanismes d'action, leur rôle dans les maladies et leur ciblage pour le développement de médicaments.
Inflammasome NLRP3 et maladies neurodégénératives
Un aperçu de l'inflammasome NLRP3 et de son rôle dans les maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson et la SLA.
Qu'est-ce que l'IL-1β?
Présentation générale de l'IL-1β, de son rôle pro-inflammatoire dans les maladies systémiques et neurologiques, et des stratégies thérapeutiques impliquant l'antagonisme de l'IL-1β.
Interleukine-1 bêta (IL-1β) et maladies neurodégénératives
Le rôle de l'IL-1bêta dans les maladies neurodégénératives, notamment la maladie d'Alzheimer (MA), la maladie de Parkinson (MP) et la sclérose latérale amyotrophique (SLA).
Dysfonctionnement lysosomal dans les microglies et les astrocytes
Un aperçu du dysfonctionnement lysosomal dans la microglie et les astrocytes, et de son rôle dans les maladies neurodégénératives.
Dysfonctionnement mitochondrial dans les microglies et les astrocytes
Le rôle du dysfonctionnement mitochondrial dans les microglies et les astrocytes dans les maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson et la SLA.