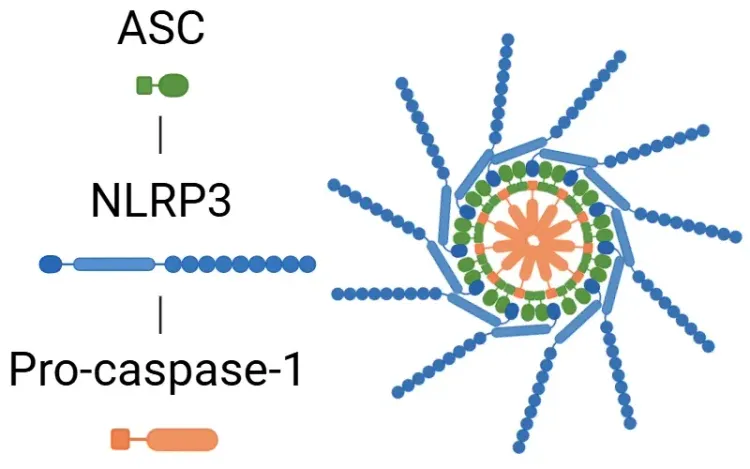
Qu'est-ce que l'inflammasome NLRP3?
L'inflammasome NLRP3, le plus étudié des inflammasomes, est un complexe multiprotéique qui joue un rôle essentiel dans la régulation du système immunitaire inné et de la signalisation inflammatoire, et qui est impliqué dans le développement de diverses maladies immunitaires et inflammatoires. Sa voie d'activation canonique est déclenchée lorsque des motifs moléculaires associés à des pathogènes (PAMP) ou des motifs moléculaires associés à des dommages dérivés de l'hôte (DAMP), libérés en réponse à une blessure ou à un stress cellulaire, sont détectés par des récepteurs de reconnaissance de motifs (PRR). Les récepteurs de type NOD (NLR), les récepteurs de type Toll (TLR) et les récepteurs de type absent in melanoma 2 (ALR) sont des types distincts de PRR qui reconnaissent les PAMP et les DAMP et préparent la cellule à l'activation ultérieure de l'inflammasome NLRP3.
L'inflammasome NLRP3 est composé de trois éléments principaux: (1) le NLRP3 en tant que capteur, (2) la protéine speck-like associée à l'apoptose contenant un domaine de recrutement de la caspase C-terminale (ASC) en tant qu'adaptateur, et (3) la pro-caspase-1 en tant qu'effecteur. La formation du processus inflammasome commence par la détection des PAMP ou des DAMPs. L'ASC se lie ensuite à la pro-caspase-1, la convertissant en caspase-1 active. À son tour, la caspase-1 active clive la pro-interleukine (IL)-1β et la pro-IL-18 en leurs formes actives, IL-1β et IL-18. La caspase-1 active également la gasdermine D (GSDMD), qui forme des pores membranaires, permettant la libération de ces cytokines pro-inflammatoires, et sert de déclencheur de la pyroptose.
Outre les maladies immunitaires et inflammatoires, l'inflammasome NLRP3 a également été impliqué dans la pathogenèse de maladies neurodégénératives telles que la maladie d'Alzheimer (AD), la maladie de Parkinson (PD) et la sclérose latérale amyotrophique (ALS) (Holbrook, 2021; Singh, 2023). Si la microglie et les astrocytes fournissent initialement des réponses immunitaires protectrices dans le SNC, leur activation chronique peut entraîner la propagation de la neuroinflammation, qui à son tour contribue à la progression de ces maladies neurodégénératives (Wang, 2024). Ainsi, les thérapies ciblant l'inflammasome NLRP3 retiennent l'attention en raison de leur potentiel à réduire l'inflammation chronique et à soulager les symptômes de la maladie.
Des études récentes explorant de petites molécules qui modulent l'activation du NLRP3 ont montré des résultats encourageants dans le blocage de l'inflammation chronique et l'amélioration des résultats de la maladie (Blevins, 2022). Bien qu'il y ait encore des défis à relever dans le développement de traitements efficaces ciblant l'inflammasome NLRP3 pour les maladies du SNC, comme le contournement de la barrière hémato-encéphalique (BHE), les progrès continus dans le développement de médicaments et les thérapies ciblées ouvriront la voie à des traitements efficaces à venir.
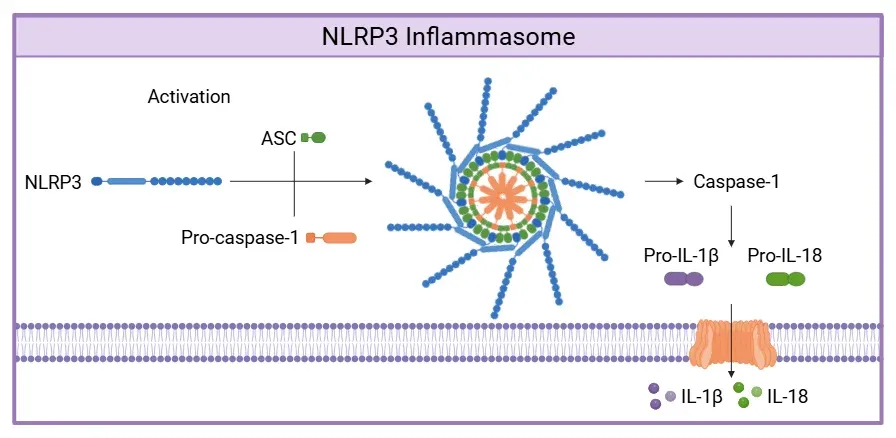
L'inflammasome NLRP3 est activé par la voie canonique lorsque NLRP3 détecte soit des PAMP, soit des DAMP (non représentés). Cette reconnaissance déclenche le recrutement de l'ASC et de la pro-caspase-1, conduisant à l'assemblage du complexe inflammasome NLRP3. Une fois formée, la caspase-1 active clive la pro-IL-1β et la pro-IL-18 en leurs formes actives, IL-1β et IL-18, ainsi que la GSDMD (non représentée). Le clivage de la GSDMD crée des pores membranaires qui permettent la libération de cytokines pro-inflammatoires, IL-1β et IL-18. Figure et légende adaptées de Wang et al. (Wang, 2024) sous licence Creative Commons Attribution.
Quel est le rôle de l'inflammasome NLRP3 dans la AD, la PD et la ALS?
Les maladies neurodégénératives, y compris la AD, la PD et la ALS, sont de plus en plus répandues. Ces troubles se caractérisent par l'accumulation progressive de protéines mal repliées dans diverses régions du SNC, entraînant une perte neuronale. Les principales protéines et pathologies impliquées sont les plaques amyloïdes-β (Aβ), les enchevêtrements neurofibrillaires tau hyperphosphorylés, les agrégats de α-synucléine (α-syn), ainsi que les inclusions de protéine de liaison à l'ADN TAR-43 (TDP-43) et de superoxyde dismutase 1 (SOD1).
Une conséquence critique de cette accumulation de protéines est l'activation de l'inflammasome NLRP3, qui déclenche la libération des cytokines pro-inflammatoires IL-1β et IL-18, contribuant à la neuroinflammation. De plus en plus de preuves soulignent le rôle central des inflammasomes dans la progression de la maladie, amplifiant l'inflammation et les dommages neuronaux. À mesure que notre compréhension de l'implication des inflammasomes s'élargit, l'exploration de leur activation dans ces maladies devient de plus en plus importante.
La maladie d'Alzheimer (AD)
La maladie d'Alzheimer est une maladie neurodégénérative progressive caractérisée par un déclin cognitif, des troubles de la mémoire et des changements de comportement et d'humeur. L'accumulation de plaques Aβ et d'enchevêtrements neurofibrillaires tau hyperphosphorylés est au cœur de la pathogenèse de la maladie d'Alzheimer. Cependant, la neuroinflammation joue également un rôle important dans la progression de la maladie. Dans la maladie d'Alzheimer, Aβ et tau agissent comme des DAMP, activant l'inflammasome NLRP3, en particulier dans la microglie. Cette activation entraîne la libération de cytokines pro-inflammatoires telles que l'IL-1β, exacerbant la neuroinflammation et accélérant la neurodégénérescence (Wang, 2024). En conséquence, les cellules immunitaires périphériques et les tissus cérébraux post-mortem des patients atteints de MA présentent des taux élevés d'IL-1β et d'IL-18, ainsi qu'une expression accrue des composants de l'inflammasome NLRP3, ASC et caspase-1, l'expression de l'ASC étant corrélée aux taux d'Aβ et de tau (Heneka, 2013; Saresella, 2016; Vontell, 2023).
De même, dans le modèle de souris AD APP/PS1, une augmentation du traitement de la caspase-1 a été observée (Heneka, 2013). Lorsque ces souris sont croisées avec des modèles déficients en NLRP3 ou caspase-1, la mémoire est préservée, ce qui suggère que NLRP3 et caspase-1 sont à l'origine de l'inflammation liée au dysfonctionnement cognitif dans la AD (Heneka, 2013). De plus, chez ces souris APP/PS1/NLRP3-/- ou APP/PS1/Casp-1-/-, la phagocytose des Aβ; est accrue, ce qui suggère que l'activation de l'inflammasome NLRP3 réduit la phagocytose des Aβ; (Heneka, 2013). Ensemble, ces résultats soutiennent l'hypothèse selon laquelle l'activation de l'inflammasome NLRP3 induite par Aβ accélère la progression de la AD en provoquant une réponse inflammatoire, contribuant ainsi à la détérioration cognitive et empêchant l'élimination de Aβ.
Outre la pathologie Aβ, l'activation de l'inflammasome NLRP3 entraîne également la pathologie tau. Chez les souris Tau22, des niveaux accrus de caspase-1, d'ASC et d'IL-1β ont été détectés (Ising, 2019). Conformément au rôle de l'activation de l'inflammasome NLRP3 dans la fonction cognitive de la AD, les souris Tau22 croisées avec ASC ou déficientes en NLRP3 présentent des niveaux plus faibles d'hyperphosphorylation et d'agrégation de la protéine tau, ainsi qu'une mémoire préservée (Ising, 2019). L'injection d'homogénat cérébral APP/PS1 chez des souris Tau22 induit une hyperphosphorylation de la protéine tau, mais cet effet est absent chez les souris Tau22/ASC-/- ou Tau22/NLRP3-/-, ce qui suggère que l'activité du NLRP3 est un élément essentiel de la cascade Aβ-tau (Ising, 2019). Compte tenu de son rôle clé dans la pathologie de la protéine Aβ et de la protéine tau, cibler l'inflammasome NLRP3 est une stratégie prometteuse qui pourrait apporter des avantages thérapeutiques et contribuer à ralentir la progression de la AD, ainsi que d'autres tauopathies (Heneka, 2013; Ising, 2019).
La maladie de Parkinson (PD)
La maladie de Parkinson, la deuxième maladie neurodégénérative la plus répandue après la maladie d'Alzheimer, se caractérise principalement par des symptômes moteurs tels que la rigidité musculaire, la bradykinésie et les tremblements de repos, ainsi que par des symptômes non moteurs, notamment des troubles de l'humeur comme la dépression et des troubles du comportement. La PD se caractérise par des signes distinctifs tels que la perte progressive des neurones dopaminergiques (DA) dans la substance noire compacte (SNc) et l'accumulation de corps de Lewy, qui sont principalement composés d'agrégats de α-syn. Outre ces caractéristiques, l'inflammation joue également un rôle crucial dans la pathologie de la MP (Li, 2021). Dans les tissus post-mortem de patients atteints de la MP, des taux accrus d'ASC et de NLRP3 ont été détectés, suggérant l'activation de l'inflammasome NLRP3 dans cette maladie (Anderson, 2021).
Dans le modèle murin de la MPTP induite par la MPTP, le croisement de souris knock-out NLRP3 ou caspase-1 entraîne une réduction de la perte de neurones DA et une amélioration de la fonction motrice (Qiao, 2017; Lee, 2019). De plus, chez les souris déficientes en NLRP3, le MPTP ne parvient pas à induire le recrutement microglial, la production d'IL-1β et l'activation de la caspase-1 dans le SN, ce qui suggère que l'activation de l'inflammasome NLRP3 dans la microglie joue un rôle crucial dans la neurodégénérescence observée dans la PD (Lee, 2019). Il est intéressant de noter qu'un agoniste sélectif du récepteur D2 de la dopamine s'est avéré inhiber l'activation de l'inflammasome NLRP3 dans le SN de souris MPTP atteintes de la maladie de Parkinson (Zhu, 2018). De plus, il a supprimé l'expression de la caspase-1 et de l'IL-1β dans des astrocytes de souris en culture primaire après l'activation de l'inflammasome NLRP3 (Zhu, 2018). Bien que certaines études soutiennent l'activation de l'inflammasome NLRP3 dans les astrocytes (Freeman, 2017), des preuves contradictoires existent, suggérant que des recherches supplémentaires sont nécessaires pour clarifier leur implication.
L'activation de l'inflammasome NLRP3 peut directement moduler la pathologie de la α-syn. La caspase-1 peut directement cliver la α-syn (Wang, 2016), et le blocage de l'activation de l'inflammasome NLRP3 avec le petit inhibiteur moléculaire MCC950 réduit l'agrégation de la α-syn, la dégénérescence dopaminergique, la neuroinflammation et les déficits moteurs dans les modèles murins de PFF et AAV-Syn (Gordon, 2018; Grotemeyer, 2023). Ces résultats suggèrent que le ciblage de l'inflammasome NLRP3 pourrait offrir une approche thérapeutique prometteuse pour la PD.
Sclérose latérale amyotrophique (ALS)
La ALS est une maladie neurodégénérative caractérisée par la dégénérescence progressive des motoneurones de la moelle épinière, du tronc cérébral et du cortex moteur, entraînant des symptômes tels que faiblesse musculaire, difficultés à parler et à avaler, et paralysie progressive. Les patients atteints de ALS présentent des mutations dans les gènes C9orf72, TARDBP, SOD1 et FUS, les protéines TDP-43 et SOD1 étant les plus étudiées. Ces protéines forment des agrégats anormaux, entraînant une clairance protéique altérée et un dysfonctionnement neuronal. En outre, l'inflammasome NLRP3 pourrait jouer un rôle important, car des taux élevés de NLRP3, ASC, IL-18 et caspase-1 ont été détectés dans les tissus post-mortem de patients atteints de SLA (Johann, 2015).
Dans les modèles murins de ALS SOD1G93A et TDP-43Q331K, le tissu de la moelle épinière présente une expression régulée à la hausse des gènes de la voie inflammasome NLRP3 (Deora, 2020). Chez les souris SOD1G93A, les astrocytes de la moelle épinière ont été identifiés comme le principal type de cellule exprimant les composants NLRP3 (Johann, 2015). Il a été démontré que l'inhibition de la caspase-1 dans le modèle SOD1G93A retardait l'apparition de la maladie, la détérioration neurologique et la mortalité, ce qui met encore davantage en évidence le rôle de l'activation de l'inflammasome NLRP3 dans la progression de la SLA (Zhang, 2013). Cependant, d'autres études indiquent que le traitement par MCC950 ne réduit pas l'inflammation de la moelle épinière dans ce modèle, ce qui suggère que plusieurs inflammasomes peuvent être activés dans la SLA et que l'inhibition de NLRP3 seule peut ne pas être suffisante pour bloquer l'inflammation dans cette maladie (Clement, 2023).
En conclusion, si l'activation de l'inflammasome NLRP3 a été largement étudiée dans la AD et la PD, son rôle dans la ALS reste moins bien compris. Outre NLRP3, d'autres complexes d'inflammasomes, tels que AIM2, NLRC4 et NLRP1, pourraient également contribuer à la neuropathologie dans ces maladies neurodégénératives. Davantage d'études précliniques et d'essais cliniques sont nécessaires pour élucider le rôle complexe des inflammasomes dans les maladies neurodégénératives, identifier des cibles thérapeutiques potentielles et développer des traitements efficaces.
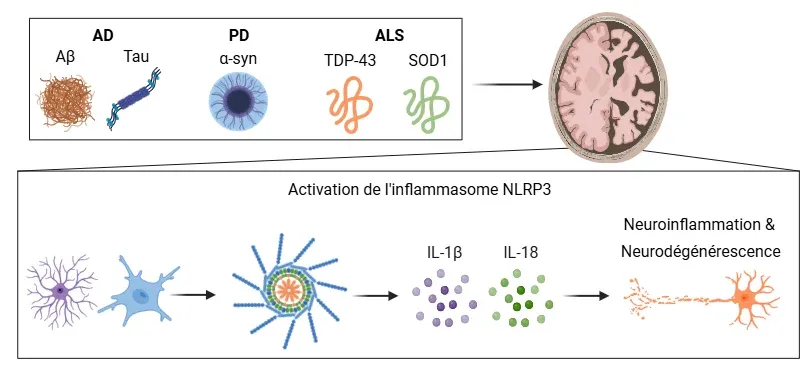
Les maladies neurodégénératives, y compris la AD, la PD et la ALS, se caractérisent généralement par l'agrégation anormale de protéines mal repliées telles que Aβ, tau, α-syn, TDP-43 et SOD1. Ces agrégats de protéines neurotoxiques déclenchent l'activation de l'inflammasome NLRP3 dans la microglie et/ou les astrocytes, conduisant à la formation du complexe inflammasome NLRP3. Il en résulte la production et la libération de cytokines pro-inflammatoires, IL-1β et IL-18, qui jouent un rôle crucial dans la médiation de la neuroinflammation et la progression de la neurodégénérescence dans ces maladies. Figure et légende adaptées de Wang et al. (Wang, 2024) sous licence Creative Commons Attribution.
Quelles stratégies sont explorées pour cibler de manière thérapeutique la voie de l'inflammasome NLRP3 dans les maladies neurodégénératives?
L'inflammasome NLRP3 joue un rôle essentiel dans les maladies neurodégénératives en favorisant la neuroinflammation, un facteur clé de la progression de la maladie. Cette découverte a conduit au développement de divers composés visant à cibler la voie de l'inflammasome NLRP3 afin de réduire la neuroinflammation et ses effets néfastes.
L'un des inhibiteurs de NLRP3 les plus connus et les plus étudiés est le MCC950 (également connu sous le nom de CRID3). Le MCC950 inhibe spécifiquement l'activation de l'inflammasome NLRP3, empêchant la libération de cytokines pro-inflammatoires, comme l'IL-1β, sans affecter les autres complexes inflammasomes. Il s'est révélé prometteur dans les études précliniques pour sa capacité à soulager les symptômes dans des modèles murins de diverses maladies neurodégénératives (Blevins, 2022). Outre le MCC950, d'autres inhibiteurs du NLRP3, dont le glyburide et l'OLT1177, sont étudiés pour leur efficacité thérapeutique. D'autres inhibiteurs de l'inflammasome, tels que le BAY 11-7082 et le parthénolide, ciblent plusieurs complexes de l'inflammasome, mais avec moins de spécificité pour le NLRP3.
L'inhibition de composants spécifiques de la voie de signalisation canonique de l'inflammasome NLRP3 est une autre approche. Les VX-740 et VX-765, inhibiteurs sélectifs de la caspase-1, bloquent la libération d'IL-1β et d'IL-18, réduisant ainsi l'inflammation. Des études précliniques montrent que ces inhibiteurs peuvent améliorer les fonctions cognitives chez des modèles murins de la MA (Wang, 2024). De même, l'inhibiteur de l'ASC IC100 a démontré des effets anti-inflammatoires dans le modèle expérimental d'encéphalomyélite auto-immune (EAE) (Wang, 2024). Le ciblage de la GSDMD est une autre stratégie prometteuse. Le disulfirame, un inhibiteur de la formation de pores GSDMD, s'est révélé efficace pour réduire l'inflammation dans les modèles cellulaires de la PD, et il a été démontré que le nécrosulfonamide, un autre inhibiteur de GSDM, réduit la neuroinflammation et protège les neurones dopaminergiques dans le modèle de PD induite par le MPTP (Wang, 2024).
Malgré des résultats précliniques prometteurs, les essais cliniques portant sur les inhibiteurs de NLRP3 pour le traitement des maladies neurodégénératives restent limités. Une étude notable est l'essai de phase 2 sur l'Usnoflast (ZYIL1), une petite molécule inhibitrice de NLRP3 testée chez des patients atteints de SLA (NCT05981040). Cet essai a fait suite à une étude de phase 1 réussie montrant une inhibition significative de l'IL-1β et de l'IL-18, soulignant le potentiel de l'inhibition de NLRP3 comme stratégie de traitement des maladies neurodégénératives (Parmar, 2023).
L'un des principaux défis du développement de thérapies ciblant le NLRP3 pour les maladies du SNC est de traverser la BHE, ce qui constitue un obstacle important. En outre, le blocage de la signalisation de l'IL-1β peut augmenter la sensibilité aux infections, ce qui nécessite un équilibre entre l'efficacité thérapeutique et la sécurité. Ces défis soulignent la nécessité de disposer d'inhibiteurs de petites molécules du NLRP3 pour surmonter les limites pharmacocinétiques et de sélectivité (Blevins, 2022).
En résumé, bien que le ciblage de l'inflammasome NLRP3 soit prometteur pour le traitement des maladies neurodégénératives, il nécessite un examen attentif de la spécificité, de la pénétration de la BHE et des effets indésirables potentiels. Les recherches et les essais cliniques en cours seront essentiels pour déterminer la viabilité thérapeutique de ces stratégies.
Notre équipe se fera un plaisir de répondre à vos questions sur l'inflammasome NLRP3 et les maladies neurodégénératives ou de vous fournir des informations spécifiques sur les modèles de la maladie d'Alzheimer, de la SLA et de la maladie de Parkinson que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur l'inflammasome NLRP3 et les maladies neurodégénératives, ainsi que sur les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de maladies neurodégénératives.
Qu'est-ce qu'un inflammasome?
Présentation générale des inflammasomes, notamment leurs mécanismes d'action, leur rôle dans les maladies et leur ciblage pour le développement de médicaments.
Qu'est-ce que le NLRP3?
Présentation générale du NLRP3 et des déclencheurs de l'activation de l'inflammasome NLRP3, des associations avec des maladies et des stratégies thérapeutiques ciblées.
Interleukine-1 bêta (IL-1β) et maladies neurodégénératives
Le rôle de l'IL-1bêta dans les maladies neurodégénératives, notamment la maladie d'Alzheimer (MA), la maladie de Parkinson (MP) et la sclérose latérale amyotrophique (SLA).
Qu'est-ce que l'IL-1β?
Présentation générale de l'IL-1β, de son rôle pro-inflammatoire dans les maladies systémiques et neurologiques, et des stratégies thérapeutiques impliquant l'antagonisme de l'IL-1β.
Dysfonctionnement lysosomal dans les microglies et les astrocytes
Un aperçu du dysfonctionnement lysosomal dans la microglie et les astrocytes, et de son rôle dans les maladies neurodégénératives.