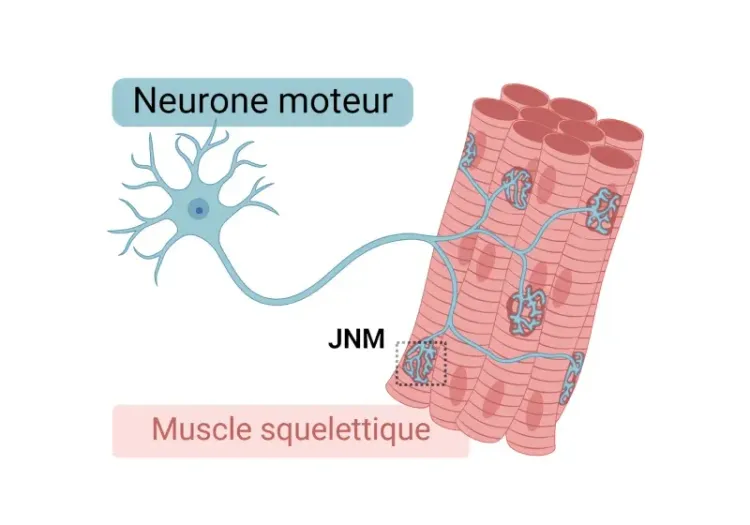
Qu'est-ce que le modèle de souris TDP-43 ΔNLS?
Le modèle TDP-43 ΔNLS, également connu sous le nom de deltaNLS, delta NLS, hTDP-43ΔNLS, hTDP-43DeltaNLS, NEFH-hTDP-43ΔNLS, dNLS, TDP43 NLS, rNLS, and rNLS8, est une souris transgénique rapportée à l'origine par Walker et ses collègues en 2015. La caractéristique clé et unique de ce modèle est que la protéine TDP-43 humaine exprimée possède un signal de localisation nucléaire (NLS) défectueux qui empêche la translocation vers le noyau (où elle devrait normalement se localiser et fonctionner). L'accumulation qui en résulte dans le cytoplasme neuronal conduit à la formation d'agrégats, notamment d'agrégats de TDP-43 phosphorylée, semblables à ceux observés chez les patients atteints de SLA.
Dans ce modèle, l'expression de hTDP-43ΔNLS est contrôlée par le promoteur du neurofilament lourd (NEFH), ce qui la limite aux neurones. Dans un modèle antérieur, rapporté par Igaz et ses collègues, l'expression était contrôlée par le promoteur Camk2a, ce qui a conduit à une accumulation de TDP-43 cytoplasmique dans le cerveau, mais avec des agrégats de TDP-43 pathologiques minimes et l'absence d'un phénotype semblable à celui de la SLA. L'expression est « régulable » (d'où le terme « rNLS ») par l'analogue de la tétracycline, la doxycycline (Dox). La double lignée transgénique rNLS8, avec expression de hTDP-43ΔNLS à la fois dans le cerveau et la moelle épinière, est générée par la reproduction des lignées transgéniques individuelles : NEFH-tTA (ligne 8 ; promoteur NEFH dirigeant l'expression de la protéine transactivatrice [tTA] contrôlée par la tétracycline) et tetO-hTDP-43ΔNLS (ligne 4 ; promoteur opérateur de la tétracycline [tetO] dirigeant l'expression de hTDP-43ΔNLS). Les souris doublement transgéniques sont soumises à un régime Dox pendant la période de reproduction et les premières semaines de leur vie (généralement entre 5 et 12 semaines) afin de supprimer l'expression de hTDP-43ΔNLS. L'induction de la maladie est initiée par le passage à une alimentation standard (le modèle « Off Dox »). Il convient de noter que les souris maintenues sous régime Dox (souris « On Dox ») peuvent servir de groupe de contrôle car elles ne présentent pas de signes de maladie.
Une caractéristique clé de ce modèle est la capacité d'obtenir une récupération pathologique et fonctionnelle en réinstaurant le régime Dox. L'arrêt et la réversibilité de la progression de la maladie dans ce modèle démontrent que la modification de la maladie est possible par la médiation de l'expression de TDP-43 et des agrégats pathologiques, ce qui en fait un modèle attractif pour le développement de médicaments contre la SLA.
Le modèle ΔNLS original progresse rapidement, avec une perte de poids et des symptômes moteurs apparaissant typiquement dans un délai d'environ une semaine après le retrait du Dox, jusqu'à la mort dans un délai de plusieurs semaines. Comme alternative mieux adaptée à la plupart des études d'efficacité thérapeutique, notre équipe a développé une version à progression plus lente en utilisant un protocole Dox alternatif. Dans notre modèle « Low Dox », un phénotype similaire est produit, mais il évolue sur une période plus longue, les souris survivant jusqu'à au moins 3 mois après l'induction du modèle.
Quelles sont les principales caractéristiques de la SLA humaine qui sont présentes chez les souris TDP-43 ΔNLS?
La SLA est une maladie neurodégénérative mortelle qui affecte de nombreux systèmes chez l'homme, notamment le système nerveux central (SNC), le système nerveux périphérique (SNP), le système nerveux autonome (SNA), les muscles et le système immunitaire. Comme le résume l'infographie ci-dessous, il a été démontré que le modèle ΔNLS récapitule un certain nombre de ces caractéristiques, d'autres (par exemple le SNA et le système immunitaire) restant à explorer.
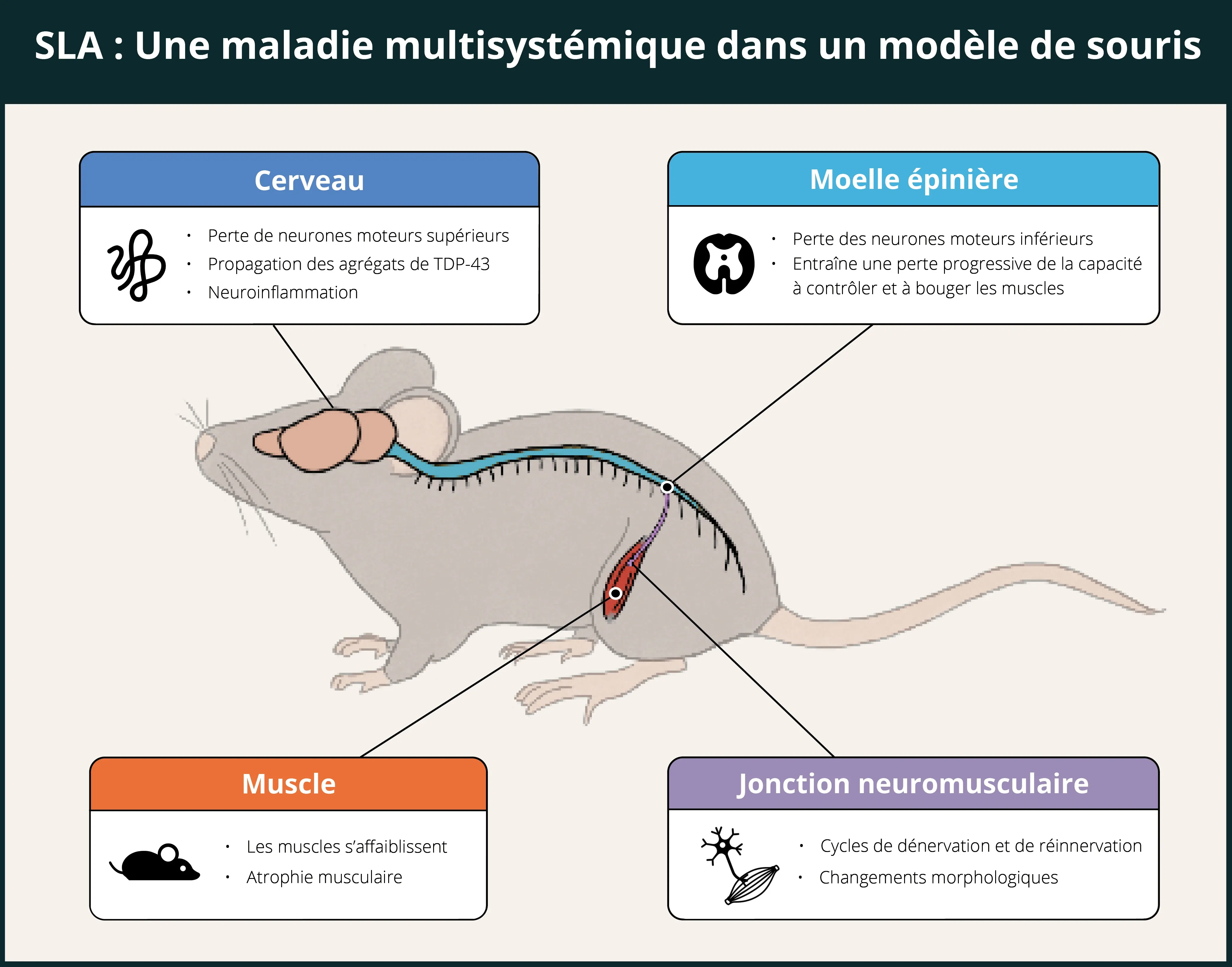
Les souris TDP-43 ΔNLS présentent une atteinte multisystémique, notamment du cerveau, de la moelle épinière, des jonctions neuromusculaires et des muscles, ce qui en fait un bon modèle pour l'évaluation d'agents thérapeutiques potentiels pour la SLA.
Cliquez pour copier le lien
Dans le cerveau, les souris ΔNLS présentent des agrégats cytoplasmiques de TDP-43 (y compris du TDP-43 phosphorylé), une neurodégénérescence, une altération de la fonction glymphatique, une neuroinflammation (microgliose et astrogliose) et une signature protéomique en corrélation avec celle du tissu cérébral humain post-mortem de patients atteints de protéinopathies TDP-43.
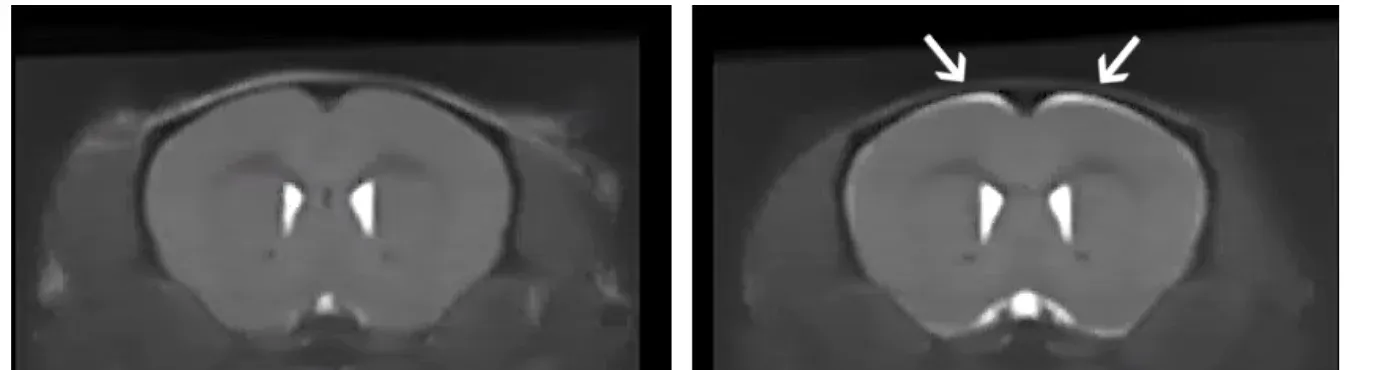
IRM anatomique de souris témoins (à gauche) et de souris ΔNLS ayant reçu du Dox pendant 3 semaines (à droite). Notez le signal lumineux dans des régions spécifiques montrant l'atrophie du cerveau chez les souris ΔNLS.
En termes de neuroinflammation, la microglie joue un rôle intriguant dans ce modèle. Spiller et al. ont constaté qu'après avoir stoppé l'expression de TDP-43 en remettant les souris sous Dox, la microglie proliférait transitoirement et modifiait sa morphologie et son expression génétique, facilitant ainsi l'élimination du cytoplasme de TDP-43. Lorsque la microglie a été décimée, la récupération a été atténuée. Hunter et al. ont effectué une analyse transcriptomique pendant les phases de progression et de récupération et ont constaté que les gènes exprimés de manière différentielle étaient associés à la chimiotaxie, à la phagocytose, à l'inflammation et à la production de facteurs neuroprotecteurs. Swanson et al. ont constaté que la microglie est phagocytaire aux premiers stades de la maladie et qu'elle passe à un état dysfonctionnel aux stades ultérieurs, et que ces états fonctionnels sont pilotés par l'agrégation de TDP-43 phosphorylée.
Dans la moelle épinière, Spiller et al. ont constaté que les motoneurones lents sont résistants alors que les motoneurones rapides fatigables sont perdus, et que le dépérissement axonal se produit d'abord dans les fibres musculaires à contraction rapide, alors que les fibres à contraction lente restent innervées. Ces résultats dans le modèle murin reflètent les schémas sélectifs de dégénérescence des motoneurones dans la maladie humaine.
Walker et al. ont fait état d'une dénervation précoce et progressive significative de la jonction neuromusculaire (NMJ). Hur et al. ont démontré que l'identité des motoneurones est responsable de la sensibilité des jonctions neuromusculaires à la pathologie TDP-43, et que les motoneurones lents peuvent conduire à la récupération des systèmes moteurs en fonction de leur résilience à la neurodégénérescence associée à la TDP-43. Plusieurs articles, dont celui de Spiller et al., ont fait état d'une réduction de l'amplitude du potentiel d'action musculaire composé (CMAP).
En termes d'atteinte musculaire, Walker et ses collègues ont constaté une faiblesse musculaire, une atrophie des fibres groupées et des noyaux centralisés dans les fibres musculaires, ainsi qu'une perte de masse musculaire dans les muscles gastrocnémiens et tibialis anterior. Tsitkanou et al. ont trouvé une hTDP-43 accumulation cytoplasmique de TDP-43 et d'oligo A11 β-amyloïde dans les fibres musculaires dénervées des muscles tibialis anterior, quadriceps et diaphragme. Ils ont également constaté une atrophie des muscles tibialis anterior, quadriceps et gastrocnémiens, une augmentation des marqueurs du stress myogénique et de la jonction neuromusculaire (NMJ), une altération de la fonction motrice et de la production de force musculaire, ainsi qu'une dysrégulation de plusieurs protéines liées aux complexes mitochondriaux.
Notre groupe a utilisé la tomodensitométrie (CT) non invasive pour démontrer une atrophie musculaire sélective, qui affecte le plus significativement le muscle gastrocnémien des membres postérieurs, dans notre modèle de souris «Low Dox».
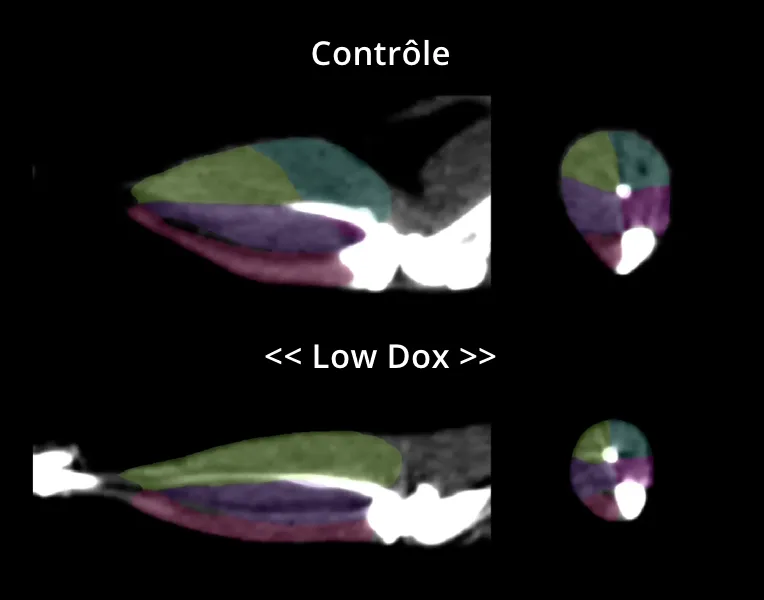
Image CT avec segmentation des muscles des membres postérieurs de souris témoins (On Dox) et « Low Dox » TDP-43 ΔNLS ; gastrocnémien médial = bleu ; gastrocnémien latéral = jaune ; tibialis postérieur = violet ; tibialis antérieur= rose ; soléaire = magenta.
Rendu volumique 3D des muscles gastrocnémiens médial (bleu) et latéral (jaune) de souris témoins et de souris TDP-43 ΔNLS « Low Dox ».
Quelles mesures ont été utilisées pour évaluer l'efficacité thérapeutique dans le modèle de souris TDP-43 ΔNLS ALS ?
Plusieurs groupes ont montré une modification de la maladie par une intervention thérapeutique dans ce modèle de souris. Young et al. ont démontré la capacité d'une petite molécule inhibitrice de PIKfyve, AIT-101 (INN : apilimod, alias LAM-002A) de diminuer la perte de poids corporel, de réduire les déficits moteurs (y compris la préhension des membres postérieurs, la paralysie des membres postérieurs et l'agilité du gril) et d'accompagner la diminution des niveaux de neurofilament léger (NfL) dans le plasma et le LCR, des agrégats de TDP-43 (par IHC) et de la neuroinflammation (par GFAP IHC) dans la version Low Dox du modèle rNLS8 de Biospective.
Stomakhina et al. ont constaté une réduction des niveaux de lumière de neurofilament (NfL) dans le plasma et le LCR, ainsi qu'une réduction de l'activité de la sphingomyélinase acide (ASM) dans le cortex caudal chez les souris rNLS8 traitées avec le VRG50304 sur une période de 28 jours. Droppelmann et al. ont constaté que les injections intracérébroventriculaires d'AAV9/NF242 (fragment N-terminal du facteur d'échange rho guanine nucléotide [RGNEF]) dans le modèle rNLS8 amélioraient la durée de vie et le phénotype moteur (agrippement des membres postérieurs, champ libre, démarche [CatWalk]), et diminuaient les marqueurs de neuroinflammation (GFAP et Iba-1).
Notre équipe se fera un plaisir de répondre à vos questions sur le modèle de souris TDP-43 ΔNLS ALS ou de vous fournir des informations spécifiques sur les modèles que nous utilisons pour les études d'efficacité thérapeutique.
Découvrez nos modèles ALS
Contenu connexe
Informations actualisées sur la sclérose latérale amyotrophique et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de la SLA.
Morphologie de la jonction neuromusculaire (JNM) dans les modèles de SLA
Aperçu de la jonction neuromusculaire (JNM), de son rôle dans la sclérose latérale amyotrophique (SLA) et des outils et méthodes utilisés pour étudier les changements morphologiques dans les JNM.
Modèles de souris SLA et neurones moteurs spinaux
Aperçu de l'implication des motoneurones spinaux dans la progression de la maladie dans les modèles murins de sclérose latérale amyotrophique (SLA).
Modèles de souris SLA pour le développement de médicaments
Un guide pour l'utilisation la plus efficace possible des modèles animaux de recherche sur la sclérose latérale amyotrophique (SLA) pour les essais précliniques de produits thérapeutiques.
Morphologie de la microglie dans la SLA, la maladie d'Alzheimer et la maladie de Parkinson
Une vue d'ensemble de l'analyse morphologique des microglies et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.
Analyse de l'atrophie cérébrale dans les modèles murins de neurodégénérescence
Mesures quantitatives automatisées de l'atrophie cérébrale in vivo par IRM (volumes cérébraux régionaux et épaisseur corticale) dans des modèles murins de SLA et de maladie de Parkinson.