TDP-43 ΔNLS 형질전환 마우스 모델이란 무엇인가요?
TDP-43 ΔNLS 모델은 deltaNLS, delta NLS, hTDP-43ΔNLS, hTDP-43DeltaNLS, NEFH-hTDP-43ΔNLS, dNLS, TDP43 NLS, rNLS, rNLS8로도 알려져 있으며, 2015년 워커(Walker)와 동료 연구자들이 처음 보고한 형질전환 마우스입니다. 이 모델의 핵심이자 독특한 특징은 발현된 인간 TDP-43 단백질이 핵으로 이동하는 것을 막는 결함 있는 핵 국소화 신호(NLS)를 가지고 있다는 것입니다(정상적으로 국소화되고 기능하는 곳). 그 결과, 신경 세포질에 축적되어 ALS 환자에서 관찰되는 것과 유사한 인산화 TDP-43 응집체를 포함한 응집체의 형성을 초래합니다.
이 모델에서 hTDP-43ΔNLS의 발현은 신경원중합체중(NEFH) 프로모터에 의해 조절되어 뉴런으로 제한됩니다. Igaz와 동료들이 보고한 이전 모델에서는 발현이 Camk2a 프로모터에 의해 조절되어 뇌에 세포질 TDP-43이 축적되었지만, 병리학적 TDP-43 응집체는 최소한으로 유지되었고 ALS와 유사한 표현형은 나타나지 않았습니다. 이 표현은 테트라사이클린 유사체인 독시사이클린(Dox)에 의해 조절 가능(따라서 "rNLS")하게 됩니다. 뇌와 척수 모두에서 hTDP-43ΔNLS가 발현되는 rNLS8 이중 형질전환 계통은 개별 형질전환 계통을 교배하여 생성됩니다. NEFH-tTA(8번째 줄; NEFH 프로모터가 테트라사이클린-조절 트랜스액티베이터 단백질[tTA] 발현을 유도)와 tetO-hTDP-43ΔNLS(4번째 줄; 테트라사이클린 오퍼레이터 프로모터[tetO]가 hTDP-43ΔNLS의 발현을 유도). 이중 형질전환 생쥐는 번식 기간과 생후 첫 몇 주(일반적으로 생후 5-12주) 동안 Dox 식이요법을 통해 hTDP-43ΔNLS의 발현을 억제합니다. 질병 유도는 표준 사료로 전환함으로써 시작됩니다("Off Dox" 모델). Dox 사료를 먹은 쥐("On Dox" 쥐)는 질병의 징후가 나타나지 않으므로 대조군으로 사용할 수 있습니다.
이 모델의 핵심 특징은 독스 식이요법을 통해 병리학적, 기능적 회복을 얻을 수 있다는 점입니다. 이 모델에서 질병 진행의 중단과 역전 가능성은 TDP-43 발현과 병리학적 응집체의 중재를 통해 질병 수정이 가능하다는 것을 보여 주며, 따라서 이 모델은 ALS 약물 개발에 매력적인 모델입니다.
원래의 ΔNLS 모델은 체중 감소와 운동 기능의 증상이 독소 제거 후 약 1주일 이내에 나타나고, 몇 주 내에 사망에 이르는 등 빠르게 진행되고 있습니다. 대부분의 치료 효과 연구에 더 적합한 대안으로, 저희 팀은 대체 독소 프로토콜을 사용하여 진행 속도가 느린 버전을 개발했습니다. "Low Dox" 모델에서는 유사한 표현형이 생성되지만, 모델 유도 후 최소 3개월 동안 생존하는 쥐를 대상으로 더 긴 기간에 걸쳐 진화합니다.
TDP-43 ΔNLS 마우스에 존재하는 인간 ALS의 주요 특징은 무엇입니까?
ALS는 중추신경계(CNS), 말초신경계(PNS), 자율신경계(ANS), 근육, 면역계를 포함한 인간의 여러 시스템에 영향을 미치는 치명적인 신경 퇴행성 질환입니다. 아래 인포그래픽에 요약되어 있듯이, ΔNLS 모델은 이러한 특징 중 다수를 재현하는 것으로 입증되었으며, 다른특징(예: ANS 및 면역계)은 아직 연구 중입니다.
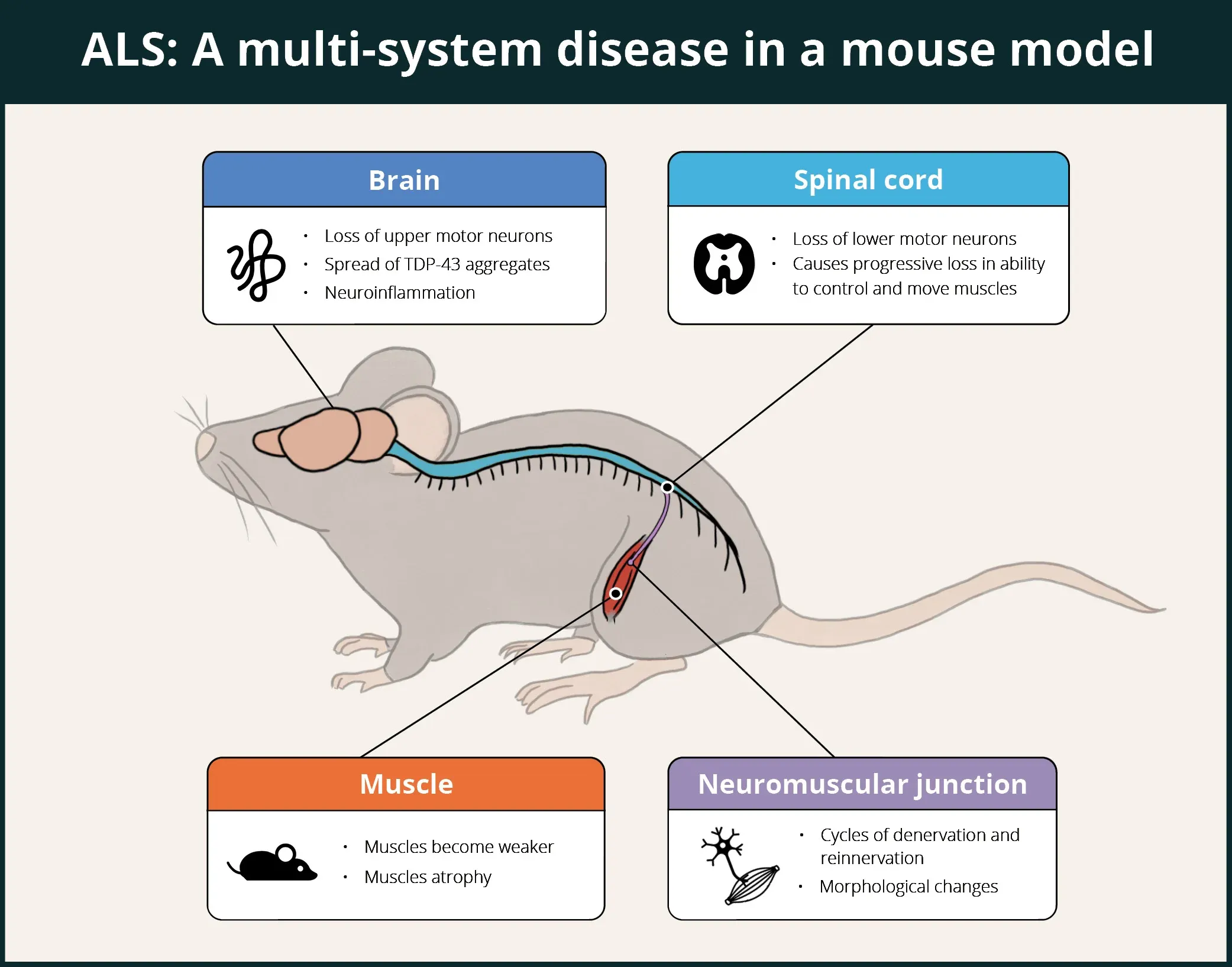
TDP-43 ΔNLS 마우스는 뇌, 척수, 신경근 접합부(NMJ), 근육을 포함한 다중 시스템의 관여를 보여줌으로써 ALS에 대한 추정 치료제의 평가를 위한 좋은 모델이 됩니다.
클릭하여 링크 복사
NLS 마우스의 뇌에서는 세포질 TDP-43 응집체(인산화 TDP-43 포함), 신경 퇴행, 손상된 글리머 기능, 신경 염증(미세아교세포증 및 성상교세포증), 그리고 TDP-43 단백질 병증 환자의 사후 인간 뇌 조직과 관련된 단백질체 서명이 관찰됩니다.
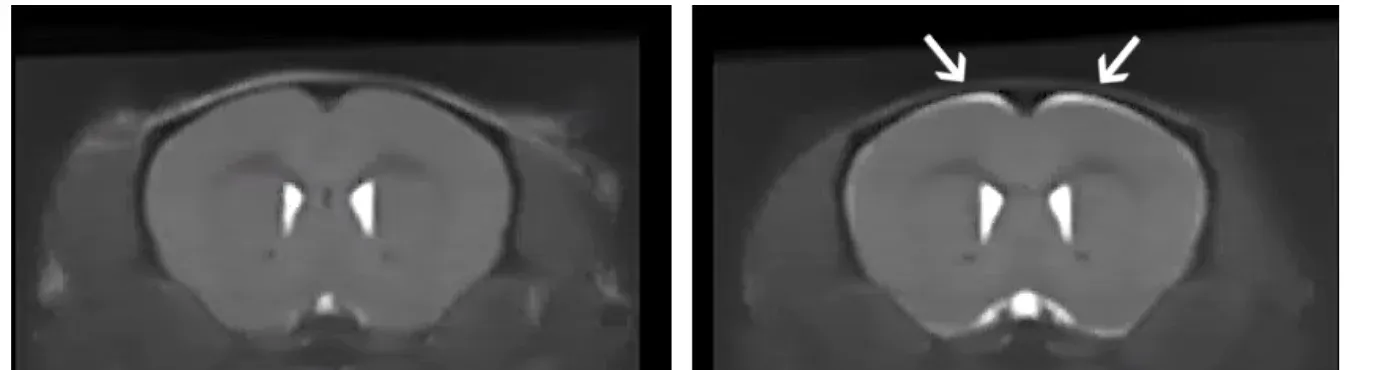
대조군(왼쪽)과 3주 동안 독소(Dox)를 투여하지 않은 ΔNLS 마우스의 해부학적 MRI(오른쪽). ΔNLS 마우스의 특정 부위에서 뇌 위축을 나타내는 밝은 신호를 확인하십시오.
신경염증의 관점에서, 미세아교세포는 이 모델에서 흥미로운 역할을 합니다. Spiller 등은 마우스를 다시 독소에 노출시켜 TDP-43의 발현을 중단시킨 후, 미세아교세포가 일시적으로 증식하고 형태와 유전자 발현이 변화하여 세포질 내 TDP-43의 제거가 촉진된다는 사실을 발견했습니다. 미세아교세포가 고갈되면 회복이 약화됩니다. Hunter 등은 진행 단계와 회복 단계에서 전사체 분석을 수행했고, 발현 차이가 있는 유전자가 화학주성, 식세포 작용, 염증, 신경보호 인자 생산과 관련이 있다는 것을 발견했습니다. Swanson 등은 미세아교세포가 질병의 초기 단계에서 식세포 작용을 하고, 후기 단계에서 기능 장애 상태로 전환하며, 이러한 기능 상태가 인산화 TDP-43 응집에 의해 주도된다는 것을 발견했습니다.
척수에서, 스필러( ) 등은 느린 운동 뉴런은 회복력이 있는 반면, 빠른 운동 뉴런은 소모되고, 축삭의 쇠퇴는 빠른 트위치 근육 섬유에서 먼저 발생하고, 느린 트위치 섬유는 신경 분포가 유지된다는 것을 발견했습니다. 이 쥐 모델의 발견은 인간 질병에서 운동 뉴런 변성의 선택적 패턴을 반영합니다.
Walker 외.는 신경근 접합부(NMJ)의 초기 및 점진적 탈수초화가 유의미하게 나타났다고 보고했습니다. Hur 외. 는 운동 신경 세포의 정체성이 TDP-43 병리학에 대한 NMJ의 민감성에 영향을 미치고, 느린 운동 신경 세포가 TDP-43 관련 신경 퇴화에 대한 회복력이라는 기능으로 운동 시스템의 회복을 촉진할 수 있다는 것을 입증했습니다. Spiller 외.를 포함한 여러 논문에서 복합 근육 활동 전위(CMAP) 진폭의 감소가 보고되었습니다.
근육 관련 측면에서, 근육 약화, 섬유 다발성 위축, 그리고 근육 섬유에 집중된 핵이 발견되었으며, 위와 비골근의 근육량 감소가 Walker와 동료들에 의해 보고되었습니다. Tsitkanou 등은 경골 전방, 대퇴사두근, 횡격막 근육의 신경이 제거된 근육 섬유에서 hTDP-43의 세포질 축적과 TDP-43 및 올리고 A11 베타-아밀로이드를 발견했습니다. 또한, 전경골근, 대퇴사두근, 비복근의 위축, 근성 및 신경근 접합부(NMJ) 스트레스의 지표의 상향 조절, 운동 기능 장애 및 근육 힘 생성 장애, 미토콘드리아 복합체와 관련된 여러 단백질의 조절 장애를 발견했습니다.
우리 그룹은 비침습적 컴퓨터 단층 촬영(CT) 이미지를 사용하여 "저독소" 마우스 모델에서 뒷다리 비복근에 가장 큰 영향을 미치는 선택적 근육 위축을 입증했습니다.
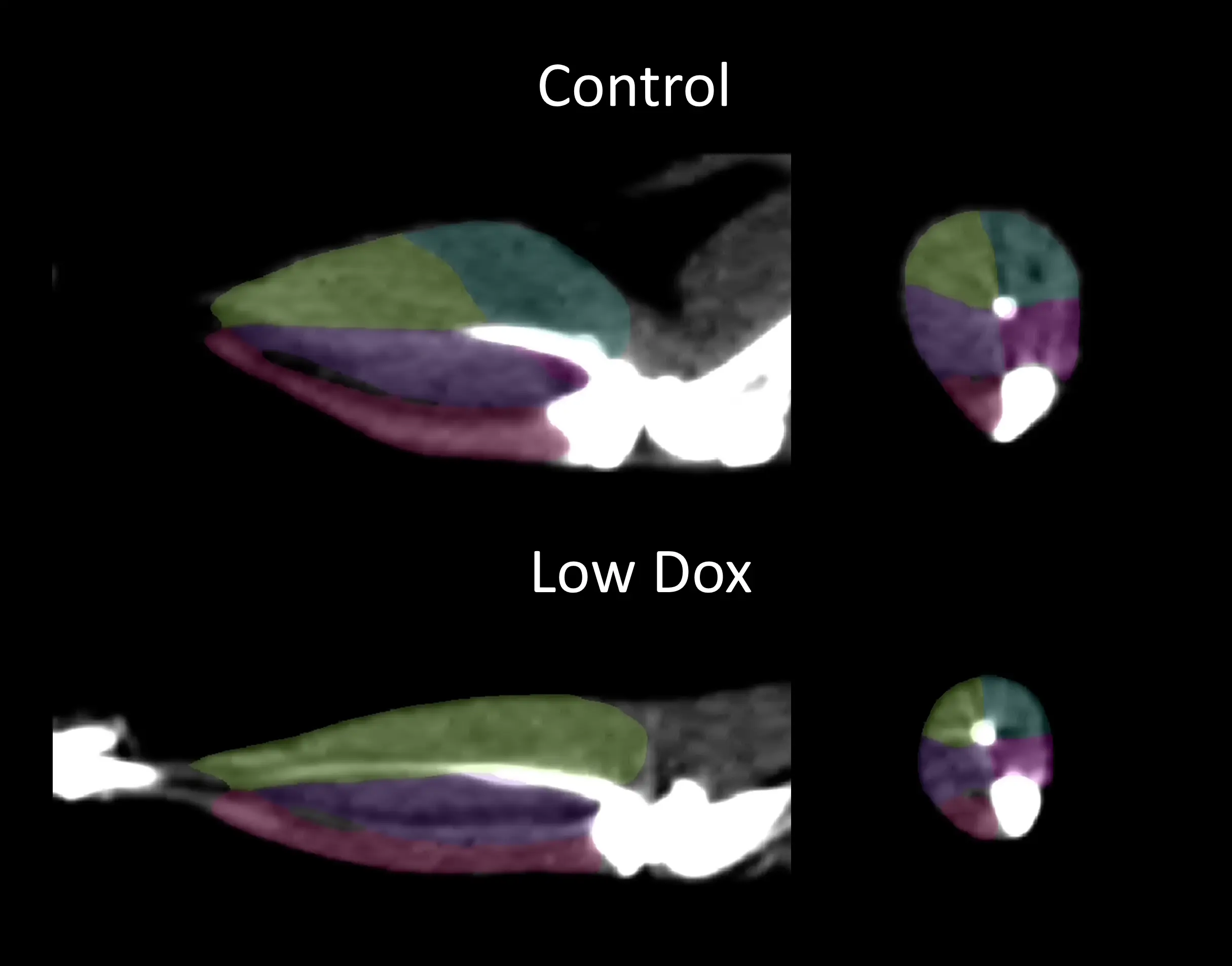
후방 근육의 분할이 가능한 CT 이미지(Control(On Dox) 및 "Low Dox" TDP-43 ΔNLS 마우스; 내측 비복근 = 파란색; 외측 비복근 = 노란색; 후방 경골근 = 보라색; 전방 경골근 = 분홍색; 가자미근 = 자홍색).
대조군과 "저독소" TDP-43 ΔNLS 마우스의 내측(파란색) 및 외측(노란색) 비복근의 3D 입체 렌더링.
TDP-43 ΔNLS ALS 마우스 모델에서 치료 효과를 평가하기 위해 어떤 방법을 사용했습니까?
여러 그룹이 이 마우스 모델에서 치료적 개입을 통한 질병 변형 효과를 보여주었습니다. Young 등은 저분자 PIKfyve 억제제인 AIT-101(INN: 아필리모드, 일명 LAM-002A)의 능력을 입증했습니다 체중 감소를 줄이고, 운동 장애(뒷다리 움츠림, 뒷다리 마비, 그릴 민첩성 포함)를 줄이며, 혈장 및 CSF 신경필라멘트 라이트(NfL) 수치, TDP-43 응집체(IHC에 의해), 신경염증(GFAP IHC에 의해)의 감소와 함께 Biospective의 Low Dox 버전 rNLS8 모델의 체중 감소를 줄입니다.
Stomakhina 등은 28일 동안 VRG50304로 치료한 rNLS8 마우스의 꼬리쪽 피질에서 혈장 및 뇌척수액 내 신경필라멘트 라이트(NfL) 수치가 감소하고, 산성 스핑고미엘리나제(ASM) 활성이 감소하는 것을 발견했습니다. Droppelmann 등은 rNLS8 모델에서 AAV9/NF242 N-말단 단편(rho guanine nucleotide exchange factor [RGNEF])의 뇌실내 주입이 수명과 운동 표현형(뒷다리 움츠림, 열린 공간, 보행[CatWalk])을 개선하고, 신경염증 지표(GFAP와 Iba-1)를 감소시킨다는 사실을 발견했습니다.
저희 팀은 TDP-43 ΔNLS ALS 마우스 모델에 대한 질문에 기꺼이 답변해 드리고, 치료 효능 연구에 사용하는 모델에 대한 구체적인 정보를 제공해 드릴 것입니다.
ALS 모델에 대해 자세히 알아보기
관련 콘텐츠
근위축성 측삭 경화증에 대한 최신 정보와 ALS 동물 모델에서 치료제 평가와 관련된 모범 사례.
신경근 접합부(NMJ) 형태학 및 ALS 모델
신경근 접합부(NMJ)에 대한 통찰, 근위축성 측삭 경화증(ALS)에서의 그 역할, 그리고 NMJ의 형태학적 변화를 연구하는 데 사용되는 도구와 방법.
루게릭병 마우스 모델과 척수 운동 뉴런
근위축성 측삭 경화증(ALS)의 마우스 모델에서 척수 운동 신경 세포가 질병 진행에 관여하는 것에 대한 개요.
ALS 마우스 모델의 신약 개발
근위축성 측삭 경화증(ALS) 치료제의 전임상 시험을 위한 연구용 동물 모델(마우스 및 랫드 모델)의 가장 효과적인 사용에 대한 안내서.
ALS, 알츠하이머병, 파킨슨병의 미세아교세포 형태학
미세아교세포 형태학적 분석의 개요와 신경퇴행성 질환 연구 및 신약 개발에 대한 응용.