Arduíno, D.M., Esteves, A.R., Cardoso, S.M. Mitochondrial fusion/fission, transport and autophagy in Parkinson’s disease: When mitochondria get nasty. Parkinson’s Dis., 2011: 767230, 2011; doi: 10.4061/2011/767230
Ashrafi, G., Schwarz, T. L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death Differ., 20: 31-42, 2013; doi: 10.1038/cdd.2012.81
Bender, A., Krishnan, K.J., Morris, C.M., Taylor, G.A., Reeve, A.K., Perry, R.H., Jaros, E., Hersheson, J.S., Betts, J., Klopstock, T., Taylor, R.W., Turnbull, D.M. High levels of mitochondrial DNA deletions in substantia nigra neurons in aging and Parkinson disease. Nat. Genet., 38: 515–517, 2006; doi: 10.1038/ng1769
Buhlman, L., Damiano, M., Bertolin, G., Ferrando-Miguel, R., Lombès, A., Brice, A., Corti, O. Functional interplay between Parkin and Drp1 in mitochondrial fission and clearance. Biochim. Biophys. Acta Mol. Cell Res., 1843: 2012–2026, 2014; doi: 10.1016/j.bbamcr.2014.05.012
Chan, N. C., Salazar, A. M., Pham, A. H., Sweredoski, M. J., Kolawa, N. J., Graham, R. L. J., Hess, S., Chan, D. C. Broad activation of the ubiquitin-proteasome system by Parkin is critical for mitophagy. Hum. Mol. Genet., 20: 1726-1737, 2011; doi: 10.1093/hmg/ddr048
Chen, C., Chen, Y., Liu, T., Song, D., Ma, D., Cheng, O. Dexmedetomidine can enhance PINK1/Parkin-mediated mitophagy in MPTP-induced PD mice model by activating AMPK. Oxid. Med. Cell. Longev., 2022: 7511393, 2022; doi: 10.1155/2022/7511393
Gandhi, S., Muqit, M.M.K., Stanyer, L., Healy, D.G., Abou-Sleiman, P.M., Hargreaves, I., Heales, S., Ganguly, M., Parsons, L., Lees, A.J., Latchman, D.S., Holton, J.L., Wood, N.W., Revesz, T. PINK1 protein in normal human brain and Parkinson’s disease. Brain, 129: 1720–1731, 2006; doi: 10.1093/brain/awl114
Ge, P., Dawson, V. L., Dawson, T. M. PINK1 and Parkin mitochondrial quality control: a source of regional vulnerability in Parkinson’s disease. Mol. Neurodegener., 15: 20, 2020; doi: 10.1186/s13024-020-00367-7
Giannoccaro, M.P., La Morgia, C., Rizzo, G., Carelli, V. Mitochondrial DNA and primary mitochondrial dysfunction in Parkinson’s disease. Mov. Disord., 32: 346–363, 2017; doi: 10.1002/mds.26966
Goldberg, M. S., Fleming, S. M., Palacino, J. J., Cepeda, C., Lam, H. A., Bhatnagar, A., Meloni, E. G., Wu, N., Ackerson, L. C., Klapstein, G. J., Gajendiran, M., Roth, B. L., Chesselet, M.-F., Maidment, N. T., Levine, M. S., Shen, J. Parkin-deficient mice exhibit nigrostriatal deficits but not loss of dopaminergic neurons. J. Biol. Chem., 278: 43628–43635, 2003; doi: 10.1074/jbc.M308947200
Gómez-Virgilio, L., Silva-Lucero, M.-C., Flores-Morelos, D.-S., Gallardo-Nieto, J., Lopez-Toledo, G., Abarca-Fernandez, A.-M., Zacapala-Gómez, A.-E., Luna-Muñoz, J., Montiel-Sosa, F., Soto-Rojas, L. O., Pacheco-Herrero, M., Cardenas-Aguayo, M.-C. Autophagy: A key regulator of homeostasis and disease: An overview of molecular mechanisms and modulators. Cells, 11: 2262, 2022; doi: 10.3390/cells11152262
Grünewald, A., Rygiel, K.A., Hepplewhite, P.D., Morris, C.M., Picard, M., Turnbull, D.M. Mitochondrial DNA depletion in respiratory chain–deficient Parkinson disease neurons. Ann. Neurol., 79: 366–378, 2016; doi: 10.1002/ana.24571
Jin, S. M., Youle, R. J. PINK1- and Parkin-mediated mitophagy at a glance. J. Cell Sci., 125: 795-799, 2012; doi: 10.1242/jcs.093849
Jung, M., Choi, H., Mun, J. Y. The autophagy research in electron microscopy. Appl. Microsc., 49: 11, 2019; doi: 10.1186/s42649-019-0012-6
Kitada, T., Asakawa, S., Hattori, N., Matsumine, H., Yamamura, Y., Minoshima, S., Yokochi, M., Mizuno, Y., Shimizu, N. Mutations in the parkin gene cause autosomal recessive juvenile parkinsonism. Nature, 392: 605–608, 1998; doi: 10.1038/33416
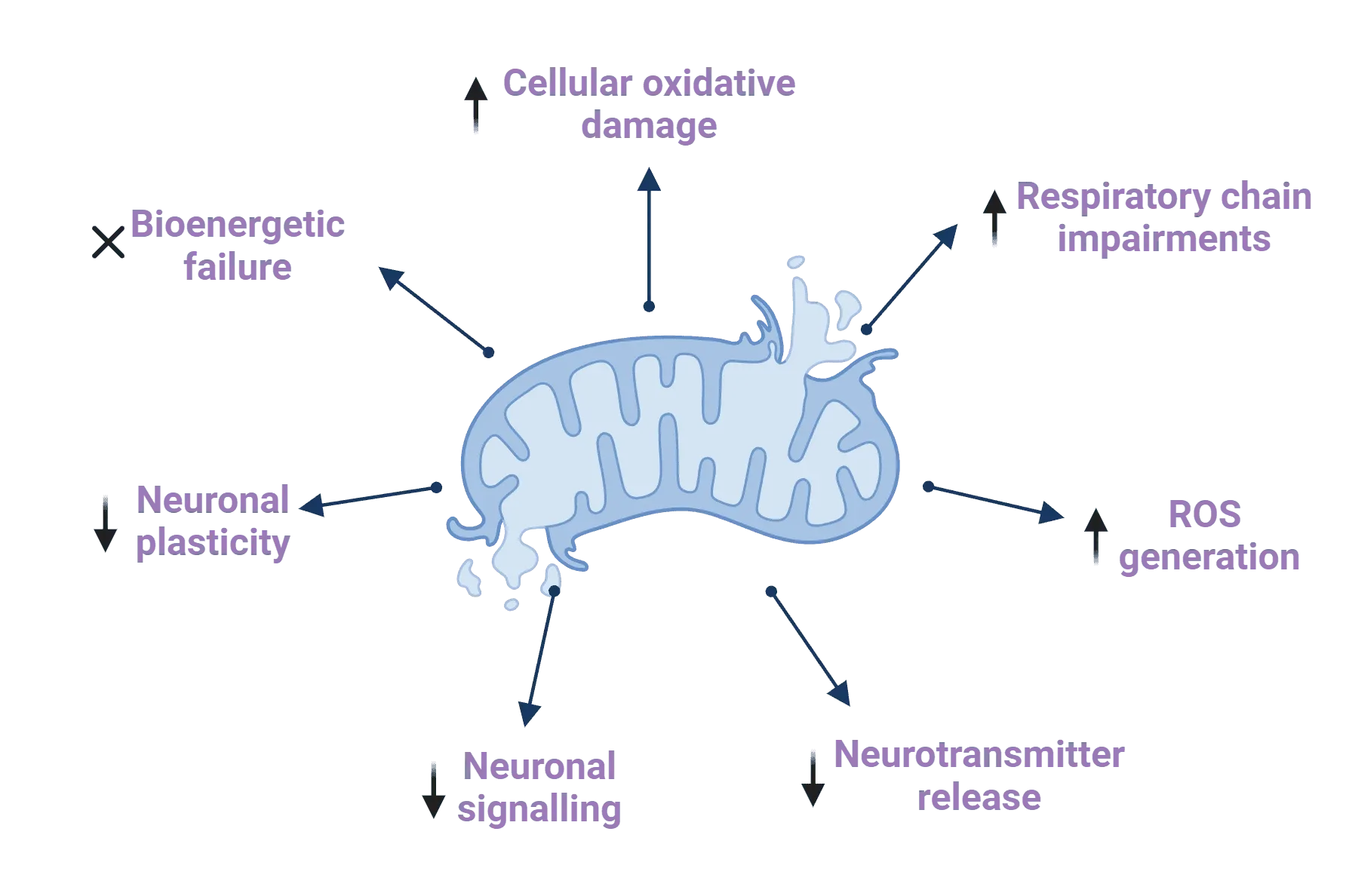
Liu, X.-L., Wang, Y.-D., Yu, X.-M., Li, D.-W., Li, G.-R. Mitochondria-mediated damage to dopaminergic neurons in Parkinson’s disease. Int. J. Mol. Med., 41: 615–623, 2018; doi: 10.3892/ijmm.2017.3255
Lonskaya, I., Hebron, M.L., Algarzae, N.K., Desforges, N., Moussa, C.E.-H. Decreased parkin solubility is associated with impairment of autophagy in the nigrostriatum of sporadic Parkinson’s disease. Neuroscience, 232: 90–105, 2013; doi: 10.1016/j.neuroscience.2012.12.018
Lücking, C.B., Dürr, A., Bonifati, V., Vaughan, J., Michele, G.D., Gasser, T., Harhangi, B.S., Meco, G., Denèfle, P., Wood, N.W., Agid, Y., Nicholl, D., Breteler, M.M.B., Oostra, B.A., Mari, M.D., Marconi, R., Filla, A., Bonnet, A.-M., Broussolle, E., Brice, A. Association between early-onset Parkinson’s disease and mutations in the parkin gene. N. Engl. J. Med., 342: 1560–1567, 2000; doi: 10.1056/NEJM200005253422103
McKinnon, C., De Snoo, M.L., Gondard, E., Neudorfer, C., Chau, H., Ngana, S.G., O’Hara, D.M., Brotchie, J.M., Koprich, J.B., Lozano, A.M., Kalia, L.V., Kalia, S.K. Early-onset impairment of the ubiquitin-proteasome system in dopaminergic neurons caused by α-synuclein. Acta Neuropathol. Commun., 8: 17, 2020; doi: 10.1186/s40478-020-0894-0
Millichap, L.E., Damiani, E., Tiano, L., Hargreaves, I.P. Targetable pathways for alleviating mitochondrial dysfunction in neurodegeneration of metabolic and non-metabolic diseases. Int. J. Mol. Sci., 22: 11444, 2021; doi: 10.3390/ijms222111444
Mizuno, Y., Ohta, S., Tanaka, M., Takamiya, S., Suzuki, K., Sato, T., Oya, H., Ozawa, T., Kagawa, Y. Deficiencies in complex I subunits of the respiratory chain in Parkinson’s disease. Biochem. Biophys. Res. Commun., 163: 1450–1455, 1989; doi: 10.1016/0006-291X(89)91141-8
Narendra, D. P., Youle, R. J. Targeting mitochondrial dysfunction: role for PINK1 and Parkin in mitochondrial quality control. Antioxid. Redox Signal., 14: 1929–1938, 2011; doi: 10.1089/ars.2010.3799
Narendra, D., Walker, J. E., Youle, R. Mitochondrial quality control mediated by PINK1 and Parkin: Links to parkinsonism. Cold Spring Harb. Perspect. Biol., 4: a011338, 2012; doi: 10.1101/cshperspect.a011338
Pickrell, A. M., Youle, R. J. The roles of PINK1, Parkin, and mitochondrial fidelity in Parkinson’s disease. Neuron, 85: 257-273, 2015; doi: 10.1016/j.neuron.2014.12.007
Rademacher, K., Doric, Z., Haddad, D., Mamaligas, A., Liao, S.-C., Creed, R.B., Kano, K., Chatterton, Z., Fu, Y., Garcia, J.H., Vance, V., Sei, Y., Kreitzer, A., Halliday, G.M., Nelson, A.B., Margolis, E.B., Nakamura, K. Chronic hyperactivation of midbrain dopamine neurons causes preferential dopamine neuron degeneration. eLife, 13, 2024; doi: 10.7554/eLife.98775.1
Samaranch, L., Lorenzo-Betancor, O., Arbelo, J.M., Ferrer, I., Lorenzo, E., Irigoyen, J., Pastor, M.A., Marrero, C., Isla, C., Herrera-Henriquez, J., Pastor, P. PINK1-linked parkinsonism is associated with Lewy body pathology. Brain, 133: 1128–1142, 2010; doi: 10.1093/brain/awq051
Srinivasan, E., Chandrasekhar, G., Chandrasekar, P., Anbarasu, K., Vickram, A.S., Karunakaran, R., Rajasekaran, R., Srikumar, P.S. Alpha-synuclein aggregation in Parkinson’s disease. Front. Med., 8, 2021; doi: 10.3389/fmed.2021.736978
Twig, G., Hyde, B., Shirihai, O. S. Mitochondrial fusion, fission and autophagy as a quality control axis: The bioenergetic view. Biochim. Biophys. Acta Bioenergetics, 1777: 1092-1097, 2008; doi: 10.1016/j.bbabio.2008.05.001
Uoselis, L., Nguyen, T. N., Lazarou, M. Mitochondrial degradation: Mitophagy and beyond. Mol. Cell, 83: 3404-3420, 2023; doi: 10.1016/j.molcel.2023.08.021
Valente, E.M., Abou-Sleiman, P.M., Caputo, V., Muqit, M.M.K., Harvey, K., Gispert, S., Ali, Z., Del Turco, D., Bentivoglio, A.R., Healy, D.G., Albanese, A., Nussbaum, R., González-Maldonado, R., Deller, T., Salvi, S., Cortelli, P., Gilks, W.P., Latchman, D.S., Harvey, R.J., Wood, N.W. Hereditary early-onset Parkinson’s disease caused by mutations in PINK1. Science, 304: 1158–1160, 2004; doi: 10.1126/science.1096284
Wang, S., Long, H., Hou, L., Feng, B., Ma, Z., Wu, Y., Zeng, Y., Cai, J., Zhang, D., Zhao, G. The mitophagy pathway and its implications in human diseases. Signal Transduct. Target. Ther., 8: 1-28, 2023; doi: 10.1038/s41392-023-01503-7
Williams, J. A., Zhao, K., Jin, S., Ding, W.-X. New methods for monitoring mitochondrial biogenesis and mitophagy in vitro and in vivo. Exp. Biol. Med., 242: 781-787, 2017; doi: 10.1177/1535370216688802
Yoshii, S. R., Kishi, C., Ishihara, N., Mizushima, N. Parkin mediates proteasome-dependent protein degradation and rupture of the outer mitochondrial membrane. J. Biol. Chem., 286: 19630-19640, 2011; doi: 10.1074/jbc.M110.209338
Youle, R. J., Narendra, D. P. Mechanisms of mitophagy. Nat. Rev. Mol. Cell Biol., 12: 9-14, 2011; doi: 10.1038/nrm3028
Zampese, E., Surmeier, D.J. Calcium, bioenergetics, and Parkinson’s disease. Cells, 9: 2045, 2020; doi: 10.3390/cells9092045
Zhao, J., Wang, J., Zhao, K., Yang, S., Dong, J., Zhang, Y., Wu, S., Xiang, L., Hu, W. Palmatine ameliorates motor deficits and dopaminergic neuron loss by regulating NLRP3 inflammasome through mitophagy in Parkinson’s disease model mice. Mol. Neurobiol., 61: 4539–4553, 2024; doi: 10.1007/s12035-024-04367-2
Zhu, J., Dagda, R. K., Chu, C. T. Monitoring mitophagy in neuronal cell cultures. In: Manfredi, G., Kawamata, H. Neurodegeneration: Methods and Protocols. Humana Press, 2011: 325-339; doi: 10.1007/978-1-61779-328-8_21