미세아교세포와 별아교세포는 신경퇴행성 질환에서 어떻게 상호작용하나요?
미세아교세포와 별아교세포는 중추신경계(CNS) 내에서 항상성을 유지하고 손상에 대응하는 데 필수적인 역할을 하는 두 가지 주요 유형의 글리아 세포입니다. 두 세포 유형은 뇌의 면역 반응에 기여하며, 신경퇴행성 질환의 공통된 특징인 신경염증에서 핵심적인 역할을 합니다.
미세아교세포
미세아교세포는 CNS의 주요 면역 세포로, 난황막 대식세포에서 유래했으며 주변 면역 세포와 구분됩니다(Ginhoux, 2010; Leavy, 2010). 이들은 고도로 동적이며, 특수한 수용체 집합체를 통해 뇌의 미세환경을 지속적으로 모니터링합니다(Qin, 2023). 미세아교세포는 식작용, 시냅스 정제, 신경 기능 조절에 관여하는 신호 분자 분비 등에 필수적입니다(Gao, 2023).
최근 연구는 미세아교세포의 다양한 상태를 밝혀내며, 전통적인 M1(염증성)과 M2(항염증성) 이분법적 분류를 넘어섰습니다. 대신 미세아교세포는 환경적 신호, 유전적 요인, 질병 진행 단계에 따라 기능적 표현형의 스펙트럼을 보여줍니다. 예를 들어, 알츠하이머 병(AD)에서 질병 관련 미세아교세포(DAM)는 아밀로이드 플라크 근처에 위치하며 아밀로이드-β 집합체의 제거에 기여합니다(Keren-Shaul, 2017; Gao, 2023). 반면, 미세아교세포의 지속적인 활성화는 과도한 사이토킨 생산을 유발해 시냅스 기능을 손상시키고 신경 세포 손상을 악화시킬 수 있습니다(Kwon, 2020). 미세아교세포는 또한 아밀로이드 베타와 타우와 같은 변형 단백질을 확산시켜 신경퇴행을 촉진하는 세포외 소포를 방출합니다. 이는 AD에서 아밀로이드 베타와 타우, 파킨슨병(PD)에서 알파-시누클레인에 해당됩니다(Gao, 2023).
아스트로사이트
아스트로사이트는 CNS에서 가장 많은 신경 세포로, 항상성 유지, 혈류 조절, 시냅스 전달 지원에 필수적입니다. 그들은 혈관-뇌 장벽(BBB) 조절에 적극적으로 참여하며, 글리프마틱 시스템의 핵심 구성 요소로 작용하며, 시냅스와 신경 세포 기능에 주요 역할을 하며, 세포외 이온 및 신경전달물질의 균형을 조절하고 사체 세포를 제거합니다(Abbott, 2010; Sweeney, 2018; Kwon, 2020).
아스트로사이트는 미세아교세포와 마찬가지로 보호적에서 유해한 상태까지 반응성 상태로 존재할 수 있습니다. 염증성 아스트로사이트(A1 형질)는 IL-1β, TNF-α, 보체 캐스케이드 단백질과 같은 사이토카인을 분비하며, 이는 신경세포와 시냅스에 손상을 입히는 것으로 알려져 있습니다. 반면, 항염증성 아스트로사이트(A2 형질)는 신경 영양 인자와 다른 보호 분자를 분비하여 신경 세포의 생존과 회복을 촉진합니다. 아스트로사이트 기능 장애는 신경퇴행성 질환에서 흔히 관찰되며, 신경염증을 악화시키고 질환 진행에 기여합니다(Kwon, 2020).
예를 들어, 알츠하이머 병(AD)에서 아스트로사이트 활성화는 글루타메이트 제거 장애와 연관되어 흥분성 독성과 신경세포 사멸을 유발합니다. 또한 미세아교세포 사이토킨에 의해 유도된 반응성 아스트로사이트는 혈관벽 장벽(BBB)을 손상시켜 신경세포의 취약성을 더욱 악화시킵니다(Kwon, 2020). 유사하게, 루게릭 병(ALS)에서 독성 인자(예: C3)를 발현하는 반응성 아스트로사이트는 운동 신경세포 퇴화에 기여합니다(Gao, 2023).
미세아교세포-아스트로사이트 상호작용
미세아교세포와 아스트로사이트는 CNS의 항상성 유지에 필수적이며, 손상 및 질병에 대응하는 데 중요한 역할을 합니다. 그들의 상호작용은 매우 동적이며, 상태와 환경적 맥락에 따라 신경염증과 신경퇴화에 보호적 또는 유해한 영향을 미칠 수 있습니다(Liu, 2020; Kim, 2021; Gotoh, 2023). 병리적 자극에 반응하여 미세아교세포는 활성화되어 IL-1α, TNF-α, C1q와 같은 염증성 인자를 분비합니다. 이러한 분자들은 아스트로사이트를 반응성 A1 형질로 유도하며, 이는 추가적인 염증성 사이토카인의 분비를 통해 미세아교세포의 활성화를 지속시킵니다. 이 상호작용 신호전달은 염증을 증폭시키고 신경퇴행성 과정을 가속화하는 파괴적인 피드백 루프를 형성합니다(Gao, 2023). 이 반응성 상태에서 미세아교세포는 신경 회로 정교화에 필수적인 과정인 시냅스 정리를 증가시킵니다. 그러나 염증 조건 하에서는 이 과정이 유해해질 수 있습니다. 동시에 아스트로사이트는 신경세포가 보체 단백질을 분비하도록 자극하며, 이는 미세아교세포를 활성화시켜 시냅스나 심지어 전체 신경세포를 식균작용으로 파괴하게 하여 신경세포 손실에 기여합니다(Sierra, 2013). 이 염증의 악화되는 순환은 혈액-뇌 장벽(BBB)을 손상시켜 그 보호 기능을 약화시키고, B 세포, T 세포, 단핵구와 같은 주변 면역 세포가 CNS로 침투하도록 허용합니다. 이 침투한 세포들은 글리아 세포로부터 사이토킨 방출을 증가시켜 지속적인 면역 활성화 환경을 조성하며, 이는 신경 조직에 추가적인 손상을 입힐 수 있습니다(Abbott, 2010; Sweeney, 2018).
이러한 유해한 상호작용에도 불구하고 미세아교세포와 아스트로사이트는 보호 및 재생 과정을 촉진할 수 있습니다. 특정 조건 하에서 미세아교세포는 IL-10 신호전달을 통해 아스트로사이트가 항염증성 A2 형질을 채택하도록 유도하여 조직 손상을 제한하고 회복을 촉진하는 더 회복적인 환경을 조성합니다(Mohammad, 2024). 중추신경계 손상 후 아스트로사이트는 증식을 증가시켜 "글리아 흉터"라는 물리적 장벽을 형성합니다. 이 흉터는 손상 부위를 격리하고 추가 조직 손상을 방지합니다. 이 흉터는 때로는 신경 재생 을 방해할 수 있지만, 회복 초기 단계에서 중추신경계 환경을 안정화하는 데 중요한 역할을 합니다. 흉터 형성 외에도 미세아교세포와 아스트로사이트는 세포외 기질(ECM) 재건, 신혈관 형성, 혈관新生을 지원하는 인자를 분비합니다. 이러한 과정은 신경 세포의 생존에 유리한 환경을 조성하며, 손상된 신경 세포를 대체하기 위해 줄기 세포의 이동을 촉진하고, 손실된 연결을 복원하기 위한 축삭 재형성을 돕습니다(Yang, 2019; Heithoff, 2021).
결국, 미세아교세포와 별아교세포 간의 상호작용은 복잡하고 엄격히 조절되며, 염증 촉진 신호와 염증 억제 신호의 균형에 따라 결과가 크게 달라질 수 있습니다. 그들의 상호작용은 손상이나 질병 후 신경 손상과 신경 세포 손실을 유발할 수 있지만, 동시에 회복을 촉진하고 CNS의 균형을 회복하는 데도 필수적입니다. 이러한 이중 역할을 이해하는 것은 신경퇴행성 손상을 완화하면서 CNS의 내재적 재생 능력을 강화하는 전략을 개발하는 데 필수적입니다.
신경염증은 타우병과 어떻게 관련되어 있나요?
타우병증은 세포 내 섬유소 집합체로 진행성적으로 축적되는 과인산화 타우 단백질의 특징을 가진 신경퇴행성 질환의 한 그룹입니다. 이러한 집합체는 이소형 구성, 구조적 형태, 위치에 따라 다양하며, 주로 신경세포 내부에 침착됩니다. 타우병증은 타우 침착이 주요 병리학적 특징인 원발성 형태와, 추가적인 병리학적 요소가 동반되는 이차성 형태로 분류됩니다 . 원발성 형태에는 진행성 초핵성 마비(PSP), 피질기저부 퇴화(CBD), 전두측두엽 치매(FTD); 알츠하이머병(AD)에서 아밀로이드-베타와 같은 추가 병리학적 요인이 관여하는 이차형; 그리고 과들루프 파킨슨병(Lannuzel, 2007)과 같은 지리적 형태. 질병 진행 과정에서 타우 단백질은 포스트트랜스레이셔널 변형을 겪으며 베타 시트 풍부한 집합체로 변형되어, 원발 침착 부위에서 해부학적으로 연결된 부위로 프리온 유사 메커니즘을 통해 전파됩니다. 이 과정에는 타우 단백질 병리학적 씨앗이 타우 단량체를 모집하는 것이 포함됩니다(Jucker, 2018). 글리아 세포(미세아교세포 및 아스트로사이트)는 초기에는 세포외 타우를 식균작용으로 제거하고 보호 인자를 방출하여 손상을 완화하려 하지만, 만성적 노출은 이들을 반응성 상태로 유도합니다. 이러한 반응성 상태는 NF-κB 경로의 활성화, 염증체에 의한 전사, 과도한 사이토킨 방출, 리소좀 청소 장애, 시냅스 정돈 오류로 특징지어집니다. 이러한 지속적 신경염증 상태는 타우 시딩을 촉진하고 신경 기능 장애를 가속화하며 인지 기능 저하와 밀접하게 연관되어 타우병의 진행을 더욱 악화시킵니다.
미세아교세포는 신경퇴행성 질환에서 타우 병리에 어떻게 기여할까요?
최근 연구에서 염증성 미세아교세포와 기능 저하 미세아교세포가 타우 병리와 신경퇴화에 서로 다른 역할을 한다는 데 점점 더 많은 공감대가 형성되고 있습니다(Streit, 2014; Angelova, 2019; Odfalk, 2022). Odfalk은 최근 리뷰 논문인 "미세아교세포: 타우 병리에서의 친구와 적"에서 이 패러다임을 매우 간결하게 정리했습니다(Odfalk, 2022). 질병의 초기 단계에서 미세아교세포는 보호 역할을 수행합니다. 미세아교세포는 퇴화하는 신경돌기 방향으로 이동해 죽어가는 신경세포에서 방출된 용해성 및 필라멘트형 타우를 포식하고, 조직 균형을 회복하는 데 도움을 주는 항염증성 매개체를 분비합니다. 그러나 이 유익한 감시 상태는 취약합니다. 지속적인 단백질 병리학적 스트레스, 연령 관련 활성화, 유전적 위험 알레르, 또는 동반된 뇌혈관 손상은 미세아교세포를 질병 연관 미세아교세포(DAM) 형질로 전환시킵니다. DAM은 항상성 표지자를 하향 조절하며, 역설적으로 더 많은 종자 형성 능력이 있는 타우 종의 섭취, 세포 내 분열, 및 후속 방출을 촉진하는 식작용-리소좀 및 지질 대사 유전자를 상향 조절합니다.
미세아교세포의 식작용이 타우 제거에 긍정적인 역할을 한다는 증거가 상당합니다(Luo, 2015; Bolós, 2017; Leyns, 2017). 타우 병리학은 미세아교세포의 형질을 변경하여 신경염증을 감소시킬 때 실험적으로 개선되는 것으로 나타났습니다. 이는 TNFα 억제(Gabbita, 2015) 또는 3xTgAD 마우스에서의 IL-1 신호전달 차단(Kitazawa, 2011)을 통해 이루어졌습니다. 미세아교세포가 타우 병리의 진행에 직접적으로 기여한다는 증거도 있습니다. 이는 그들의 항상성 기능의 이상 조절을 포함한 다양한 메커니즘을 통해 이루어집니다(Perea, 2018; 2020). 예를 들어, 미세아교세포는 타우 종자의 세포 간 전파를 촉진하여 이후 집합체를 형성합니다. 이 메커니즘은 Asai 등 (2015)이 미세아교세포의 제거가 타우 전파를 감소시킨다는 것을 입증함으로써 지원됩니다. 또한, 플라크와 연관된 미세아교세포가 트랜스제닉 마우스 모델에서 타우 전파를 촉진한다는 강력한 증거가 있습니다(Clayton, 2021).
타우병증의 맥락에서 정상과 병리적 균형의 예시는 프랙탈킨 수용체 CX3CR1의 역할입니다(Perea, 2018). 정상 상태에서 미세아교세포는 휴지 상태를 유지하며, 신경세포에 발현되는 CX3C 리간드(CX3CL1)와 미세아교세포에 발현되는 수용체(CX3CR1)가 상호작용하여 정상 기능을 유지합니다(Jiang, 2023;Bhaskar, 2010; Zhan, 2014; Maphis, 2015). 이 축은 CX3CL1의 막 결합형과 용해형이 미세아교세포 수용체 CX3CR1에 결합함으로써 유지되며, 이는 적절한 면역 기능을 보장합니다. 세포외 타우가 존재할 경우 미세아교세포는 활성화되어 과도한 타우를 식작용을 통해 제거하려 시도하며, 이 과정은 CX3CL1/CX3CR1 축에 의해 영향을 받습니다. 알츠하이머 병에서 병리가 진행되고 신경세포 사멸이 증가함에 따라 세포외 타우가 현저히 축적되며, 이는 CX3CL1/CX3CR1 경로의 정상 기능을 방해합니다. 과도한 타우는 CX3CL1과 CX3CR1 간의 결합을 경쟁하여 미세아교세포의 타우 제거를 방해합니다(Bolós, 2017). 이에 대응해 미세아교세포는 과활성화되고 증식하며, 더 많은 CX3CL1과 CX3CR1을 생성하여 보상 시도합니다. 그러나 이 증가에도 불구하고 CX3CL1/CX3CR1 축은 조절 장애를 일으키며, 이는 타우 축적과 질병 진행을 더욱 촉진합니다. 이 기능 장애를 보이는 미세아교세포 반응은 면역 조절의 복잡한 역할을 강조합니다.
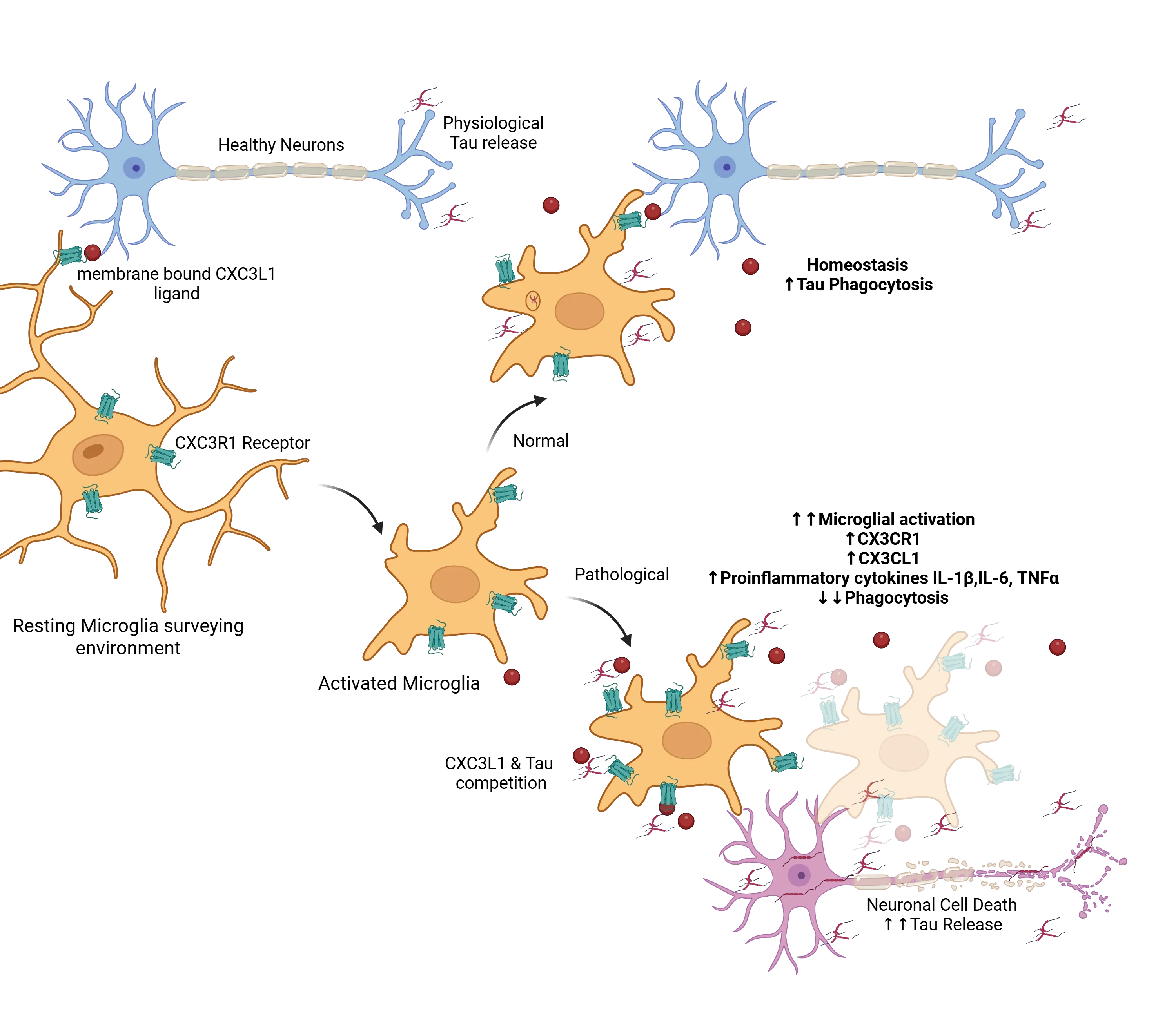
CXCL1/CXC3R1와 같은 신호는 미세아교세포가 환경을 감시하는 동안 휴식 상태를 유지하는 데 도움을 줍니다. 세포외 타우가 존재할 경우, 이러한 미세아교세포는 활성화되며 정상 조건에서는 타우를 식균작용으로 제거하여 항상성을 유지하는 데 기여합니다. 병리적 조건에서 과도한 타우는 CXCL1/CXC3R1 상호작용과 경쟁하여 활성화된 미세아교세포를 기능 장애 상태로 밀어넣습니다. 이로 인해 활성화 증가, 식작용 감소, 타우 제거 감소가 발생하며, 결국 세포외 타우 축적이 증가하여 독성 사이클을 악화시킵니다. 그림은 Perea et al. (Perea, 2018)에서 Creative Commons Attribution License 하에 재현되었습니다.
아스트로사이트는 어떻게 타우 병리를 증폭시키고 전달하나요?
아스트로사이트는 신경 세포의 기능 장애에 의해 영향을 받는 수동적인 구성 요소로만 여겨지던 것에서 벗어나, 타우 병리의 핵심적인 역할을 하는 것으로 점점 더 인정받고 있습니다. 이들은 타우의 항상성 조절과 뇌 영역 간 병리적 확산에 적극적으로 기여하는 것으로 밝혀지고 있습니다. 최근 연구 결과에 따르면 아스트로사이트는 타우를 내재화하는 복잡한 메커니즘에 참여하여 그 축적과 제거에 영향을 미칩니다. 이 글리아 세포는 이중 역할을 수행합니다: 한쪽으로는 세포외 타우 부하를 완화하려는 완충 역할을 하며, 다른 쪽으로는 기능 장애나 과활성화로 인해 타우 응집과 확산을 증폭시킬 수 있습니다. 이 미묘한 역할은 신경퇴행성 질환에서 타우 동역학을 조절하기 위한 치료적 개입의 잠재적 표적으로 아스트로사이트를 부각시킵니다(Reid, 2020).
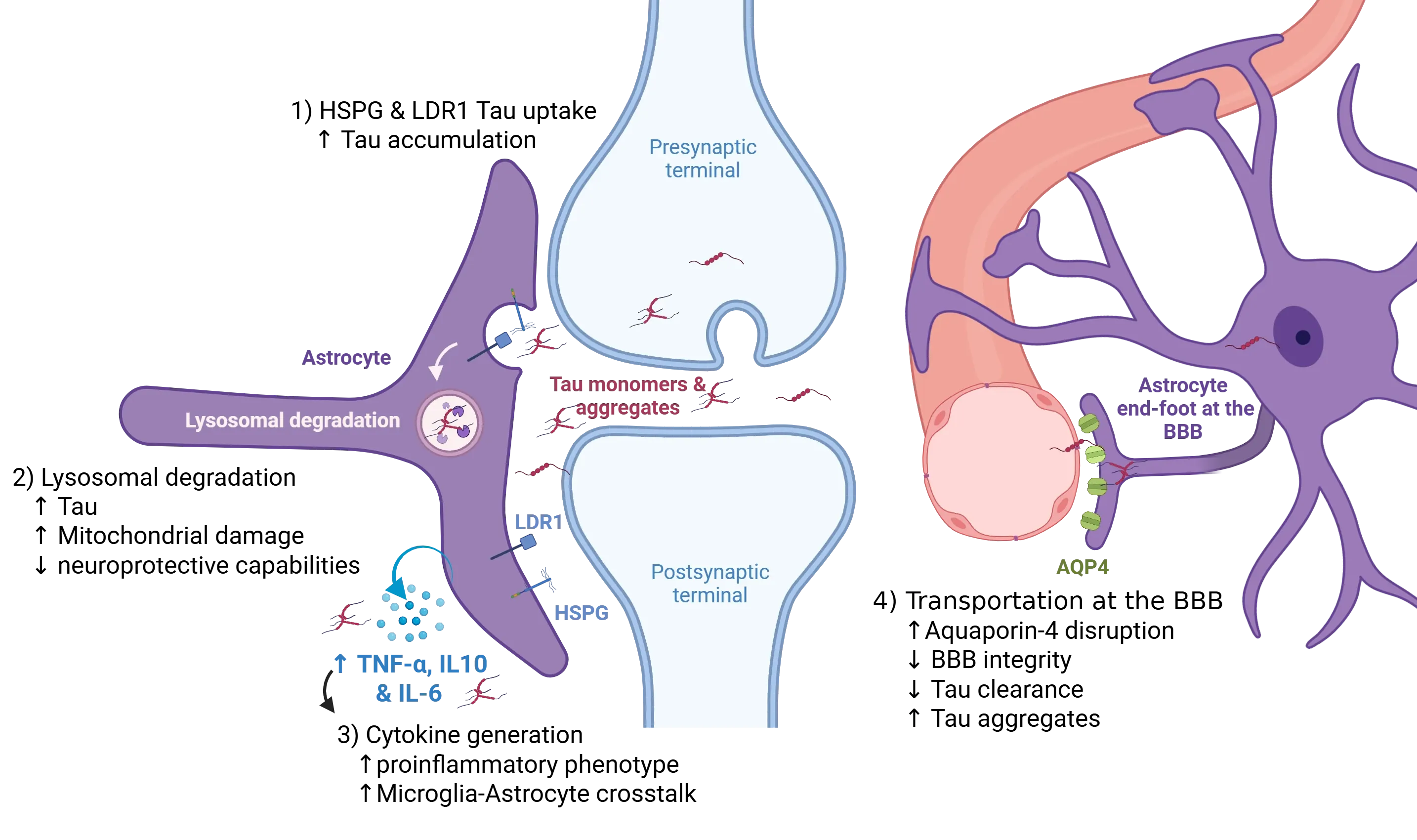
아스트로사이트는 중추 신경계 내에서 타우 병리의 전파를 조절하는 데 적극적인 역할을 합니다. 신경세포는 전신경말단에서의 시냅스 방출을 포함해 다양한 경로를 통해 타우 단백질을 세포외 공간으로 방출합니다. 시냅스 주변 아스트로사이트는 수용체 매개 내포작용을 통해 세포외 타우를 내재화하며, 이는 주로 특정 헤파란 설페이트 프로테오글리칸(HSPGs)을 통해 이루어집니다. HSPGs는 집합된 타우에 선택적으로 결합하며, 저밀도 지단백질 수용체 관련 단백질 1(LRP1)은 단일체 및 올리고머 타우의 내재화를 매개합니다(1). 이러한 경로의 장애는 세포외 타우의 제거와 축적 사이의 균형을 변화시켜 타우 확산을 촉진할 수 있습니다. 내재화된 타우는 분해 위해 리소좀으로 운반됩니다(2); 그러나 리소좀 기능의 장애(내재적 과부하 또는 병리적 신호전달로 인해)는 세포내 타우 축적과 종자 형성 능력이 있는 집합체 형성을 유발합니다. 동시에, 종양 괴사 인자 알파(TNF-α)와 인터루킨 IL-10 및 IL-6와 같은 사이토카인의 증가로 특징지어지는 염증성 환경은 아스트로사이트의 반응성을 증폭시키고 아스트로사이트-미세아교세포 간 교신을 촉진합니다(3), 이는 병리적 타우 종의 확산에 이용 가능한 풀을 증가시킵니다. 또한, 혈관 주위 아스트로사이트 말단 발의 아쿠아포린-4(AQP4) 국소화 장애는 타우의 글리프마틱 청소를 방해합니다(4). 이 혈관 주위 청소 메커니즘의 장애는 세포외 타우의 점진적 축적을 초래하며, 이는 뇌 실질 전체로 타우 병리의 확산을 악화시킵니다. 그림은 Reid et al. (Reid, 2020)의 Creative Commons Attribution License 하에 재인용되었습니다.
시냅스에서 신경세포는 시냅스 틈새 주변에 단일체와 집합체 형태의 타우를 방출하며, 이 물질들은 아스트로사이트에 의해 수용체 매개 내포작용을 통해 신속히 포획됩니다(Reid, 2020). 아스트로사이트는 고도로 황산화된 헤파란 설페이트 프로테오글리칸(HSPGs)을 독특하게 갖추고 있으며, 이는 섬유상 타우에 대해 나노몰 농도에서 친화성을 보여 효율적으로 내-리소좀 분해 경로로 유도합니다(Puangmalai, 2020). 이 능력은 리소좀 조절인자 TFEB의 발현 증가로 강화되며, 이는 아스트로사이트의 리소좀 부피를 확장시켜 포식된 타우를 처리하는 능력을 향상시킵니다(Martini-Stoica, 2018). 특히, 아스트로사이트의 타우 섭취는 섬유에 국한되지 않습니다. 저밀도 지단백질 관련 단백질-1(LRP1)은 HSPGs와 협동하여 단일체 및 올리고머 타우를 내재화하여 아스트로사이트가 처리할 수 있는 타우 종의 범위를 확장합니다(Reid, 2020). 이 아스트로사이트 메커니즘은 초기에는 시냅스 타우를 제거하고 균형을 유지하는 역할을 하지만, 역설적으로 세포 내 타우 집합체의 저장고를 생성합니다. 이 종자 형성 능력이 있는 집합체는 이후 방출되어 프리온 유사 전파를 증폭시키며, 아스트로사이트를 시냅스 타우 균형의 보호자이자 병리적 확산의 기여자로 이중 역할을 하게 합니다.
혈관-뇌 장벽에 위치한 아스트로사이트는 특히 글리프마틱 시스템과의 연결을 통해 타우 제거에 중요한 역할을 합니다. 그들의 혈관 주위 말단 발은 수분 채널인 아쿠아포린-4(AQP4)가 풍부해 간질액의 이동을 촉진하고 글리프마틱 교환을 유도합니다(Sun, 2025). 이 시스템은 뇌 내 용해성 타우를 제거하여 타우 병리를 완화합니다. 그러나 AQP4 기능 장애는 유전적 결손, 위치 이상, 수면 분열, 노화 등 다양한 메커니즘을 통해 글리프마틱 흐름을 방해하고 혈관뇌장벽의 무결성을 저하시켜 타우 제거를 감소시키고 세포외 타우 축적 및 응집을 악화시킬 수 있습니다. 반면, AQP4 극성 회복이나 글리프마틱 기능 강화에 초점을 맞춘 개입은 전임상 연구에서 타우 부하 감소와 인지 기능 개선에 유망한 결과를 보여주었습니다(Zhou, 2025). 예를 들어, 행동 수정, 약물 치료, 신경 조절 방법 등 글리프마틱 펌핑과 AQP4 발현을 최적화하는 표적 접근법은 치료적 잠재력을 입증하는 강력한 증거를 제공합니다(Sun, 2025).
글리아 매개 타우 집합체 제거를 치료적으로 강화할 수 있을까요?
미세아교세포에 의한 타우 응집체 제거 강화
미세아교세포는 변형된 타우 단백질의 제거에 중요한 역할을 합니다. 이 제거 기능을 강화하는 치료법이 연구 중입니다. 유망한 접근법 중 하나는 TREM2 활성화를 통해, 인간 단일클론 항체 VG-3927이 대표적이며, 현재 Phase 1 용량 증량 연구를 완료 중입니다. TREM2를 결합함으로써 이 치료법은 미세아교세포의 항상성 표현형을 회복하고 세포외 타우의 식작용 제거를 촉진하는 것을 목표로 합니다. 또 다른 접근 방식은 NLRP3 염증체 억제이며, 이는 다양한 동물 모델에서 유망한 결과를 보여주었습니다(Zhang, 2020). Quan은 NLRP3 결핍이 타우 전사유전자 마우스에서 신경염증을 감소시키고 인지 기능을 개선한다는 것을 보여주었습니다(Quan, 2024)
가장 진전된 접근법 중 하나는 TREM2 작용제입니다. 완전 인간 IgG1 항체인 VG-3927은 인간 대상 첫 번째 용량 증량 및 약동학 연구를 완료 중이며, 지질 감지 경로를 활성화하고 미세아교세포 대사 회복 및 타우 식작용을 강화하는 것을 목표로 합니다. 이전 항체(예: Alector의 AL002, Denali의 DNL-919)는 Phase 2 프로그램에서 기대에 미치지 못했지만, 업데이트된 TREM2 작용제인 Novartis VHB937은 2024년에 알츠하이머 병과 근위축성 측삭경화증(ALS)을 대상으로 임상 시험에 진입하며 이 접근법에 대한 지속적인 기대감을 보여주고 있습니다. 수용체 작용제와 보완적으로, 뇌 투과성 소분자 MCC950을 통한 NLRP3 염증체 억제는 IL-1β 성숙을 억제하여 하류 화학키닌 캐스케이드를 완화합니다. 개선된 약동학 특성을 갖춘 다수의 차세대 NLRP3 억제제가 IND 승인 연구 단계로 진전되었습니다.
TREM2가 미세아교세포 기능에 미치는 역할에 대한 심층적 검토는 다음을 참조하십시오: TREM2와 미세아교세포
면역치료 접근법
타우를 표적으로 하는 활성 및 수동 면역치료법이 개발 중이며, 미세아교세포 기능을 조절함으로써 세포외 타우 환경을 재구성하는 데 잠재력을 보여주고 있습니다(Jadhav, 2019). 활성 면역요법(예: 펩타이드 또는 mRNA 백신)과 수동 면역요법(예: 인간화 항체)은 용해성 타우 씨앗을 선택적으로 제거하는 것을 목표로 합니다. 씨앗 형성 능력 있는 구조체나 단축된 조각을 감소시킴으로써, 이러한 치료법은 미세아교세포 활성화를 간접적으로 조절하여 타우 집합체의 흡수 및 제거를 촉진하며 과도한 신경염증을 유발하지 않습니다. 특정 병리적 타우 종을 표적화하도록 설계된 2세대 항체는 Phase 1-2 임상 시험 단계에 진행 중이며, 그 성공은 미세아교세포가 항체-오포니화된 타우를 처리하는 효율성에 부분적으로 의존합니다. 이러한 전략은 여전히 초기 단계에 있지만, 진행 중인 연구는 타우 관련 신경퇴행성 질환 치료를 위한 잠재력을 계속해서 정교화하고 있습니다.
아스트로사이트 표적: 글리프마틱 흐름에서 프로테오스타시스까지
아스트로사이트는 AQP4에 의존하는 혈관 주위 교환을 통해 간질 용질의 대량 제거를 촉진하며, 변형된 타우를 분해하는 열 충격 단백질을 분비합니다(Zhou, 2025). AQP4 극성 조절의 실험적 활성화 또는 아스트로사이트 TFEB(리소좀 생합성의 주요 조절자)의 약리학적 활성화는 쥐 타우병 모델에서 타우 제거를 가속화하며, 현재 소분자 TFEB 작용제 및 AQP4 조절제를 통해 탐구되고 있습니다(Verkman, 2013). 또한, 미세아교세포가 방출한 사이토킨(예: IL-33에 의해 유도된 지질 제거 프로그램)의 아스트로사이트 전환은 양방향 글리아-글리아 교차작용을 잠재적 치료 접근법으로 강조합니다(Carlock, 2017; Sun, 2021).
타우의 후전사적 처리의 대사 조절
염증 beyond, 타우 자체의 대사 조절은 치료적 개입의 대상으로 여전히 매력적입니다 . O-GlcNAcase (OGA)의 선택적 억제는 타우의 O-GlcNAcylation을 증가시켜 병리적 인산화 및 응집을 구조적으로 방해합니다(Kielbasa, 2024; Selnick, 2019; Wang, 2020). 경구 투여 가능한 강력한 선택적 소분자 OGA 억제제인 MK-8719는 PSP에서 Phase 1b 임상 시험으로 진행되었으나, 초기 효능 신호는 미미했으나 뇌척수액(CSF) 약동학 바이오마커는 강력한 표적 결합을 확인했습니다. 두 번째 OGA 억제제인 ceperognastat(이전 명칭 MK-8722)은 2025년 2월 Eli Lilly에 의해 알츠하이머 병(AD) 환자군에서 치료 용량 미달로 인해 중단되었으나, 구조 및 활성 개선 연구는 진행 중입니다. 중요하게도, 이러한 대사 개입은 기능적 글리아 단백질 균형 기계에 의존하며, 미세아교세포와 별아교세포의 지원이 최대 치료 효과를 위해 필수적임을 강조합니다.
전망
수용체 활성화, 염증체 차단, 면역요법, 대사 조절에서 얻어진 데이터는 공통된 주제를 제시합니다: 글리아 세포는 병리적 타우를 중화하는 미개척 잠재력을 지니지만, 이 잠재력은 균형 잡힌 항상성 표현형으로 재조정되어야 합니다. 미래 임상 시험은 글리아 상태와 타우 부하의 실시간 변화를 포착하기 위해 정밀한 분자적 결합과 민감한 체액 및 영상 바이오마커를 결합해야 합니다. 단일 제제 글리아 조절제가 임상적으로 의미 있는 질병 진행 속도 감소를 가져올 수 있는지, 아니면 타우 표적 항체나 안티센스 올리고뉴클레오티드와의 합리적인 조합에서 가장 효과적일지 여부는 여전히 미해결 과제입니다. 이 분야는 빠르게 발전 중이며, 아스트로사이트와 미세아교세포-타우 상호작용을 표적하는 다른 치료 후보물질들이 연구 중입니다. 진행 중인 연구는 타우 병증에서 글리아의 복잡한 역할을 밝히며, 효과적인 질병 수정 치료법을 개발하는 것을 목표로 하고 있습니다.
저희 팀은 신경퇴행성 질환에서의 미세아교세포, 별아교세포 및 타우에 대한 질문에 답변해 드리거나, 치료 효과 연구에 사용되는 알츠하이머 병(AD) 및 타우병증 모델에 대한 구체적인 정보를 제공해 드릴 수 있습니다.
신경퇴행성 질환 모델에 대해 더 알아보세요
관련 콘텐츠
신경퇴행성 질환에서의 미세아교세포, 별아교세포 및 타우에 대한 최신 정보 및 신경퇴행성 질환 동물 모델에서 치료제 평가와 관련된 최선의 실천 방법.
TREM2와 미세아교세포
TREM2 개요, 미세아교세포에서의 역할, 신경퇴행성 질환과의 연관성 및 잠재적 치료적 함의.
미세아교세포-신경세포 상호작용 및 신경퇴행성 질환
미세아교세포와 신경세포 간의 직접적인 상호작용에 대한 간결한 검토, 그리고 이러한 세포 간 상호작용이 신경퇴행성 질환에서 어떻게 영향을 받을 수 있는지.
미세아교세포, 아스트로사이트 및 알파-시누클린 파킨슨병에서의 역할
알파-시누클레인이 파킨슨병 및 기타 시누클레인 병증에서 미세아교세포와 별아교세포에 미치는 영향.
신경 퇴행성 질환의 TNF-α & 미세 아교 세포
미세아교세포에서 종양괴사인자-알파(TNF-α)의 기능과 신경퇴행의 진행에 대한 기여에 대한 개요.
NLRP3 인플라마좀과 신경퇴행성 질환
NLRP3 인플라마솜과 알츠하이머병, 파킨슨병, ALS를 포함한 신경 퇴행성 질환에서의 그 역할에 대한 개요.