Tau, Rather than Amyloid-β, Drives Neurodegeneration in Alzheimer's Disease (AD) and Mouse Models of AD
아밀로이드-베타 형질전환 모델
인간 알츠하이머병의 특징인 베타-아밀로이드 병리학은 돌연변이 인간 아밀로이드 전구체 단백질(APP)과 프리세닐린 1(PS1; PSEN1)의 과발현을 통해 형질전환 마우스에서 모델링할 수 있습니다. 인간 질병과 유사하게, 병리학의 진화는 나이가 들면서 증가합니다.
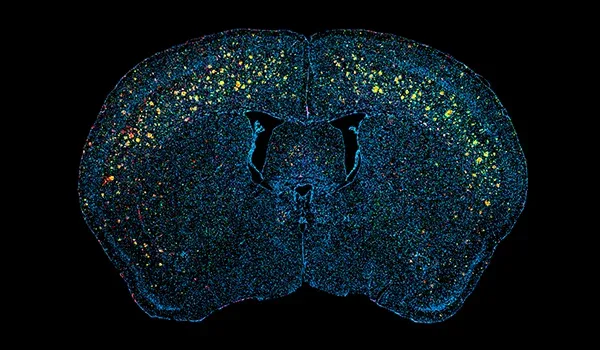
실험적 질병 조절 치료제의 효능을 전임상 평가하는 데 사용하는 APP/PS1 모델은 재현성이 뛰어나며, 인간 알츠하이머병의 여러 주요 특징을 재현합니다. 이 마우스는 진행성 아밀로이드 베타(Aβ) 플라크, 뇌혈관 병리, 신경염을 나타냅니다. 치료적 개입에 대한 반응은 디지털화된 뇌 조직 섹션의 다중 면역형광 염색에 대한 고급 이미지 분석을 포함한 여러 정량적 판독을 통해 평가할 수 있습니다.
아밀로이드-베타 및 타우 공동 병리 모델
우리의 아밀로이드 베타 (Aβ) 및 타우 공동 병리 마우스 모델은 알츠하이머 병의 두 가지 특징적인 특징인 Aβ 플라크 축적과 타우 관련 신경퇴행을, 유전자 변형 기술과 바이러스 벡터 기반 방법을 결합하여 재현합니다. 이 모델은 알츠하이머 병의 병리 메커니즘을 조사하고 질병 수정 치료법의 효능을 평가하는 데 강력한 실용적 플랫폼을 제공합니다.
아밀로이드-베타 병리는 APP/PS1 전유전자 마우스를 사용하여 확립되며, 이 마우스는 연령에 따라 Aβ 플라크 침착이 발생합니다. 타우 병리를 유도하기 위해, 야생형 인간 타우(2N4R)를 발현하는 아데노연관 바이러스(AAV) 벡터가 질병 관련 뇌 부위에 스테로타픽 주사로 투여됩니다. 이 표적 발현은 신경 세포체 및 과정 내 인산화 타우 집합체의 축적을 유발합니다. 이 병리 모델은 알츠하이머 병과 관련된 복잡한 병리학적 상호작용을 반영하는 심각한 신경염증, 신경퇴화 및 기능 장애를 보여줍니다.
알츠하이머병 및 타우병 모델의 인간 질병으로의 번역 가능성
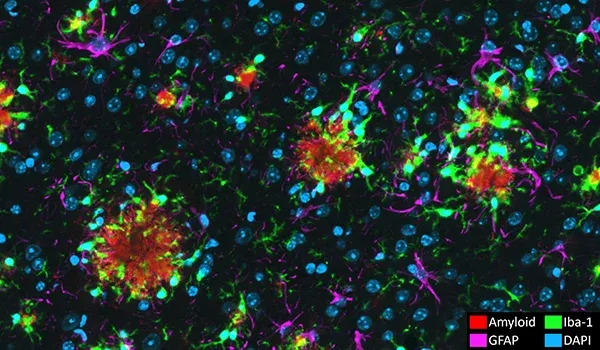
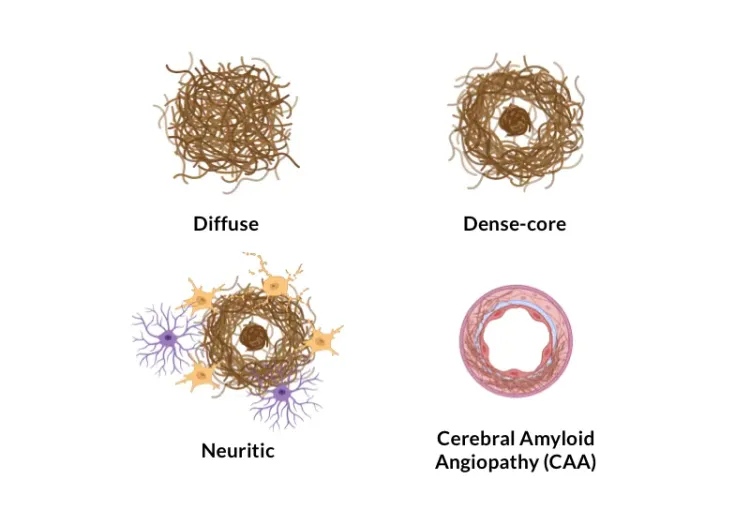
아밀로이드 베타 플라크와 뇌혈관 병리
알츠하이머병의 신경병리학적 특징은 아밀로이드-베타의 응집으로 인한 세포 외 플라크와 뇌혈관 침착물입니다(Serrano-Pozo, 2011). 저희 APP/PS1 마우스 모델은 아밀로이드-베타 병리(확산성, 밀집성, 신경성 플라크, 세포 내 아밀로이드-베타, 뇌혈관 병리 포함)의 시간 의존적 증가를 보여줍니다. A&beta 병리학은 잘 정의된 시공간 패턴으로 진행되며, 저희 팀이 개발한 정교한 알고리즘을 사용하여 정량화할 수 있습니다.
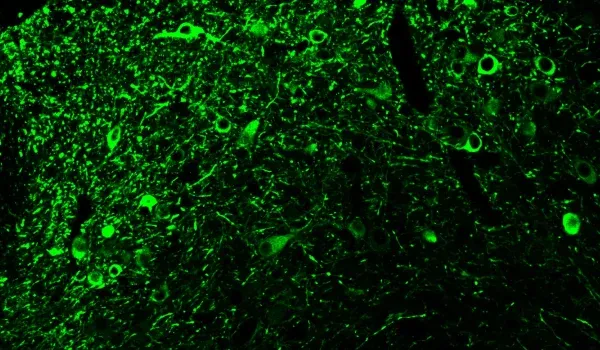
타우 병리학
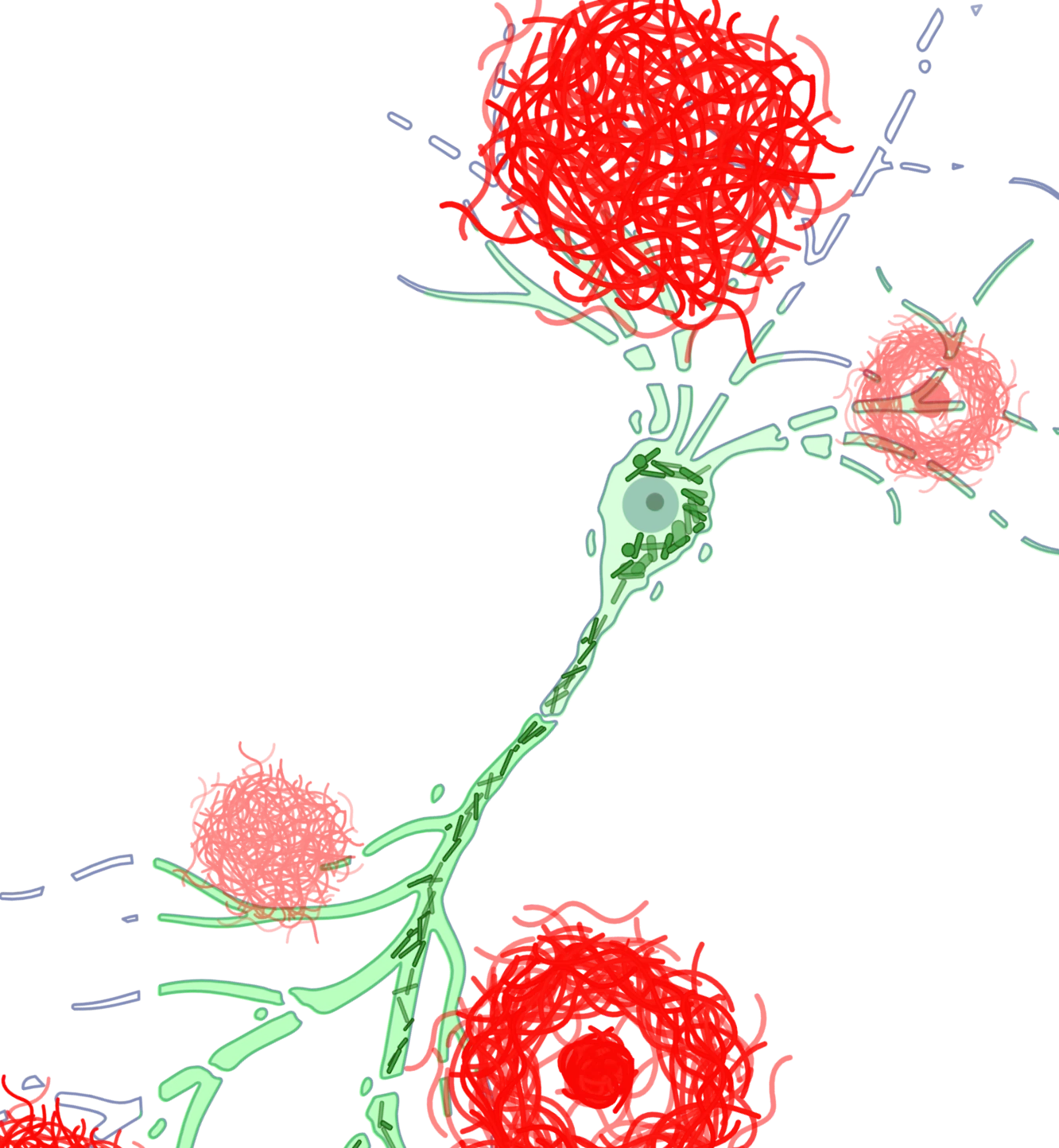
또한, 아밀로이드 베타와 함께 타우(tau)는 알츠하이머병에서 발견되는 주요한 오작동 단백질입니다. 타우는 알츠하이머병의 임상적, 신경 영상적 특징의 주요 원인으로 여겨집니다(Lew, 2021; Carbonell, 2025). 우리의 APP/PS1/인간 타우 모델은 아밀로이드 베타와 타우 병리를 모두 보여줍니다. 인산화 타우 염색은 세포체와 세포 돌기에서 관찰됩니다. 진행성 핵상마비, 피질-기저부 퇴행, 전두측두엽 치매와 같은 타우병증은 특정 뇌 영역에서 순수한 타우 병리를 나타냅니다. AAV-hTau 모델에서 우리는 타우 발현을 흑질과 중뇌 영역에 표적화하여 파킨슨병의 특징을 가진 타우병증을 효과적으로 모델링할 수 있습니다.
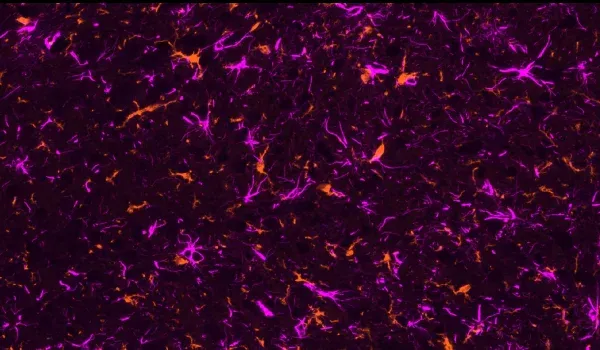
활성화된 미세아교세포와 반응성 아스트로사이트
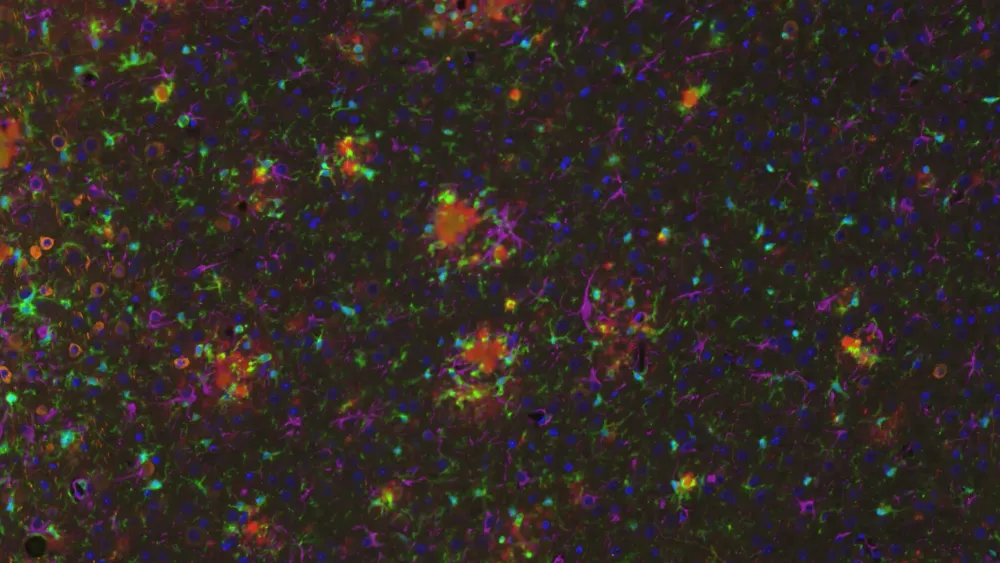
활성화된 미세아교세포와 반응성 성상교세포를 포함한 신경염증 세포는 오작동된 아밀로이드-베타 및 타우(Minter, 2015; Chen and Yu, 2023)와 가까운 곳에서 발견됩니다. 저희 APP/PS1 마우스 모델에서, 저희는 Aβ 플라크, 활성화된 미세아교세포, 비활성화된 미세아교세포, 그리고 Aβ 플라크와 비대성 및 비비대성 성상교세포 사이의 공간적, 시간적 관계를 입증했습니다. 또한 저희는 APP/PS1/hTau 병리학 및 AAV 유도 타우병 모델에서 인산화 타우와 관련하여 강력한 미세아교세포증과 성상교세포증을 관찰했습니다.
타우병에 의한 파킨슨 운동 특징
진행성 핵상마비 및 피질-기저변성은 순수한 타우병으로, 다른 임상 증상들 중에서도 파킨슨병의 특징과 흑질(substantia nigra)의 심각한 신경세포 손실을 특징으로 합니다(Oyangi, 2001). AAV-hTau 모델에서, 우리는 실질적 운동 기능의 심각한 결핍( 실린더 테스트, 꼬리 서스펜션 스윙 테스트, 로타로드 테스트, 뒷다리 쥐기 테스트에 근거)을 발견했는데, 이는 흑질에 있는 도파민성 신경세포의 퇴행과 그에 따른 선조체의 탈신경의 결과입니다.
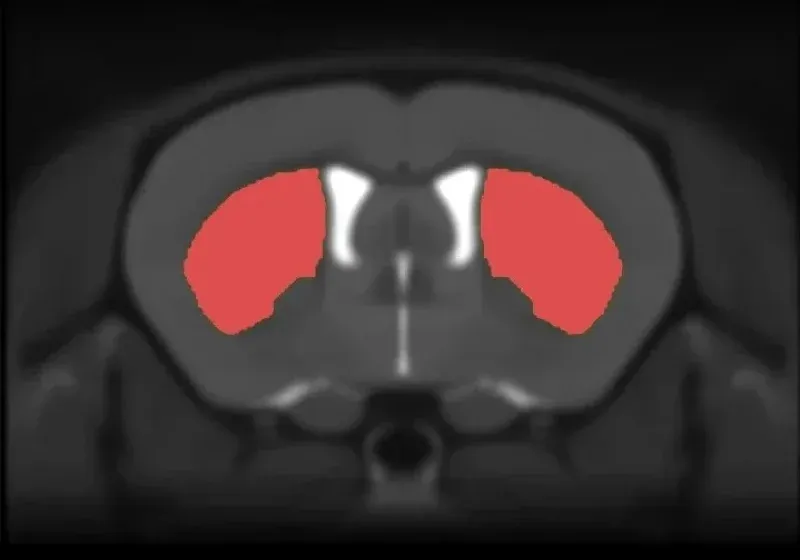
지역성 뇌 위축
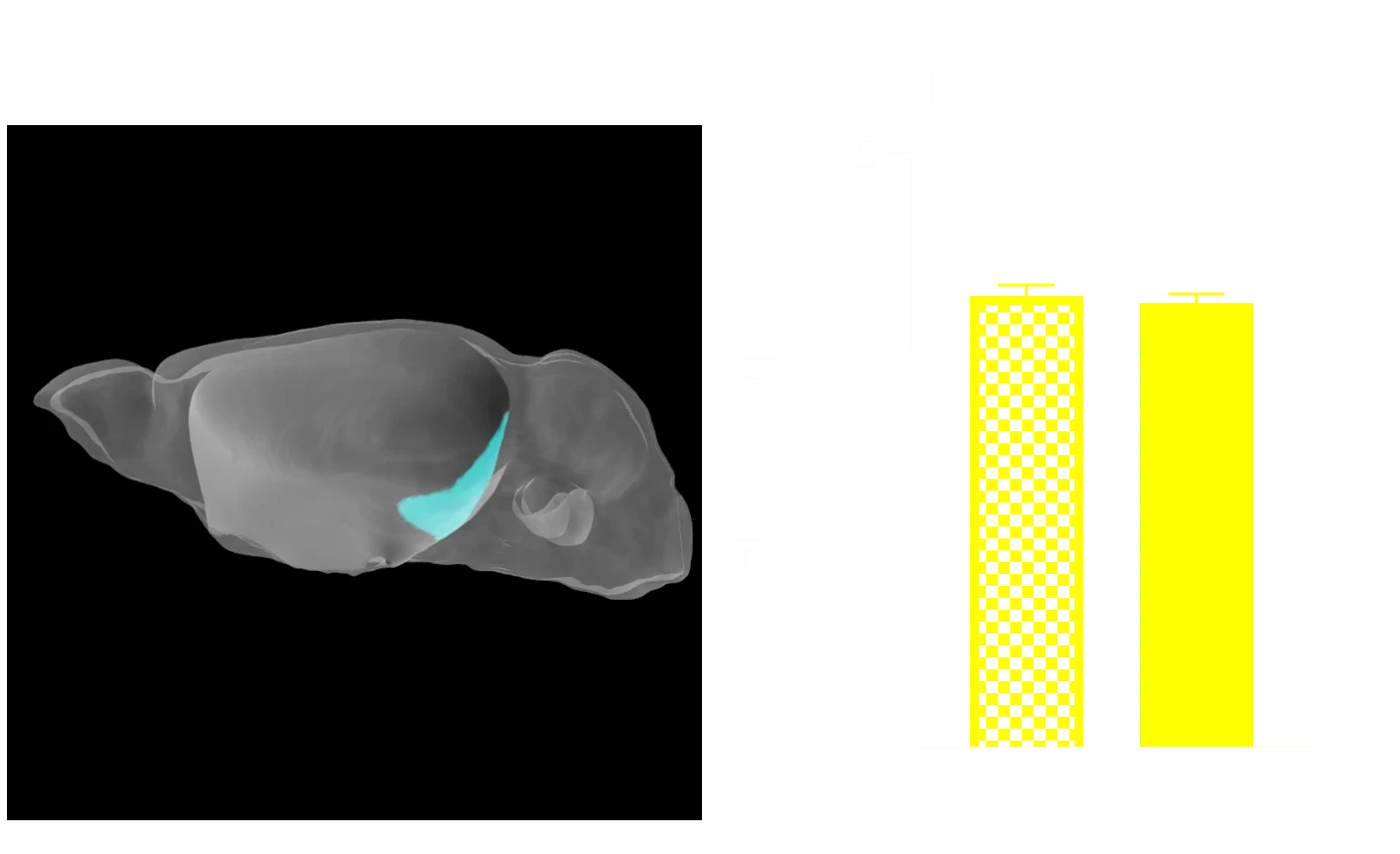
다중 모드 영상 바이오마커는 알츠하이머병과 타우병의 임상 시험에서 널리 사용되고 있습니다. MRI에서 도출된 국소 부피와 피질 두께 측정은 뇌 위축에 매우 민감하며, 알츠하이머병, 진행성 핵상마비, 피질-기저 변성, 전두측두치매에서 시간 경과에 따른 질병 진행을 모니터링할 수 있게 해줍니다. 비침습적 생체 내 전뇌 MRI 획득과 첨단 완전 자동 이미지 처리 및 분석 기술을 결합하여, 타우 병리와 관련된 매우 중요한 뇌 영역 위축을 보여줌으로써 신경 퇴화의 강력한 생체 내 측정 및 번역적 바이오마커로 사용될 수 있음을 입증했습니다.
알츠하이머병 마우스 모델 특징
아래의 대화형 프레젠테이션을 통해 생체 내 데이터와 전체 멀티플렉스 면역형광 조직 섹션의 고해상도 이미지를 포함하여 인간 알츠하이머병 마우스 모델에서 아밀로이드-β, 타우 및 뇌 위축 사이의 관계를 살펴볼 수 있습니다.
왼쪽 패널을 사용하여 이 "이미지 스토리"를 간단하게 탐색할 수 있습니다.
왼쪽 마우스 버튼을 사용하여 고해상도 현미경 이미지를 이동할 수 있습니다. 마우스/트랙패드(위/아래) 또는 왼쪽 상단 모서리에 있는 + 및 - 버튼 을 사용하여 확대 및 축소할 수 있습니다 . 오른쪽 상단 모서리에 있는 제어판에서 채널 및 세분화에 대한 이미지 설정을 토글(켜기/끄기), 색상 변경 및 조정할 수 있습니다.
최상의 상호작용 경험을 위해 전체 화면 모드를 사용하는 것이 좋습니다.
알츠하이머병 및 타우병증 마우스 모델의 특성화, 검증된 측정 방법, 전임상 신경과학 CRO 서비스에 대해 자세히 알아보세요.
관련 콘텐츠
알츠하이머병에 대한 최신 정보와 알츠하이머병 동물 모델에서 치료제 평가와 관련된 모범 사례.
ALS, 알츠하이머병, 파킨슨병의 미세아교세포 형태학
미세아교세포 형태학적 분석의 개요와 신경퇴행성 질환 연구 및 신약 개발에 대한 응용.
알츠하이머병의 아밀로이드-베타 플라크 분석
인간과 알츠하이머병 동물 모델(유전자 변형 쥐와 랫트)의 뇌 조직 섹션에서 Aβ 플라크를 분류하고 정량화하는 방법의 개요.