TDP-43 모델 개요
세포질 TDP-43 (또는 TDP43) 응집체는 가족성 및 산발성 ALS의 특징입니다. TDP-43 응집이 있는 근위축성 측삭 경화증(ALS; 운동 신경 질환[MND]이라고도 함)의 여러 트랜스제닉(tg) 마우스 모델이 존재하지만, 각각의 모델은 장점과 단점이 있습니다. 약물 개발을 위한 ALS 마우스 모델 리소스에서 ALS 동물 모델에 대해 자세히 알아보세요.
Biospective에서는 TDP-43 단백질 병증("TDP-43 모델")의 ALS 마우스 모델인 rNLS8(또는 ΔNLS; delta NLS; dNLS)의 원본 버전과 수정된 버전을 모두 사용합니다.
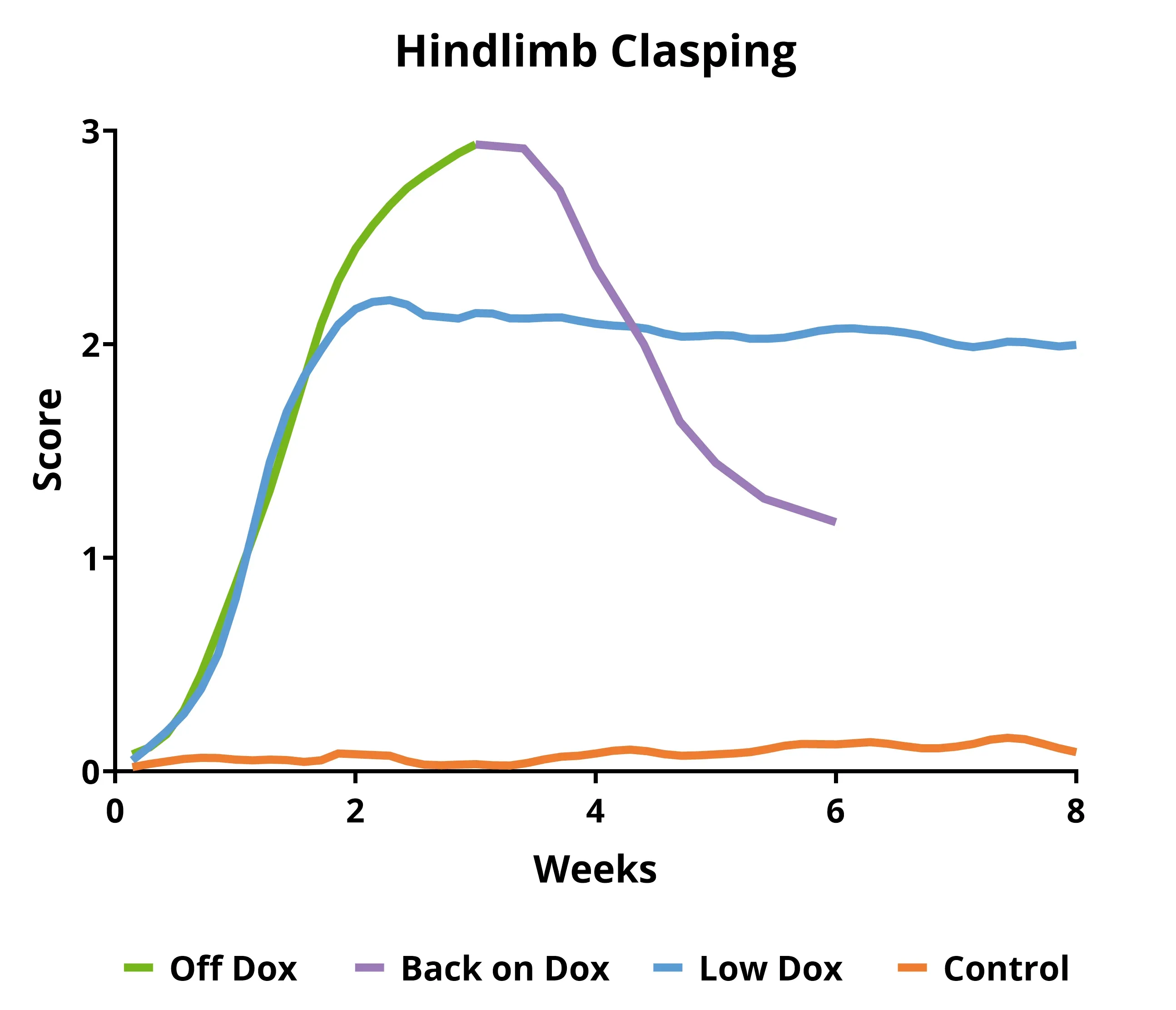
- 원래 마우스 모델("Off Dox"): 빠르게 진행됨(몇 주)
- Biospective 마우스 모델("Low Dox"): 진행이 느림(몇 달)
ALS 연구자들에게 이 TDP-43 모델의 중요한 장점은 다음과 같습니다.
- TDP-43의 세포질 내 위치 이동
- 점진적 운동 기능 장애
- 근육 약화, 신경 절단, 위축
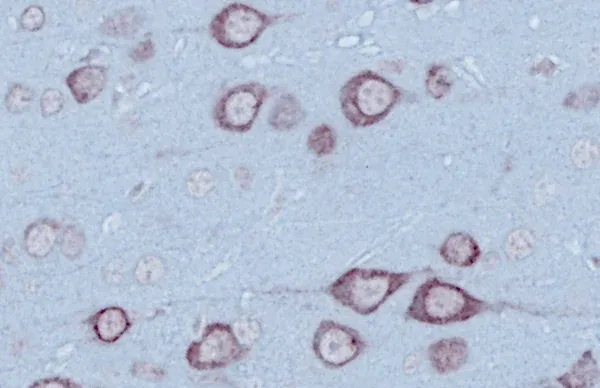
- 운동 뉴런 퇴행 및 국소 뇌 위축
- 신경염증
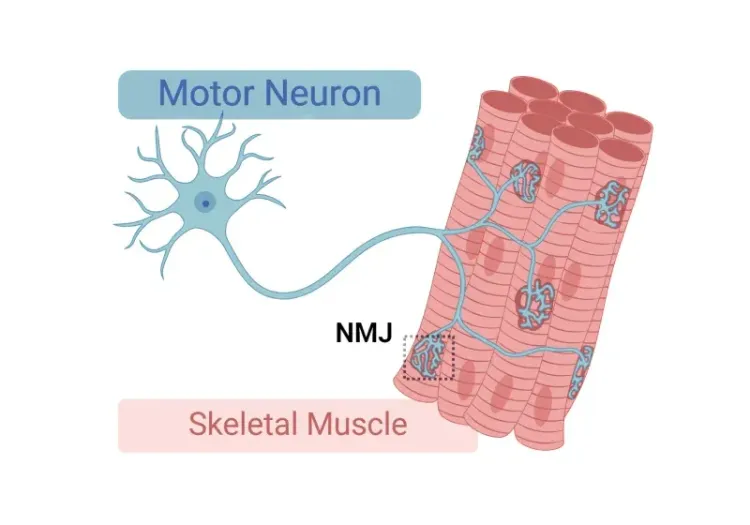
- 뇌, 척수, 신경근 접합부(NMJ) 병리
이 모델의 시간 경과는 예측 가능하며, 질병 진행의 측정은 재현성이 매우 높기 때문에 전임상 연구에서 치료제 평가를 위한 훌륭한 모델입니다. 자세한 내용은 리소스 - 신약 개발을 위한 TDP-43 ΔNLS(rNLS8) 마우스에서 확인하실 수 있습니다.
TDP-43 마우스 세대
rNLS8(NEFH-hTDP-43-ΔNLS) 이중 형질전환 ALS 마우스("TDP43 마우스 모델")는 NEFH-tTA 형질전환 유전자를 가진 마우스와 tetO-hTDP-43-ΔNLS 형질전환 유전자를 가진 마우스를 교배하여 생성됩니다. 이 TARDBP 모델은 원래 Walker et al.(Acta. Neuropathol., 130: 643-670, 2015). 이 모델은 근위축성 측삭 경화증(ALS) 또는 운동 신경 질환(MND)의 모델입니다. 또한 전두측두치매(FTD) 또는 전두측두엽변성(FTLD)의 TDP-43 병리학 모델로도 사용할 수 있습니다.
이 TDP-43 트랜스제닉 마우스는 번식과 초기 노화 기간(일반적으로 생후 5~12주) 동안 독스(Dox) 사료를 먹습니다. 그런 다음, 마우스는 독스 사료에서 표준 사료("오프 독스" 모델) 또는 바이오스펙트럼이 개발한 대체 프로토콜("로우 독스" 모델)로 전환되어 인간 TDP-43 발현을 가능하게 합니다. 이 모델의 흥미로운 특징은 쥐를 다시 독스 다이어트에 넣음으로써 병리학적 회복과 기능적 회복을 모두 달성할 수 있다는 점입니다.
저희의 검증된 TDP-43 형질전환 마우스 측정
- 체중
- 모터 스코어링(뒷다리 잡기, 떨림, 그릴 민첩성, 마비)
- 그립력 테스트
- 생체 내 근육 전기 생리학, 복합 근육 활동 전위(CMAP) 포함 (ALS 마우스 모델 및 척수 운동 뉴런 참조)
- 생체 내 종단 컴퓨터 단층 촬영(CT)으로 측정된 근육 위축 (ALS 약물 개발을 위한 TDP-43 ΔNLS(rNLS8) 마우스 참조)
- 신경원섬유소 가벼운 사슬은 혈장 및 뇌척수액에서 측정됩니다
- 신경변성을 측정하기 위한 MRI 뇌 위축 (신경변성 마우스 모델에서의 뇌 위축 분석 참조)
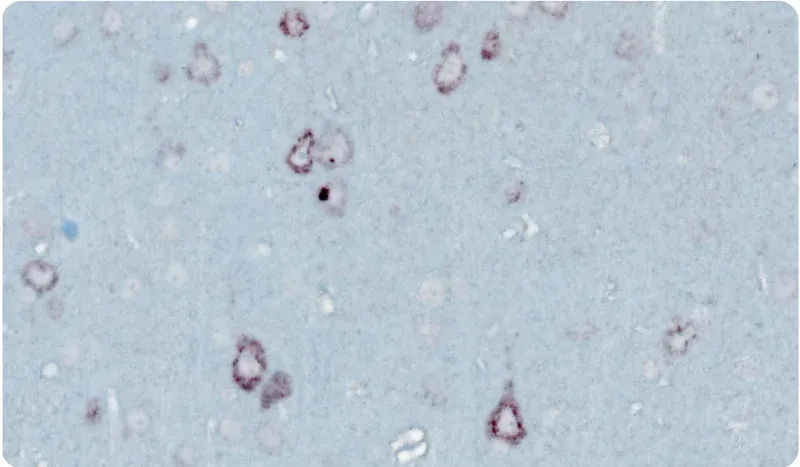
- 면역조직화학 & 다중 면역형광
이 모델이 인간 ALS에 적용될 수 있는지에 대해 자세히 알아보세요.
현미경 이미지
아래의 대화형 이미지 뷰어를 사용하면 TDP-43 형질 전환 마우스 모델의 전체 다중 면역 형광 조직 섹션을 탐색할 수 있습니다.
왼쪽 마우스 버튼을 사용하여 이미지를 이동할 수 있습니다. 마우스/트랙패드(위/아래) 또는 왼쪽 상단 모서리에 있는 + 및 - 버튼을 사용하여 확대 및 축소할 수 있습니다. 오른쪽 상단 모서리에 있는 제어판에서 채널의 토글(켜기/끄기), 색상 변경 및 이미지 설정 조정을 할 수 있습니다.
최상의 상호작용 경험을 위해 전체 화면 모드를 사용하는 것이 좋습니다.
이 모델의 특징, 검증된 측정 방법, 그리고 전임상 신경과학 CRO 서비스에 대해 자세히 알아보세요.
관련 콘텐츠
ALS에 대한 최신 정보와 ALS 동물 모델에서 치료제 평가와 관련된 모범 사례.
신경근 접합부(NMJ) 형태학 및 ALS 모델
신경근 접합부(NMJ)에 대한 통찰, 근위축성 측삭 경화증(ALS)에서의 그 역할, 그리고 NMJ의 형태학적 변화를 연구하는 데 사용되는 도구와 방법.
루게릭병 마우스 모델과 척수 운동 뉴런
근위축성 측삭 경화증(ALS)의 마우스 모델에서 척수 운동 신경 세포가 질병 진행에 관여하는 것에 대한 개요.
ALS 마우스 모델의 신약 개발
근위축성 측삭 경화증(ALS) 치료제의 전임상 시험을 위한 연구용 동물 모델(마우스 및 랫드 모델)의 가장 효과적인 사용에 대한 안내서.
ALS 신약 개발을 위한 TDP-43 ΔNLS (rNLS8) 마우스
이 자료는 임상 전 치료 연구를 위한 ΔNLS(deltaNLS, hTDP-43ΔNLS, hTDP-43DeltaNLS, dNLS, TDP43 NLS, rNLS8) TDP-43 ALS 유전자 변형 마우스 모델의 사용에 대한 정보를 제공합니다.
ALS, 알츠하이머병, 파킨슨병의 미세아교세포 형태학
미세아교세포 형태학적 분석의 개요와 신경퇴행성 질환 연구 및 신약 개발에 대한 응용.
자가포식 및 신경퇴행성 질환
세포 자가포식이 뇌 건강과 신경 퇴화에 어떤 역할을 하는지에 대한 개요.
자가포식 및 전사 인자 EB(TFEB)
전사 인자 EB(TFEB)와 자가포식 및 신경 퇴행성 질환에서의 역할에 대한 개요.