Cette ressource décrit :
- Qu'est-ce que le modèle cuprizone de la sclérose en plaques?
- Quelles sont les méthodes les plus courantes pour évaluer la démyélinisation et la remyélinisation chez les souris cuprizone?
- Quelles sont les considérations pratiques pour mesurer la démyélinisation et la remyélinisation dans les études précliniques d'efficacité thérapeutique?
Qu'est-ce que le modèle cuprizone de la sclérose en plaques?
La sclérose en plaques (SP) est une maladie démyélinisante auto-immune chronique du système nerveux central (SNC) qui touche plus de 2,8 millions de personnes dans le monde (Walton, 2020). Dans la recherche sur la SP, divers modèles précliniques sont utilisés pour reproduire différents aspects de la maladie, notamment le modèle de démyélinisation et de remyélinisation chez la souris cuprizone (Dedoni, 2023).
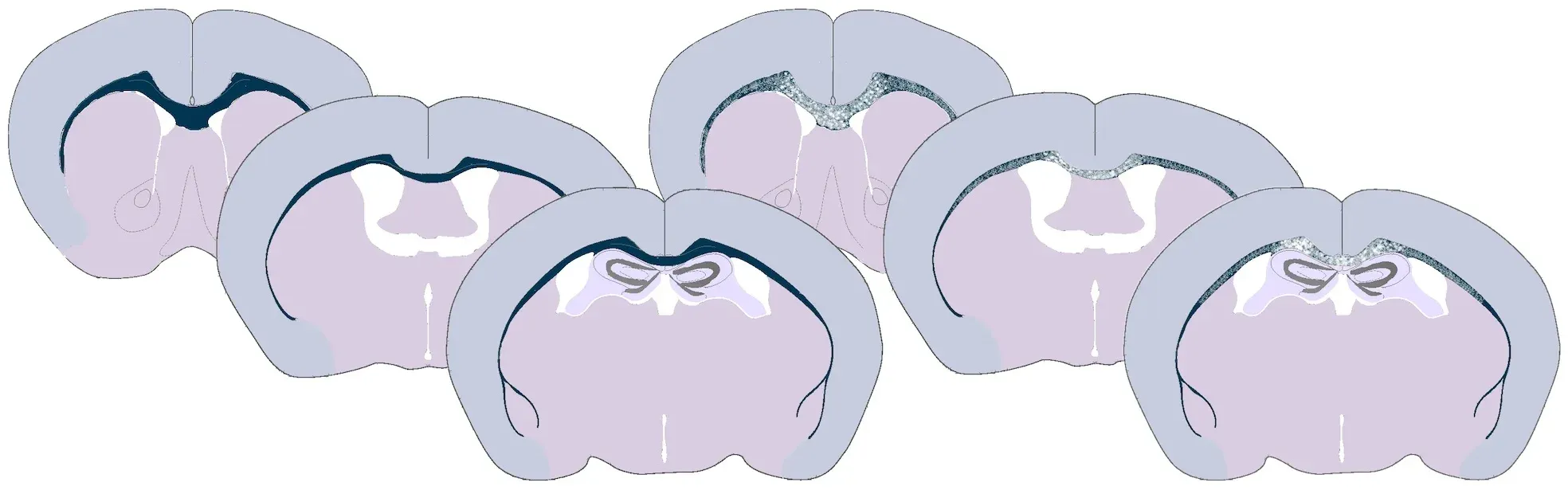
Illustration de la démyélinisation dans le corpus callosum de souris traitées avec Cuprizone. Une myélinisation normale du corpus callosum est illustrée à gauche, et une démyélinisation partielle de la matière blanche est illustrée à droite.
Le modèle cuprizone est un modèle de sclérose en plaques induite par une toxine largement utilisé (Kipp, 2024 ; Zhan, 2020). La cuprizone (C14H22N4O2), ou acide oxalique bis [cyclohexylidène hydrazide], est un agent chélateur du cuivre qui, administré par voie orale, induit la mort des oligodendrocytes matures et la démyélinisation subséquente de certains segments de la substance blanche dans le cerveau des rongeurs (Dedoni, 2023). Ce modèle implique l'activation de cellules immunitaires innées dans le cerveau, mais les lymphocytes T et B ne jouent pas un rôle central (Wolf, 2018), ce qui le distingue d'autres modèles de SP qui impliquent le système immunitaire adaptatif, tels que l'encéphalomyélite auto-immune expérimentale (EAE), le virus de l'encéphalopathie murine de Theiler (TMEV) et d'autres modèles viraux de SP (Dedoni, 2023). La démyélinisation induite par la cuprizone n'est pas dépendante des lymphocytes et se produit même chez les souris knock-out pour le gène activant la recombinaison (Rag), déficient en lymphocytes (Hiremath, 2008).
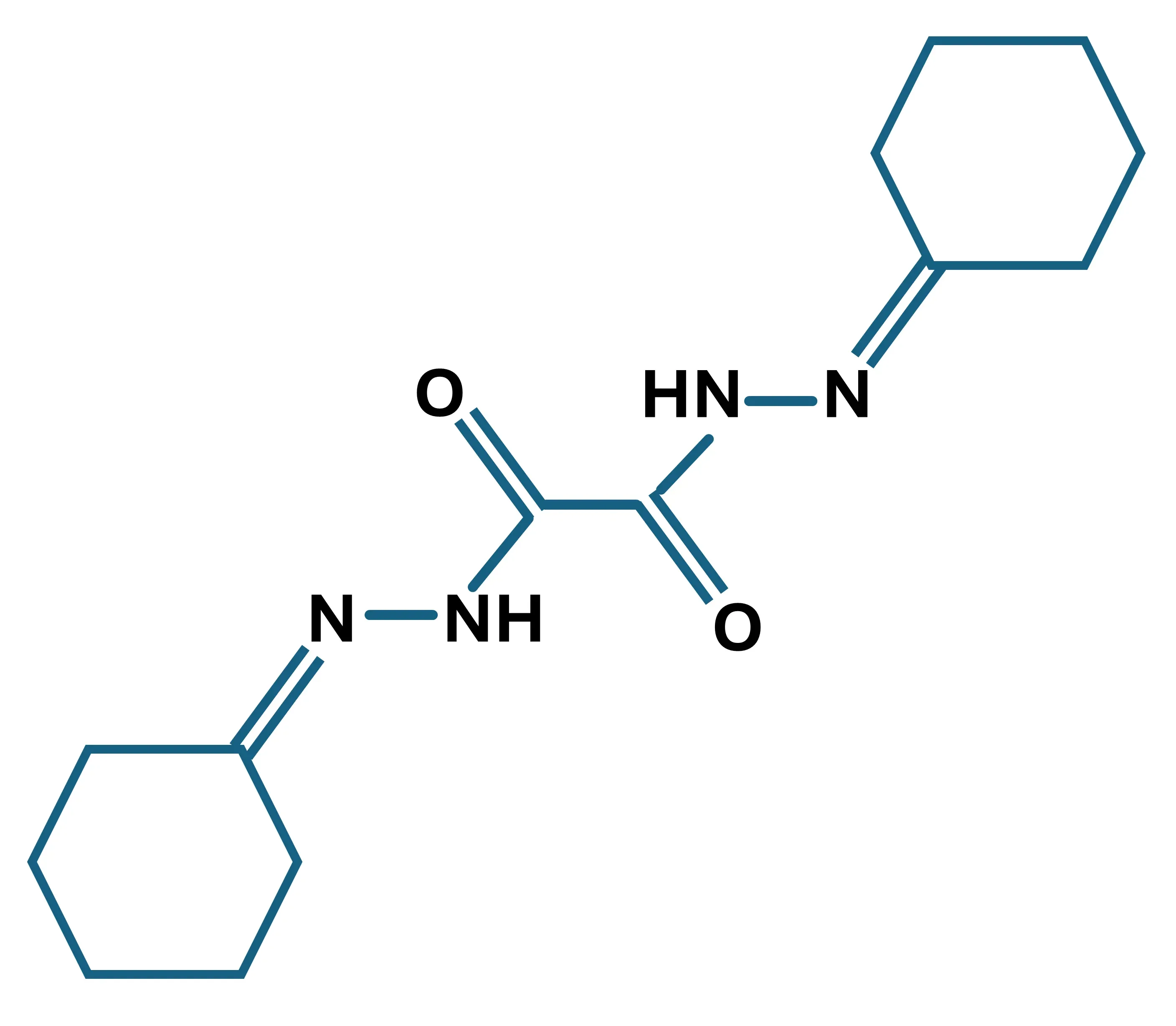
Structure moléculaire de la cuprizone ; C14H22N4O2 ; poids moléculaire : 278,45 g/mol
Le modèle cuprizone permet aux chercheurs de disséquer et d'étudier les mécanismes spécifiques de la progression de la SP. Ce modèle de rongeur peut être divisé en deux phases : (1) une démyélinisation initiale dans le corps calleux et d'autres régions du cerveau, telles que les pédoncules cérébelleux supérieurs et le cortex cérébral (Vega-Riquer, 2019), qui s'accompagne d'une activation du système immunitaire inné, et (2) une remyélinisation significative des axones exposés une fois que le traitement à la cuprizone est terminé (Gharagozloo, 2022).
En pratique, les souris sont nourries avec de la cuprizone pendant 5 à 6 semaines. Cette approche entraîne un stress et une mort sélectifs des oligodendrocytes, ce qui se traduit par une démyélinisation aiguë de sous-régions cérébrales distinctes, une activation microgliale et une prolifération astrocytaire importantes, une défaillance des mécanismes de transport axonal (Rühling, 2019) et, dans les modèles plus chroniques, des lésions axonales manifestes (Lindner, 2009). Les mécanismes exacts à l'origine de la dégénérescence des oligodendrocytes ne sont pas entièrement compris, mais ils peuvent inclure une perturbation mitochondriale due à un déficit en cuivre induit par la cuprizone, une ferroptose (Jhelum, 2020) et des réponses au stress du réticulum endoplasmique.
La chronologie des effets de la cuprizone est bien documentée. Dans la phase initiale, au cours de la première semaine de traitement, la mort des oligodendrocytes peut être observée dès deux jours après le début du traitement. On observe une activation précoce des astrocytes (Kipp, 2023) et de la microglie (Gudi, 2014), suivie d'une perte rapide d'oligodendrocytes matures, avec environ 65 % de perte dès le deuxième jour et 80 % à la fin de la première semaine (Kipp, 2023). Dans la phase intermédiaire, qui s'étend sur 1 à 3 semaines, la perte d'oligodendrocytes et l'activation des cellules gliales se poursuivent, les signes de démyélinisation et de pathologie axonale aiguë devenant évidents (Crawford, 2009 ; Kipp, 2023).
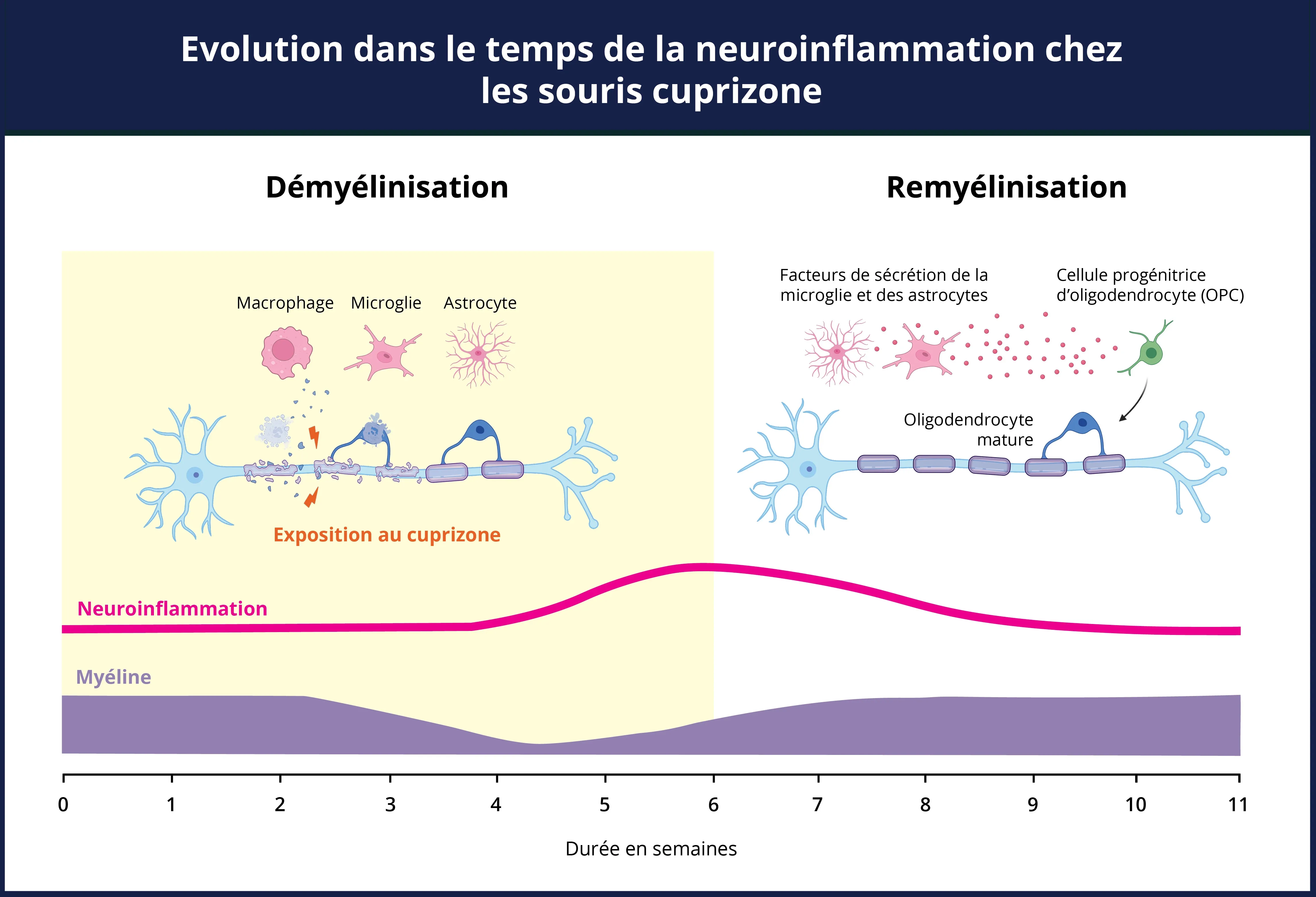
Vue d'ensemble de l'évolution temporelle de la neuroinflammation dans le modèle cuprizone. Pendant la période d'exposition à la cuprizone, on observe simultanément une perte de myéline (violet) et une augmentation spectaculaire des populations de microglies activées et d'astrocytes réactifs (rose), ce qui contribue à l'état neuroinflammatoire. Les astrocytes et la microglie jouent un rôle actif dans l'élimination des débris de myéline et dans l'activation des progéniteurs d'oligodendrocytes. La neuroinflammation disparaît après l'élimination de l'attaque à la cuprizone et la remyélinisation des axones.
Cliquez pour copier le lien
Entre 3 et 5 semaines, la démyélinisation devient visible et les OPC sont activés et recrutés pour remplacer les oligodendrocytes perdus (Brousse, 2015). Des troubles de la coordination motrice et des déficits comportementaux, principalement au niveau de la mémoire spatiale et du comportement social, deviennent évidents (Franco-Pons, 2007). A ce stade, si le régime contenant de la cuprizone est remplacé par un régime standard, le processus de démyélinisation s'arrête et la remyélinisation se produit.
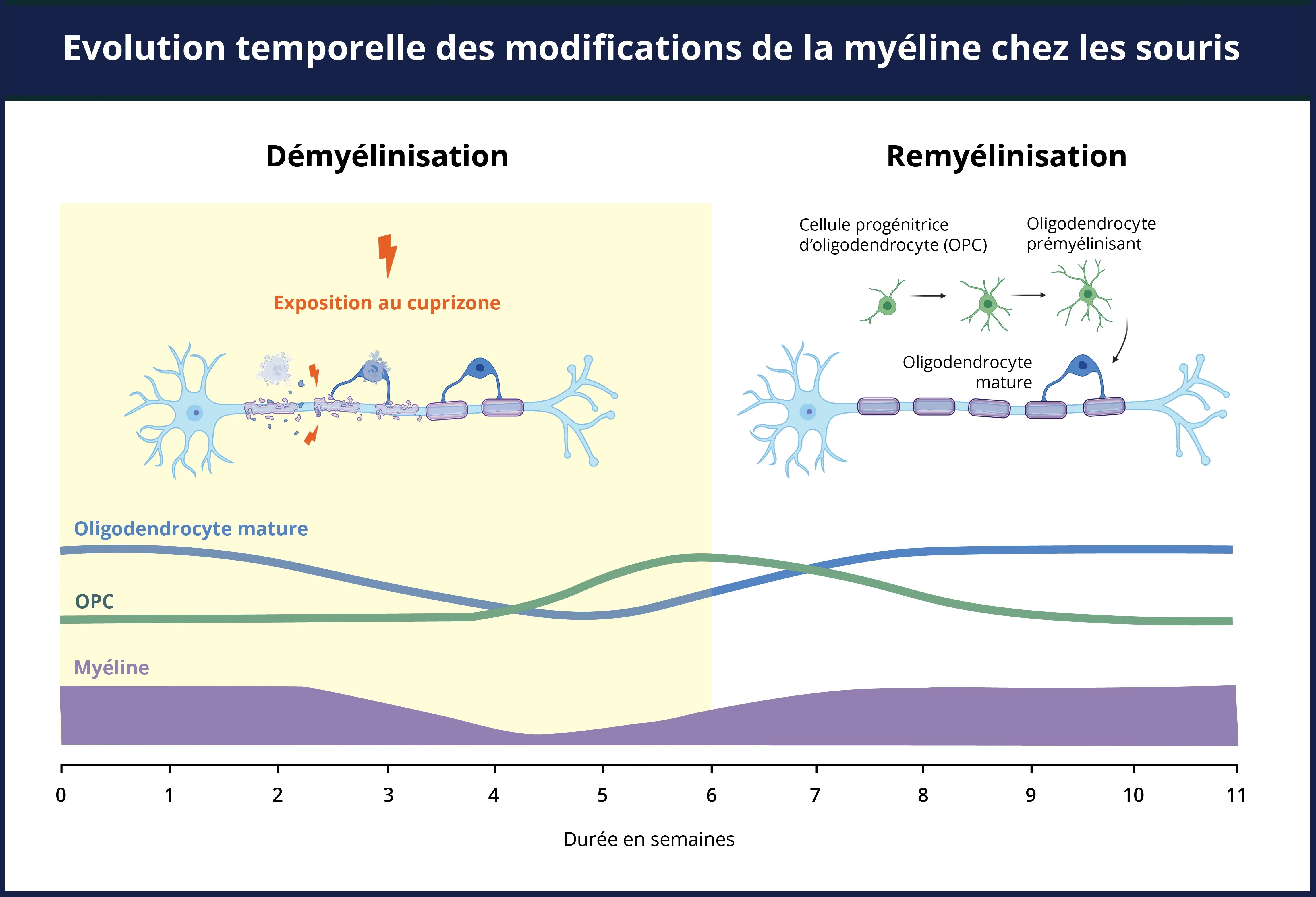
Vue d'ensemble de la chronologie de la démyélinisation et de la remyélinisation dans le modèle cuprizone. Pendant la période d'exposition à la cuprizone, on observe simultanément une perte de myéline (violet), la mort des oligodendrocytes matures (bleu) et une augmentation spectaculaire de la prolifération et de la différenciation des progéniteurs d'oligodendrocytes (vert) en cellules précurseurs d'oligodendrocytes (OPC) pré-myélinisantes. Les OPCs migrent et se différencient sur le site de la lésion tissulaire, même en présence de cuprizone. Dès l'élimination de la cuprizone, les OPC se différencient rapidement en oligodendrocytes matures, qui commencent à remyéliniser les axones exposés.
Cliquez pour copier le lien
Si le traitement est prolongé au-delà de 12 semaines, la démyélinisation peut devenir chronique, la population d'OPC s'épuisant et le potentiel de remyélinisation étant profondément diminué (Lindner, 2009). De nombreuses études ont montré que l'exposition prolongée à la cuprizone induit des lésions chroniques qui présentent une capacité de remyélinisation endogène limitée (Leo, 2022), une astrogliose prolongée (Hibbits, 2012) et des lésions axonales plus étendues (Lindner, 2009). En résumé, le modèle cuprizone est un outil crucial pour la recherche sur la SP car il reproduit des aspects clés de la maladie, en particulier la dégénérescence des oligodendrocytes et la démyélinisation qui en résulte. Il est essentiel de comprendre la chronologie et les mécanismes des lésions induites par la cuprizone pour mettre au point des interventions thérapeutiques ciblées contre la SP.
Quelles sont les méthodes les plus courantes pour évaluer la démyélinisation et la remyélinisation chez les souris cuprizone?
Pour étudier et comprendre efficacement les processus de démyélinisation et de remyélinisation, il est essentiel d'utiliser des techniques fiables de détection de la myéline et des processus de démyélinisation et de remyélinisation dans le système nerveux central (SNC). La visualisation de la myéline dans les tissus expérimentaux peut être réalisée à l'aide de techniques histologiques et d'immunohistochimie (IHC). L'analyse ultrastructurale des gaines de myéline peut être visualisée par microscopie électronique (ME), qui fournit des images à haute résolution. Des techniques d'imagerie in vivo avancées et non invasives, telles que l'imagerie par résonance magnétique (IRM), permettent de mieux comprendre le processus en cours. Bien que chacune de ces techniques permette de mieux comprendre les troubles liés à la myéline, elles présentent toutes des avantages et des inconvénients, comme indiqué ci-dessous.
Coloration histologique
Il existe une grande variété de techniques histochimiques pour évaluer la démyélinisation et la remyélinisation chez les souris cuprizone. Quelques méthodes de coloration couramment utilisées sont présentées ci-dessous.
Bleu rapide de Luxol (LFB)
Le Luxol Fast Blue (LFB) est une coloration histologique rapide utilisée pour donner un aperçu de la myélinisation dans les coupes de tissus. Il révèle efficacement les vides clairs où les trajets axonaux ont été démyélinisés et permet d'identifier l'étendue des lésions de la myéline. La méthode LFB implique une sur-coloration du tissu, suivie d'une différenciation dans du carbonate de lithium pour distinguer les zones myélinisées des zones démyélinisées. Les étapes de différenciation doivent être adaptées aux tissus spécifiques pour obtenir une coloration optimale. Cependant, ce processus peut générer une variabilité importante au niveau des lots, ce qui fait du LFB un mauvais candidat pour l'analyse quantitative.
FluoroMyelin™ et autres colorants fluorescents liant la myéline
Les colorants FluoroMyelin™ sont des colorants fluorescents disponibles dans le commerce qui ont une affinité sélective pour la myéline. Ces colorants ont été développés dans un certain nombre de couleurs fluorescentes différentes qui peuvent être utilisées pour visualiser la myéline en combinaison avec d'autres marqueurs dans les coupes de tissus cérébraux. De nombreux autres composés fluorescents ayant une affinité pour la myéline ont également été développés. Les inconvénients de ces composés fluorescents qui se lient à la myéline sont qu'ils ont tendance à générer une forte coloration de fond et qu'ils présentent un faible contraste de coloration et souvent une faible luminosité, ce qui rend leur utilisation difficile dans le cadre d'une coloration quantitative multiplex.
Coloration à l'argent
La coloration à l'argent est une technique très sensible utilisée pour visualiser les structures tissulaires, mais il s'agit d'une procédure laborieuse qui nécessite des temps de développement adaptés, ce qui entraîne une variabilité importante au niveau des lots. Bien qu'elle soit très sensible, la coloration à l'argent a une gamme dynamique très faible et a tendance à colorer d'autres structures protéiques, ce qui en fait un mauvais candidat pour l'analyse quantitative.
Bleu de toluidine
Le bleu de toluidine O est un colorant histologique anionique qui se lie à la myéline (entre autres structures) et permet une visualisation détaillée de la gaine de myéline. Il est souvent utilisé pour les nerfs périphériques et, bien que difficile, il peut être utilisé dans le SNC. La préparation des tissus est laborieuse, car le processus nécessite un enrobage de résine EPON, et il est plus efficace lorsqu'il s'agit de colorer des sections de tissus semi-minces (0,5-1 μm) enrobées de plastique. La visualisation de la myéline dans le corps calleux nécessite des dissections détaillées, car le processus est optimal dans les petits échantillons de tissus et les sections doivent être perpendiculaires aux axones pour visualiser efficacement les gaines de myéline. L'inconvénient de cette méthode est qu'elle prend du temps et qu'elle ne permet pas l'immunomarquage du même tissu. En outre, les colorations au bleu de toluidine O se lient à d'autres structures, ce qui rend crucial un échantillonnage minutieux des tissus.
Coloration immunohistochimique (IHC)
La coloration immunohistochimique de la myéline à l'aide de marqueurs tels que la protéine basique de la myéline (MBP), la protéine protéolipidique (PLP) et la glycoprotéine de l'oligodendrocyte de la myéline (MOG) sur des coupes de tissus est très efficace pour identifier la gaine de myéline associée aux processus oligodendrocytaires matures et aux corps cellulaires. Cette technique est excellente pour quantifier les niveaux de myéline et visualiser l'étendue des lésions de la myéline, mais elle n'est pas idéale pour dénombrer le nombre de cellules productrices de myéline.
La coloration immunohistochimique des marqueurs de la lignée oligodendrocytaire, tels que Olig2/Olig2, PDGF-α-Récepteur (PDGFRα) et NKX2.2, permet de mieux comprendre les étapes de la maturation et de la différenciation des cellules précurseurs d'oligodendrocytes (OPC). Ces marqueurs sont souvent localisés dans le noyau ou le corps cellulaire, ce qui les rend idéaux pour compter et suivre le nombre de cellules au cours du processus de maturation et de différenciation des CPO. Olig2 est un facteur de transcription essentiel à la prolifération et à la différenciation des oligodendrocytes. Il est exprimé dans le noyau des OPC et continue à l'être dans les oligodendrocytes matures. Le PDGFRα est un récepteur de surface cellulaire qui lie le facteur de croissance dérivé des plaquettes (PDGF). Il s'agit d'un marqueur des OPC précoces qui joue un rôle important dans leur prolifération et leur survie. L'expression du PDGFRα est généralement régulée à la baisse lorsque les CPO se différencient en oligodendrocytes matures. NKX2.2 est un facteur de transcription qui joue un rôle crucial dans la différenciation des OPC en oligodendrocytes matures. Il est exprimé dans le noyau et participe à la régulation des gènes nécessaires à la maturation des oligodendrocytes et à la myélinisation.
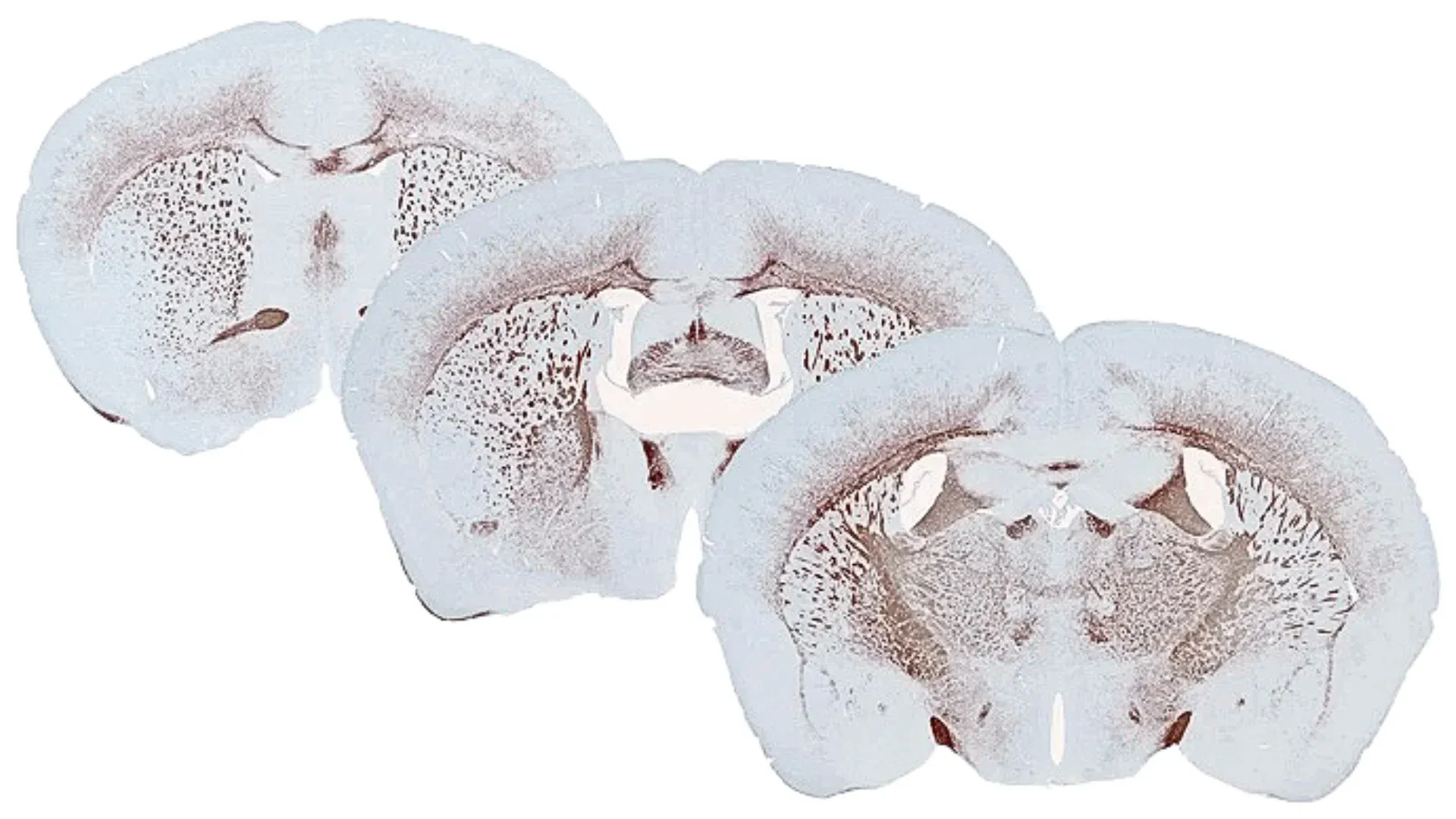
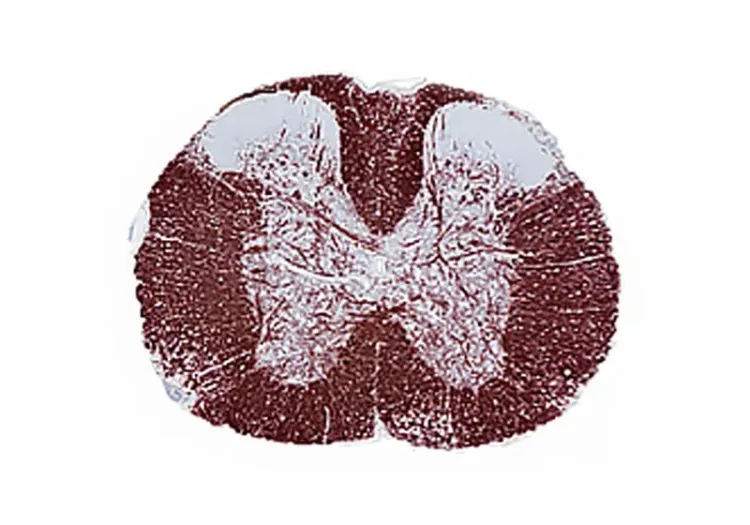
Coloration immunohistochimique de la protéine basique de la myéline (MBP) sur plusieurs coupes de tissus, mettant en évidence la démyélinisation de la ligne médiane du corps calleux chez une souris exposée à un régime à base de cuprizone pendant une période de cinq semaines.
Microscopie électronique (ME)
La microscopie électronique permet d'obtenir des images à très haute résolution d'échantillons de tissus, fournissant des détails exquis sur la structure et l'enveloppe de la myéline aux niveaux cellulaire et subcellulaire (Cruz-Martinez, 2016). Elle est utilisée pour déterminer le rapport g des axones myélinisés et constitue une excellente technique pour distinguer les axones myélinisés au cours du développement des axones remyélinisés. Cependant, elle n'échantillonne que de très petites régions du tissu et, dans le modèle de cuprizone, ne permet pas de comprendre l'étendue de la démyélinisation ou de la remyélinisation dans l'ensemble du corps calleux.
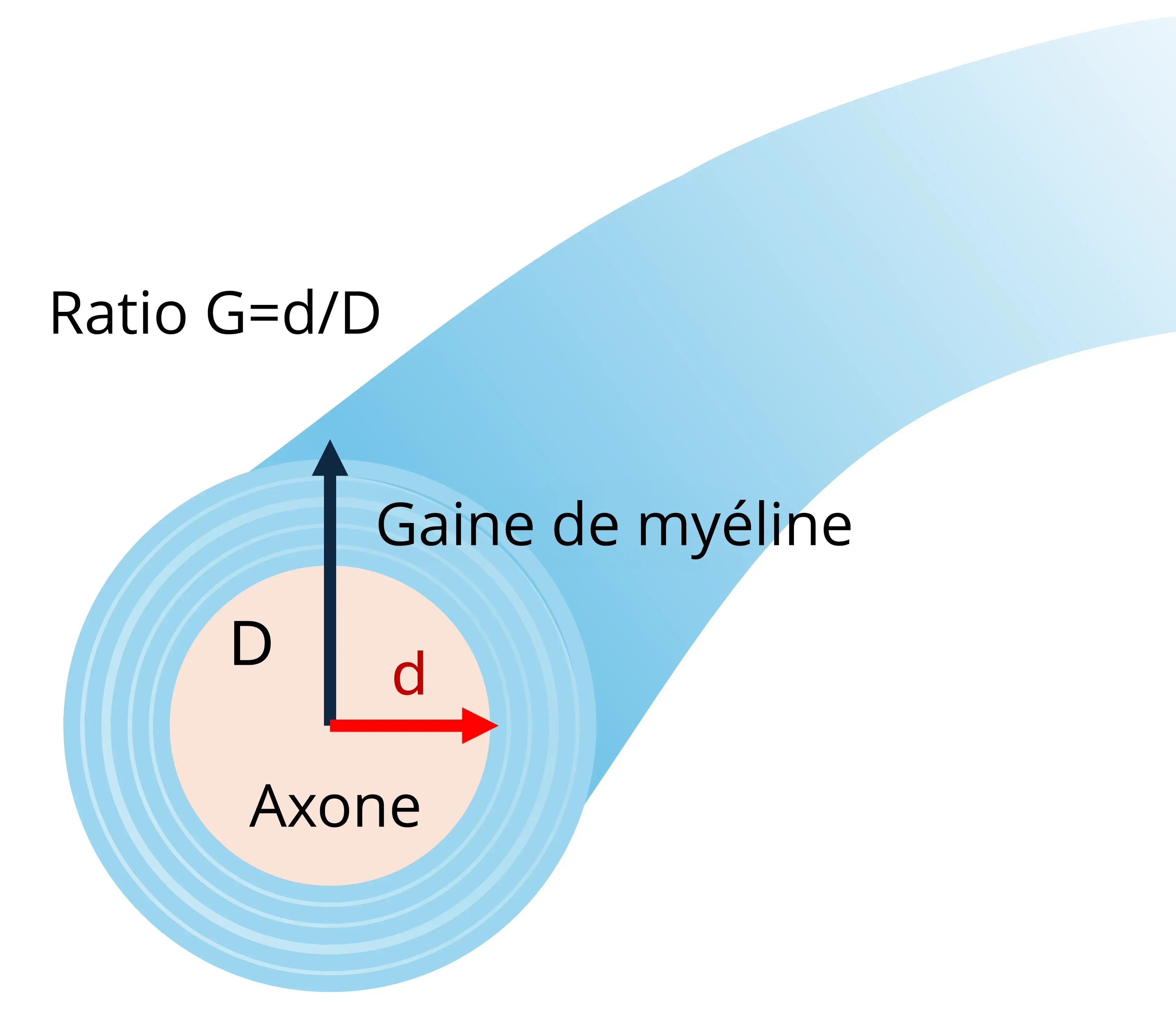
Illustration du calcul du ratio G
Imagerie in vivo
L'imagerie par résonance magnétique (IRM) préclinique et l'imagerie du tenseur de diffusion (ITD) permettent une évaluation structurelle en raison de la nature spécifique de la diffusion de l'eau dans les tissus. Les axones myélinisés présentent un signal DTI contraint et directionnel caractéristique (Wang, 2019). Ces techniques peuvent être utilisées pour des évaluations en cours de vie, donnant un aperçu de l'évolution des modifications de la myéline et sont entièrement transposables (c'est-à-dire des biomarqueurs translationnels) des études d'efficacité précliniques aux essais cliniques (Sommer, 2022).
Le rapport de transfert de magnétisation (MTR) (Tagge, 2016) est une autre technique d'IRM qui fournit des informations sur le contenu de la myéline en mesurant le transfert de magnétisation entre l'eau libre et l'eau liée aux macromolécules. Cette méthode, comme l'ITD, peut être utilisée pour évaluer la durée de vie d'une personne, ce qui permet d'obtenir des informations précieuses sur l'évolution des modifications de la myéline. La MTR est également transposable des études précliniques d'efficacité aux essais cliniques (Sommer, 2022).
Bien qu'il s'agisse d'outils puissants pour une évaluation non invasive, longitudinale et in vivo, l'IRM, le DTI et le MTR ne permettent pas une évaluation microscopique et peuvent être perturbés par l'œdème, bien que cette question ne soit pas une considération particulière pour le modèle cuprizone étant donné que l'œdème vasogénique ne joue pas un rôle prépondérant.
Quelles sont les considérations pratiques pour mesurer la démyélinisation et la remyélinisation dans les études précliniques d'efficacité thérapeutique?
Lors de l'utilisation du modèle cuprizone pour des études précliniques d'efficacité thérapeutique dans le cadre d'études de développement de médicaments, il est important de déterminer la fenêtre temporelle appropriée à la fois pour l'intervention et pour la lecture des points finaux. Le moment de l'intervention doit tenir compte de la pharmacocinétique de l'agent thérapeutique et du type de cellule ciblé.
Souvent, un effet thérapeutique modifie la vitesse de la démyélinisation et de la remyélinisation, alors qu'en fin de compte, le modèle se résout à un état final de remyélinisation très similaire. Le choix du moment le plus approprié pour l'évaluation des effets est donc également crucial. Étant donné que les processus de démyélinisation et de remyélinisation se déroulent sur des périodes différentes, il convient d'évaluer plusieurs points dans le temps afin de saisir la dynamique de ces processus.
Le choix d'une évaluation pathologique appropriée est essentiel pour obtenir une quantification objective et reproductible. Il est important de s'assurer que la préparation et la coupe des tissus permettent une localisation ciblée de la pathologie dans les régions du corps calleux les plus touchées, afin de pouvoir effectuer des comparaisons entre les groupes.
L'imagerie in vivo permet de mieux comprendre l'évolution et la résolution des lésions de démyélinisation et de remyélinisation. Des techniques telles que l'imagerie du tenseur de diffusion (DTI) et l'imagerie de transfert de magnétisation (MTR) permettent de mieux comprendre l'intégrité de la substance blanche. Les études longitudinales utilisant l'IRM permettent des mesures répétées chez le même animal, ce qui permet de suivre l'évolution de la maladie et les effets thérapeutiques.
Notre équipe se fera un plaisir de répondre à vos questions sur le modèle de souris Cuprizone ou de vous fournir des informations spécifiques sur les modèles de SP que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de SP
Contenu connexe
Informations actualisées sur la sclérose en plaques et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de la sclérose en plaques.
Lésions axonales dans l'encéphalomyélite auto-immune expérimentale (EAE)
Cette ressource décrit les méthodes disponibles pour mesurer les lésions axonales et la dégénérescence des axones, y compris les marqueurs tissulaires et les niveaux de chaîne légère des neurofilaments (NfL ; NF-L) dans le plasma et le LCR, dans le modèle EAE de la sclérose en plaques (SP).