銅ゾーン誘発性多発性硬化症の脱髄モデルとは何ですか?
多発性 硬化症(MS)は、中枢神経系(CNS)に影響を及ぼす慢性の自己免疫疾患で、世界中で280万人以上が罹患しています(Walton、2020年)。MSの研究では 、 リゾレシチン(LPC)マウスおよびラットモデルや 銅ゾンデーションマウスモデル などの脱髄モデルなど 、さまざまな前臨床モデルが使用され、 病気の さまざまな側面を再現しています (Dedoni, 2023)。
銅被覆食を与えたマウスの脳梁における脱髄の図解。 通常、髄鞘で覆われている脳梁が左側に、部分的に脱髄した白質が右側に示されています。
銅ゾーンモデル は、広く使用されている毒素誘発性多発性硬化症モデルです(Kipp, 2024; Zhan, 2020)。銅ゾーン (C14H22N4O2)または シュウ酸ビス[シクロヘキシリデンヒドラジド] は 、経口投与すると 、 齧歯類の脳の 特定の白質束における 成熟オリゴデンドロサイトの死と それに続く 脱髄 を誘発する銅キレート剤です (Dedoni, 2023)。このモデルでは脳内の自然免疫細胞が活性化されますが、TおよびBリンパ球は中心的な役割を果たさないため (Wolf,2018)、 実験的自己免疫性脳脊髄炎(EAE)、タイラー脳症ウイルス(TMEV )、および その他のMSのウイルスモデル などの 適応免疫系が関与する他のMSモデルとは区別されます (Dedoni, 2023)。銅ゾル誘発性脱髄はリンパ球に依存しておらず、リンパ球欠損組み換え活性化遺伝子(Rag)ノックアウトマウスでも起こります(Hiremath, 2008)。
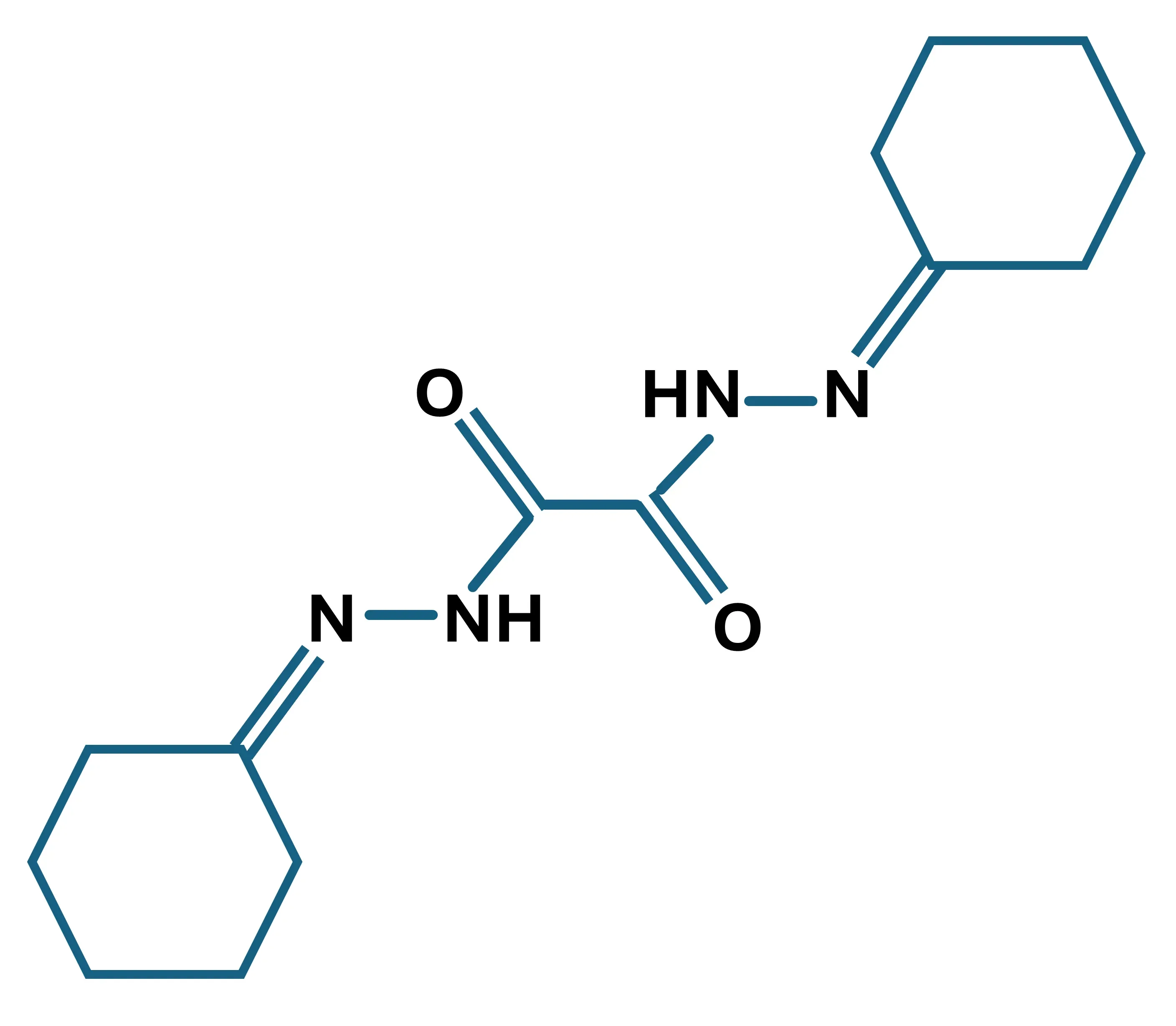
銅ゾーンの分子構造;C14H22N4O2; 分子量:278.45 g/mol
銅ゾーンモデルにより、研究者はMSの進行における特定のメカニズムを分析し、調査することができます 。 このげっ歯類モデルは2つの段階に分けることができます。 ( 1) 脳梁や小脳上核、大脳皮質などの脳領域における初期の脱髄(Vega-Riquer, 2019)で、これは先天性免疫系の活性化を伴います。 (2) 銅ゾーンの投与を中止すると、露出した軸索の再ミエリン化が大幅に進行します(Gharagozloo, 2022)。
実際には、マウスに5~6週間、銅ゾーンを投与します。このアプローチにより、選択的にオリゴデンドロサイトがストレスを受け死滅し、特定の脳領域で急性の脱髄、広範囲にわたるミクログリアの活性化とアストロサイトの増殖、軸索輸送メカニズムの崩壊(Rühling, 2019)、さらに慢性のモデルでは明らかな軸索損傷(Lindner, 2009)が引き起こされます。オリゴデンドロサイトの変性の正確なメカニズムは完全には解明されていませんが、銅欠乏症を誘発するクプリゾンの影響によるミトコンドリアの崩壊、フェロトーシス(Jhelum, 2020)、小胞体ストレス応答などが原因として考えられます。
銅ゾーンの影響のタイムラインは十分に文書化されています。初期段階では、治療開始後1週間以内に、治療開始後2日目には早くも乏突起膠細胞の死が観察されます。アストロサイトの早期活性化(Kipp, 2023)とミクログリアの早期活性化(Gudi, 2014)が起こり、成熟オリゴデンドロサイトの急速な損失が続きます。2日目までに約65%、1週間後には80%が失われます(Kipp, 2023)。1~3週間にわたる中間期には、オリゴデンドロサイトの損失とグリア細胞の活性化が続き、脱髄と急性軸索損傷の兆候が明らかになります(Crawford, 2009;Kipp, 2023)。
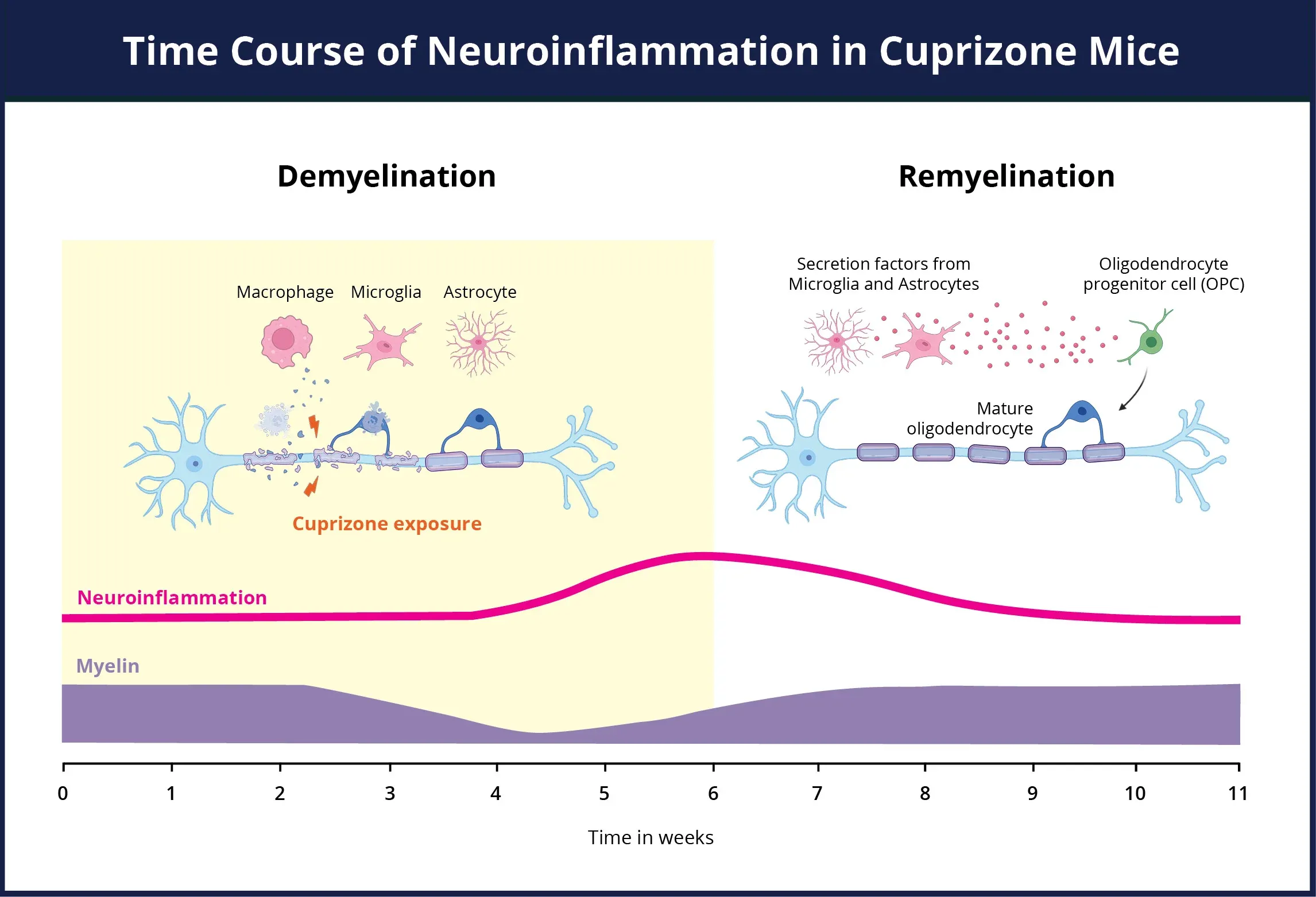
銅被覆モデルにおける神経炎症の経過の概要。銅被覆暴露期間中、ミエリン(紫色)の損失と、活性化ミクログリアおよび反応性アストロサイトの劇的な増加(ピンク色)が同時に起こり、神経炎症状態を引き起こします。アストロサイトとミクログリアは、ミエリン残骸の除去とオリゴデンドロサイト前駆体の活性化にともに重要な役割を果たします。銅ゾルによる障害が 除去 され、軸索の再ミエリン化が起こると、神経炎症は治まります。
クリックしてリンクをコピー
3~5週間後には脱髄が目に見えるようになり、OPCが活性化され、失われたオリゴデンドロサイトを補うために動員されます(Brousse, 2015)。運動協調障害や行動障害、主に空間記憶や社会行動の障害が明らかになります(Franco-Pons, 2007)。この段階で、銅ゾル含有食を標準食に置き換えると、脱髄プロセスが停止し、再ミエリン化が起こります。
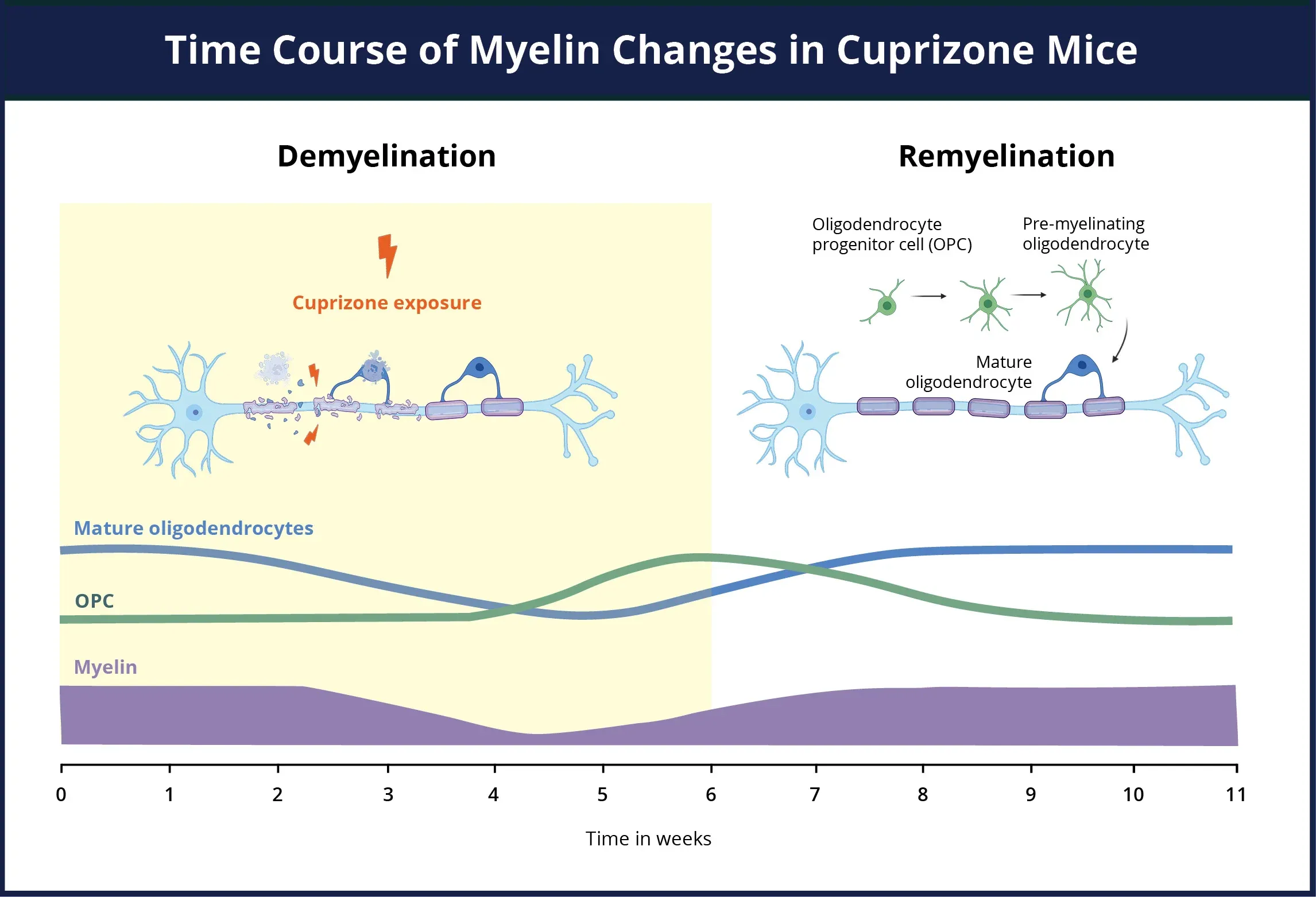
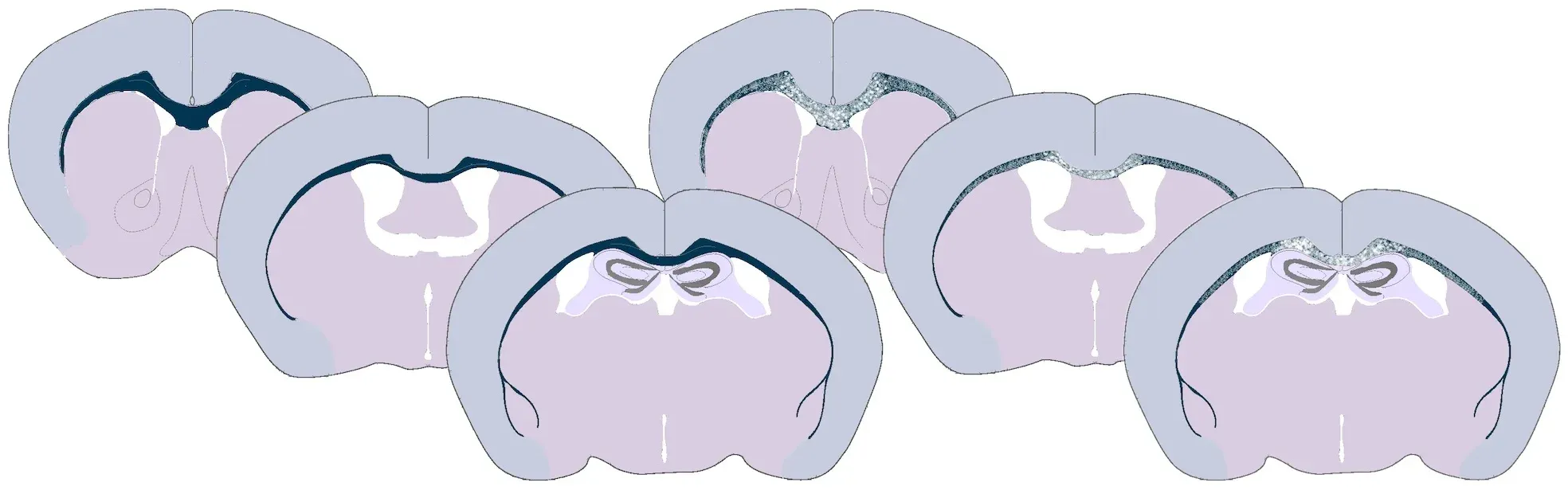
銅ゾーンモデルにおける脱髄と再ミエリン化のタイムラインの概要。銅ゾーンに暴露されている期間には、ミエリン(紫色)の損失、成熟オリゴデンドロサイト(青色)の死滅、およびオリゴデンドロサイト前駆細胞(緑色)の劇的な増殖と分化による前ミエリン化オリゴデンドロサイト前駆細胞(OPC)への変化が同時に起こります。OPCは、銅イオンが存在する間も、組織損傷部位で移動し分化します。銅イオンの障害が取り除かれると、OPCは成熟したオリゴデンドロサイトに急速に分化し、露出した軸索の再ミエリン化を開始します。
クリックしてリンクをコピー
治療が12週間以上長引くと、脱髄が慢性化し、OPC細胞が枯渇し、再ミエリン化の可能性が大幅に低下する可能性があります(Lindner、2009年)。多くの研究により、銅ゾーンへの長期暴露は、限定的な内因性再ミエリン化能力を示す慢性病変(Leo, 2022)、長期にわたるアストログリア症(Hibbits, 2012)、より広範囲にわたる軸索損傷(Lindner, 2009)を誘発することが示されています。まとめると、MS研究において、銅ゾルモデルは、特にオリゴデンドロサイトの変性とそれに伴う脱髄というMSの重要な側面を再現する重要なツールです。銅ゾルによる損傷の時間経過とメカニズムを理解することは、MSの治療介入を目的とした開発に不可欠です。
銅線マウスにおける脱髄および再ミエリン化の評価に最もよく用いられる方法はどのようなものですか?
脱髄および再ミエリン化のプロセスを効果的に研究し理解するためには、中枢神経系(CNS)内のミエリンおよび脱髄および再ミエリン化のプロセスを検出するための信頼性の高い技術を採用することが極めて重要です。実験組織におけるミエリンの可視化は、組織学的および免疫組織化学(IHC)技術によって行うことができます。ミエリン鞘の超 微 細構造分析は電子顕微鏡(EM)で可視化でき、高解像度の画像を提供します 。 また、磁気共鳴画像法(MRI)などの 高度な非侵襲的 in vivo 画像化技術は、進行中のプロセスに関する洞察を提供することができます。 これらの技術はそれぞれミエリン関連疾患のより深い理解を促進することができますが、以下に概説するように、それぞれ長所と短所があります 。
組織学的染色
銅ゾーンマウスにおける脱髄および再ミエリン化の評価には、さまざまな組織化学的技術が利用可能です。以下に、一般的に使用される染色法をいくつか紹介します。
Luxol Fast Blue (LFB)
Luxol Fast Blue(LFB)は、組織切片におけるミエリン化に関する情報を得るために使用される迅速な組織学的染色法です。軸索の髄鞘が脱髄された部分を明確に示し、ミエリンの損傷範囲を特定するのに役立ちます。LFB法では、組織を過剰に染色し、続いてリチウム炭酸塩で分化させることで、ミエリン化および脱ミエリン化された領域を区別します。 最適な染色を行うには、特定の組織に合わせて分化ステップを調整する必要があります。 しかし、このプロセスはバッチごとに大きなばらつきが生じる可能性があり、LFB法は定量分析には適していません。
フルオロマイリン®およびその他のミエリン結合蛍光染色
FluoroMyelin® 染色は、ミエリンに選択的な親和性を持つ市販の蛍光色素です。 この色素は、脳組織切片内の他のマーカーと組み合わせてミエリンを可視化するために使用できる、さまざまな異なる蛍光色で開発されています。ミエリンに親和性を持つ他の蛍光化合物も数多く開発されています。これらの蛍光ミエリン結合化合物の欠点としては、強い背景染色が生じやすいこと、染色コントラストが低く、輝度も低いことが多く、そのため定量的多重染色での使用が難しいことが挙げられます。
銀染色
銀染色は組織構造の視覚化に用いられる非常に感度の高い技術ですが、処理時間が必要な手間のかかる手順であるため、バッチごとのばらつきが大きくなります。銀染色は感度が高いものの、ダイナミックレンジが非常に狭く、さまざまなタンパク質構造を染色する傾向があるため、定量的分析には適していません。
トルイジンブルー
トルイジンブルーOは、ミエリン(およびその他の構造)に結合する陰イオン性組織染色剤であり、ミエリンの包み込みを詳細に可視化することができます。末梢神経の染色によく使用され、困難ではありますが、中枢神経系でも使用できます。EPON樹脂包埋を必要とするため、組織の準備には手間がかかりますが、プラスチック包埋した半薄切片(0.5-1μm)を染色する場合には最も効果的です。視覚化には、脳梁内のミエリンの可視化には、詳細な解剖が必要であり、このプロセスは小規模な組織サンプルに最適であり、ミエリン鞘を効果的に可視化するには軸索に対して切片を垂直にしなければなりません。この方法の欠点は、時間がかかり、同じ組織の免疫染色ができないことです。さらに、トルイジンブルーO染色は他の構造物にも結合するため、慎重な組織サンプリングが不可欠です。
免疫組織化学(IHC)染色
ミエリン塩基性タンパク質(MBP)、プロテオリピドタンパク質(PLP)、ミエリンオリゴデンドロサイト糖タンパク質(MOG)などのマーカーを使用した組織切片の免疫組織化学的染色は、成熟したオリゴデンドロサイトのプロセスや細胞体に関連するミエリン鞘を特定するのに非常に有効です。 この 技術は、ミエリンの量を定量化し、ミエリンの損傷の程度を視覚化するには優れていますが、ミエリンを産生する細胞の数を数えるには適していません。
Olig2、PDGF-α受容体(PDGFRα)、NKX2.2などのオリゴデンドロサイト系列マーカーに対する免疫組織化学的染色は、オリゴデンドロサイト前駆細胞(OPC)の成熟および分化段階に関する重要な洞察を提供します。これらのマーカーは核または細胞体に局在することが多いため、OPCの成熟および分化過程における細胞数のカウントや追跡に最適です。Olig2は、オリゴデンドロサイトの増殖と分化に重要な役割を果たす転写因子です。 OPCの核で発現し、成熟したオリゴデンドロサイトでも発現が持続します。 PDGFRαは、血小板由来増殖因子(PDGF)と結合する細胞表面受容体です。 初期のOPCのマーカーであり、OPCの増殖と生存に重要です。PDGFRαの発現は、OPCが成熟したオリゴデンドロサイトへと分化するにつれて、通常はダウンレギュレートされます。NKX2.2は、OPCが成熟したオリゴデンドロサイトへと分化する際に重要な役割を果たす転写因子です。核内で発現し、オリゴデンドロサイトの成熟とミエリン化に必要な遺伝子の制御に関与しています。
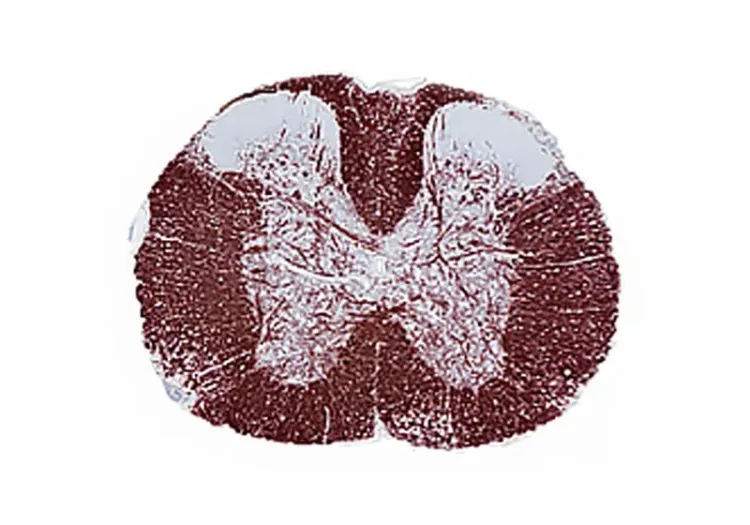
5週間銅ゾン食を与えたマウスの脳梁正中線上の脱髄を強調した 、複数の組織切片におけるミエリン塩基性タンパク(MBP)に対する免疫組織化学染色 。
電子顕微鏡 (EM)
電子顕微鏡 は組織サンプルの超高 解像度画像を提供し、細胞レベルおよび細胞レベル以下のミエリン構造と包み込みの精緻な詳細を提供します(Cruz-Martinez, 2016)。これは 、ミエリン化軸索の g 比率を決定するために用いられ、 発達中のミエリン化軸索と再ミエリン化軸索を区別する優れた技術です。しかし、 組織のごく一部の 領域しかサンプリングしない ため 、銅ゾーンモデルでは 、 脳梁全体の 脱髄または再髄鞘化の程度 を把握することはできません。
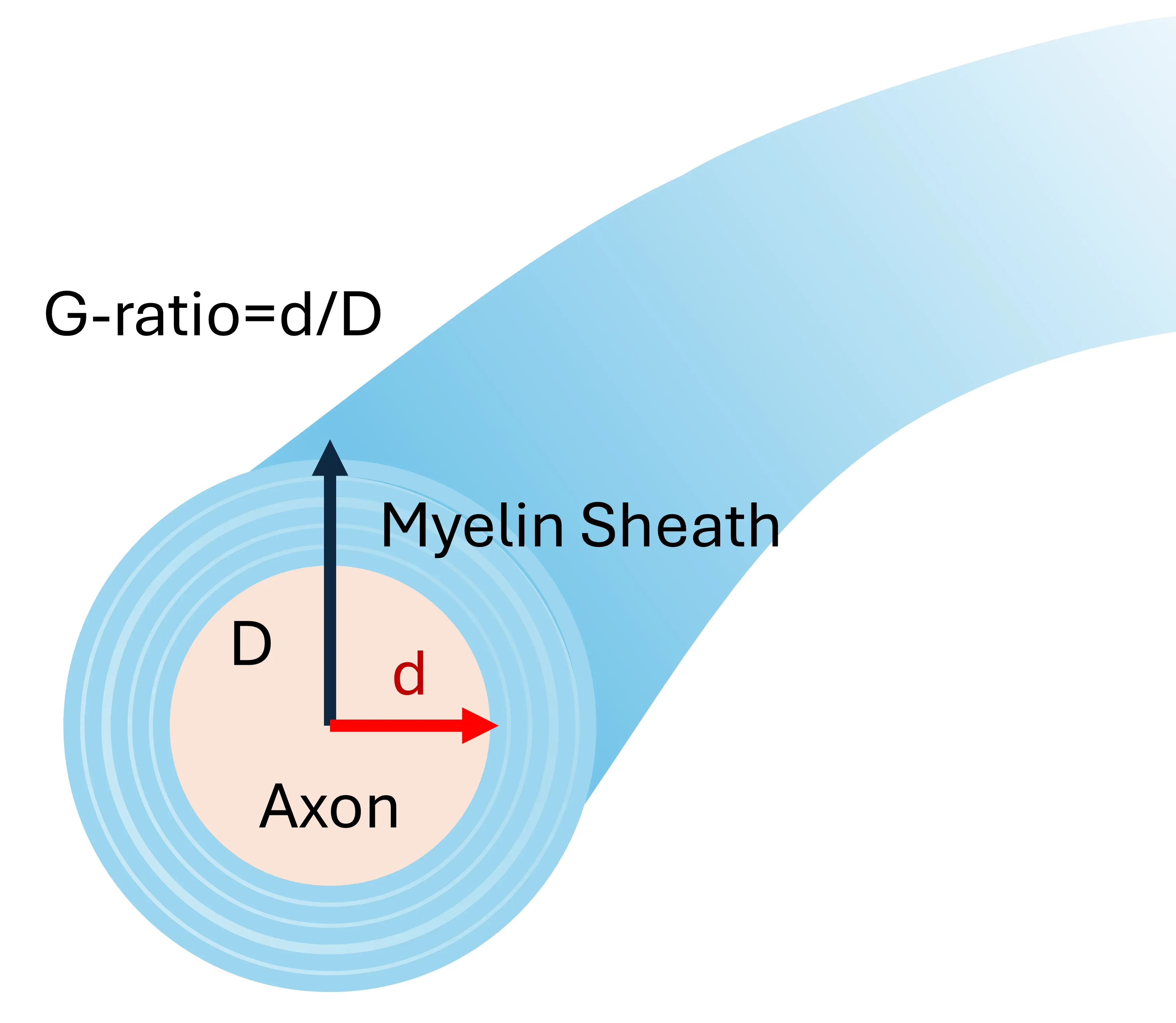
g-ratioの計算の例
インビボイメージング
臨床前段階の磁気共鳴画像法(MRI) および拡散テンソル画像法(DTI)は、水の拡散が組織特異的な性質を持つことを利用して、構造評価を可能にします 。 ミエリンで覆われた軸索は、特徴的な制限された方向性のDTI信号を示します(Wang, 2019)。これらの技術は、生体内評価として実施することができ、ミエリン変化の進化に関する洞察を提供し、前臨床効果研究から臨床試験への完全な転換(すなわち、転換 バイオマーカー)が可能です(Sommer, 2022)。
磁化率(MTR)(Tagge, 2016)は、自由水と高分子結合水間の磁化率の移動を測定することでミエリン含有量に関する洞察を提供する、もう一つのMRI技術です。 この方法はDTIと同様に、インライフ評価として実施でき、ミエリン変化の進化に関する貴重な情報を提供します。 MTRもまた、前臨床有効性研究から臨床試験へと移行できます(Sommer, 2022)。
非侵襲的で経時的な 生体内評価のための強力なツールであるMRI、DTI、MTRは、顕微鏡的評価はできず、浮腫の影響を受ける可能性がありますが、血管原性浮腫が重要な役割を果たさないことから、この問題はカプリゾンモデルでは特に考慮する必要はありません。
前臨床治療効果研究における脱髄および再ミエリン化の測定に関する実際的な考慮事項は何ですか?
医薬品開発研究の一環として、前臨床治療効果研究に銅ゾーンモデルを利用する際の 重要な 考慮事項には、介入とエンドポイントの読み取りの両方について適切な時間枠を決定することが含まれます。介入のタイミングは、治療薬の薬物動態(PK)と標的細胞の種類を考慮する必要があります 。
多くの場合 、治療効果により脱髄と再ミエリン化の速度が変化しますが、最終的にはモデルは非常に類似した最終的な再ミエリン化状態に落ち着きます。そのため、エンドポイント評価のタイミングを最も適切に選択することも極めて重要です。脱髄と再ミエリン化のプロセスは異なる時間枠で起こるため、これらのプロセスの動態を捉えるには、複数の時点を評価する必要があります 。
客観的かつ再現可能な定量化を行うためには、適切な病理学的評価 を行う ことが不可欠です。組織の準備と切片化により、最も影響を受けている脳梁の領域に病理学的変化を正確に局在させることが、グループ間比較を行う上で重要です 。
脱髄および再ミエリン化病変の進化と分解に対する洞察を 最大限 に深めるには、 生体イメージング を利用することが有効です 。 拡散テンソル画像(DTI)や磁化率転移画像(MTR)などの技術は、白質完全性に対する洞察を提供します。MRIを用いた縦断的研究では、同一の動物に対して繰り返し測定を行うことができるため、疾患の進行と治療効果の追跡が可能になります 。
当社のチームは、Cuprizone Mouse Modelに関するご質問や、治療効果研究で使用しているMSモデルに関する特定の情報提供など、どのようなご質問にも喜んでお答えいたします。
MSモデルについてもっと知ろう
関連コンテンツ
多発性硬化症に関する最新情報と、MS動物モデルにおける治療薬の評価に関するベストプラクティス。
実験的自己免疫性脳脊髄炎(EAE)および軸索損傷
この資料では、多発性硬化症(MS)のEAEモデルにおける軸索損傷および軸索変性の測定方法について説明しています。組織マーカーや血漿およびCSF中のニューロフィラメント軽鎖(NfL;NF-L)レベルなど、利用可能な測定方法を説明しています。