Bai, X., Wey, M. C.-Y., Fernandez, E., Hart, M. J., Gelfond, J., Bokov, A. F., Rani, S., & Strong, R. Rapamycin improves motor function, reduces 4-hydroxynonenal adducted protein in brain, and attenuates synaptic injury in a mouse model of synucleinopathy. Pathobiol. Aging Age-Relat. Dis., 5: 28743, 2015; doi: 10.3402/pba.v5.28743
Brunialti, E., Rizzi, N., Pinto-Costa, R., Villa, A., Panzeri, A., Meda, C., Rebecchi, M., Di Monte, D. A., & Ciana, P. Design and validation of a reporter mouse to study the dynamic regulation of TFEB and TFE3 activity through in vivo imaging techniques. Autophagy, 20: 1879–1894, 2024; doi: 10.1080/15548627.2024.2334111
Chauhan, S., Ahmed, Z., Bradfute, S. B., Arko-Mensah, J., Mandell, M. A., Won Choi, S., Kimura, T., Blanchet, F., Waller, A., Mudd, M. H., Jiang, S., Sklar, L., Timmins, G. S., Maphis, N., Bhaskar, K., Piguet, V., & Deretic, V. Pharmaceutical screen identifies novel target processes for activation of autophagy with a broad translational potential. Nat. Commun., 6: 8620, 2015; doi: 10.1038/ncomms9620
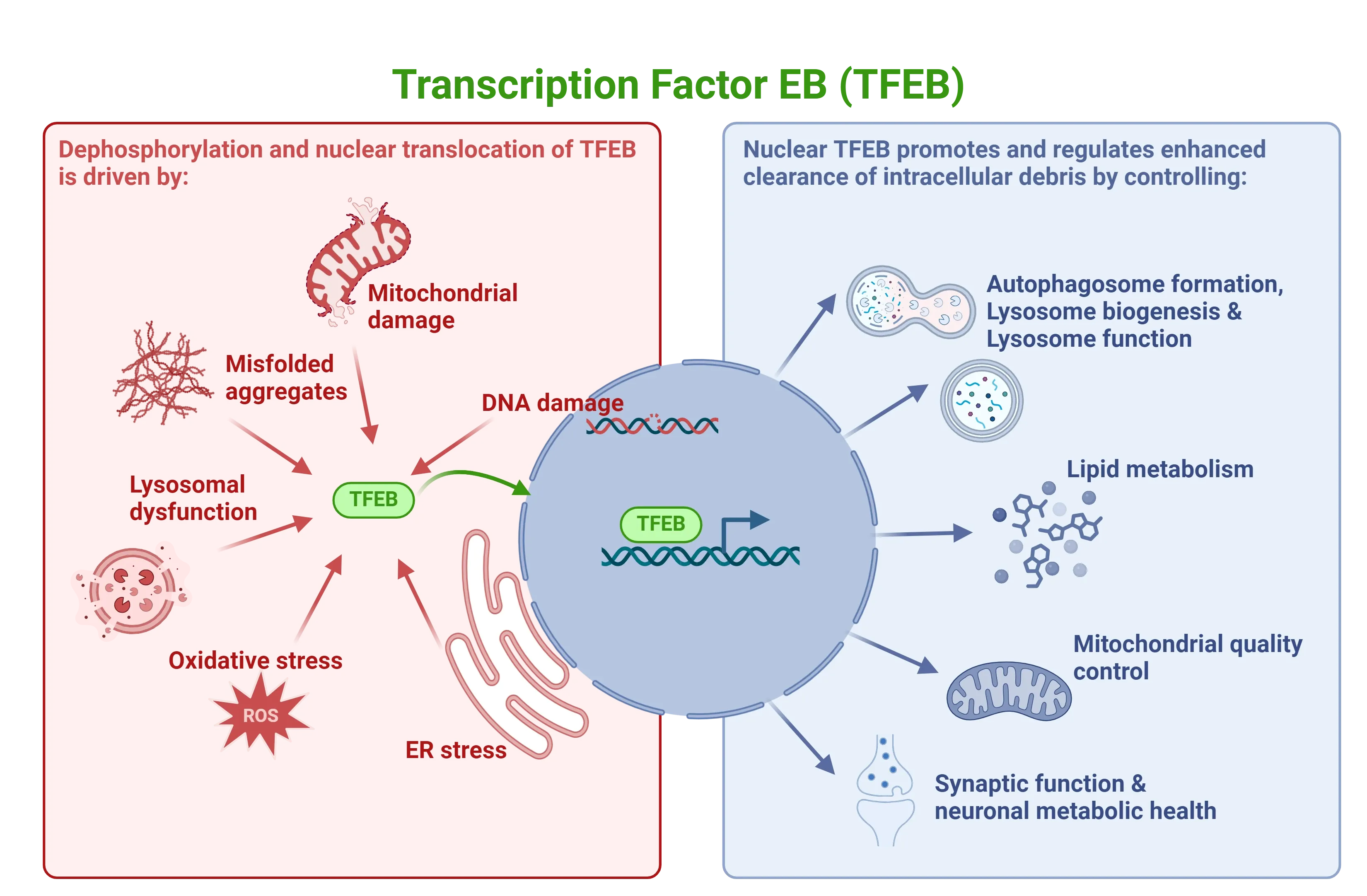
Chen, H., Gong, S., Zhang, H., Chen, Y., Liu, Y., Hao, J., Liu, H., & Li, X. From the regulatory mechanism of TFEB to its therapeutic implications. Cell Death Discov., 10: 1–11, 2024; doi: 10.1038/s41420-024-01850-6
Chun, Y. S., Kim, M.-Y., Lee, S.-Y., Kim, M. J., Hong, T.-J., Jeon, J. K., Ganbat, D., Kim, H. T., Kim, S. S., Kam, T.-I., & Han, S. MEK1/2 inhibition rescues neurodegeneration by TFEB-mediated activation of autophagic lysosomal function in a model of Alzheimer’s disease. Mol. Psychiatry, 27: 4770–4780, 2022; doi: 10.1038/s41380-022-01713-5
Corà, D., Bussolino, F., & Doronzo, G. TFEB signalling-related microRNAs and autophagy. Biomolecules, 11: 985, 2021; doi: 10.3390/biom11070985
Cortes, C. J., & La Spada, A. R. TFEB dysregulation as a driver of autophagy dysfunction in neurodegenerative disease: Molecular mechanisms, cellular processes, and emerging therapeutic opportunities. Neurobiol. Dis., 122: 83–93, 2019; doi: 10.1016/j.nbd.2018.05.012
Decressac, M., Mattsson, B., Weikop, P., Lundblad, M., Jakobsson, J., & Björklund, A. TFEB-mediated autophagy rescues midbrain dopamine neurons from α-synuclein toxicity. Proc. Natl. Acad. Sci. USA, 110: E1817–E1826, 2013; doi: 10.1073/pnas.1305623110
Deng, Z., Purtell, K., Lachance, V., Wold, M. S., Chen, S., & Yue, Z. Autophagy receptors and neurodegenerative diseases. Trends Cell Biol., 27: 491–504, 2017; doi: 10.1016/j.tcb.2017.01.001
Franco-Juárez, B., Coronel-Cruz, C., Hernández-Ochoa, B., Gómez-Manzo, S., Cárdenas-Rodríguez, N., Arreguin-Espinosa, R., Bandala, C., Canseco-Ávila, L. M., & Ortega-Cuellar, D. TFEB: Beyond its role as an autophagy and lysosome regulator. Cells, 11: 3153, 2022; doi: 10.3390/cells11193153
Gebrie, A. Transcription factor EB as a key molecular factor in human health and its implication in diseases. SAGE Open Med., 11: 20503121231157210, 2023; doi: 10.1177/20503121231157209
Gu, Z., Cao, H., Zuo, C., Huang, Y., Miao, J., Song, Y., Yang, Y., Zhu, L., & Wang, F. TFEB in Alzheimer’s disease: From molecular mechanisms to therapeutic implications. Neurobiol. Dis., 173: 105855, 2022; doi: 10.1016/j.nbd.2022.105855
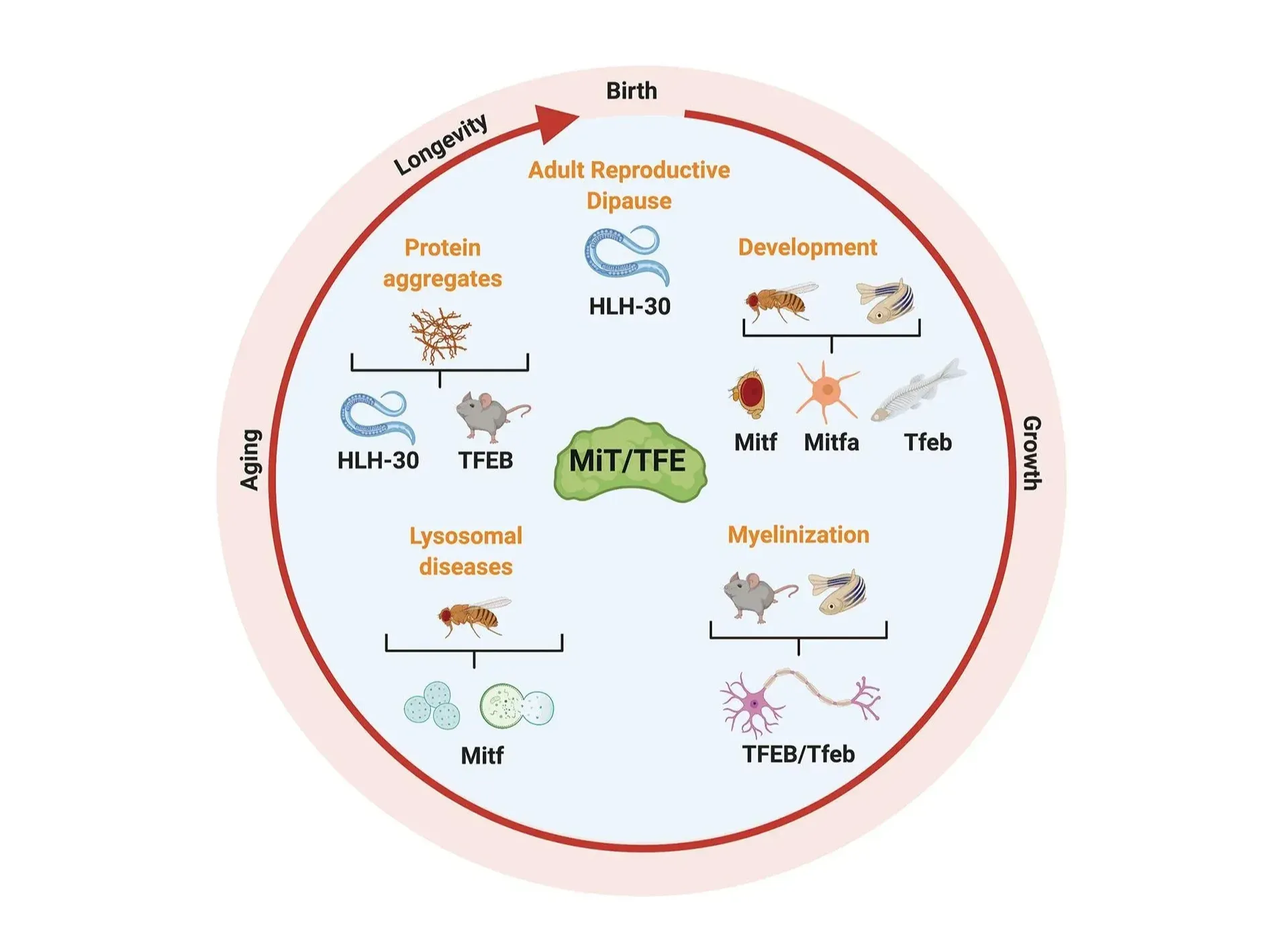
La Spina, M., Contreras, P.S., Rissone, A., Meena, N.K., Jeong, E., Martina, J.A. MiT/TFE family of transcription factors: an evolutionary perspective. Front. Cell Dev. Biol., 8: 1-9, 2021; doi: 10.3389/fcell.2020.609683
Martini-Stoica, H., Xu, Y., Ballabio, A., & Zheng, H. The autophagy–lysosomal pathway in neurodegeneration: A TFEB perspective. Trends Neurosci., 39: 221–234, 2016; doi: 10.1016/j.tins.2016.02.002
Matthews, I., Birnbaum, A., Gromova, A., Huang, A.W., Liu, K., Liu, E.A., Coutinho, K., McGraw, M., Patterson, D.C., Banks, M.T., Nobles, A.C., Nguyen, N., Merrihew, G.E., Wang, L., Baeuerle, E., Fernandez, E., Musi, N., MacCoss, M.J., Miranda, H.C., Cortes, C.J. Skeletal muscle TFEB signaling promotes central nervous system function and reduces neuroinflammation during aging and neurodegenerative disease. Cell Rep., 42: 113436, 2023; doi: 10.1016/j.celrep.2023.113436
Menzies, F. M., Fleming, A., Caricasole, A., Bento, C. F., Andrews, S. P., Ashkenazi, A., Füllgrabe, J., Jackson, A., Sanchez, M. J., Karabiyik, C., Licitra, F., Ramirez, A. L., Pavel, M., Puri, C., Renna, M., Ricketts, T., Schlotawa, L., Vicinanza, M., Won, H., … Rubinsztein, D. C. Autophagy and neurodegeneration: Pathogenic mechanisms and therapeutic opportunities. Neuron, 93: 1015–1034, 2017; doi: 10.1016/j.neuron.2017.01.022
Nah, J., Yuan, J., & Jung, Y.-K. Autophagy in neurodegenerative diseases: From mechanism to therapeutic approach. Mol. Cells, 38: 381–389, 2015; doi: 10.14348/molcells.2015.0034
Napolitano, G., & Ballabio, A. TFEB at a glance. J. Cell Sci., 129: 2475–2481, 2016; doi: 10.1242/jcs.146365
Oksuz, O., Henninger, J.E., Warneford-Thomson, R., Zheng, M.M., Erb, H., Vancura, A., Overholt, K.J., Hawken, S.W., Banani, S.F., Lauman, R., Reich, L.N., Robertson, A.L., Hannett, N.M., Lee, T.I., Zon, L.I., Bonasio, R., Young, R.A. Transcription factors interact with RNA to regulate genes. Mol. Cell, 83: 2449-2463.e13, 2023; doi: 10.1016/j.molcel.2023.06.012
Nezich, C. L., Wang, C., Fogel, A. I., & Youle, R. J. MiT/TFE transcription factors are activated during mitophagy downstream of Parkin and Atg5. J. Cell Biol., 210: 435–450, 2015; doi: 10.1083/jcb.201501002
Palmieri, M., Impey, S., Kang, H., di Ronza, A., Pelz, C., Sardiello, M., Ballabio, A. Characterization of the CLEAR network reveals an integrated control of cellular clearance pathways. Hum. Mol. Genet., 20: 3852-3866, 2011; doi: 10.1093/hmg/ddr306
Polito, V.A., Li, H., Martini-Stoica, H., Wang, B., Yang, L., Xu, Y., Swartzlander, D.B., Palmieri, M., di Ronza, A., Lee, V.M., Sardiello, M., Ballabio, A., Zheng, H. Selective clearance of aberrant tau proteins and rescue of neurotoxicity by transcription factor EB. EMBO Mol. Med., 6: 1142-1160, 2014; doi: 10.15252/emmm.201303671
Reddy, K., Cusack, C. L., Nnah, I. C., Khayati, K., Saqcena, C., Huynh, T. B., Noggle, S. A., Ballabio, A., & Dobrowolski, R. Dysregulation of nutrient sensing and CLEARance in presenilin deficiency. Cell Rep., 14: 2166–2179, 2016; doi: 10.1016/j.celrep.2016.02.006
Sardiello, M., Palmieri, M., di Ronza, A., Medina, D.L., Valenza, M., Gennarino, V.A., Malta, C.D., Donaudy, F., Embrione, V., Polishchuk, R.S., Banfi, S., Parenti, G., Cattaneo, E., Ballabio, A. A gene network regulating lysosomal biogenesis and function. Science, 325: 473-477, 2009; doi: 10.1126/science.1174447
Settembre, C., Malta, C.D., Polito, V.A., Arencibia, M.G., Vetrini, F., Erdin, S., Erdin, S.U., Huynh, T., Medina, D., Colella, P., Sardiello, M., Rubinsztein, D.C., Ballabio, A. TFEB links autophagy to lysosomal biogenesis. Science, 332: 1429-1433, 2011; doi: 10.1126/science.1204592
Song, J.-X., Liu, J., Jiang, Y., Wang, Z.-Y., Li, M. Transcription factor EB: an emerging drug target for neurodegenerative disorders. Drug Discov. Today, 26: 164-172, 2021; doi: 10.1016/j.drudis.2020.10.013
Song, T.-T., Cai, R.-S., Hu, R., Xu, Y.-S., Qi, B.-N., Xiong, Y.-A. The important role of TFEB in autophagy-lysosomal pathway and autophagy-related diseases: a systematic review. Eur. Rev. Med. Pharmacol. Sci., 25: 1641-1649, 2021; doi: 10.26355/eurrev_202102_24875
Tiribuzi, R., Crispoltoni, L., Porcellati, S., Di Lullo, M., Florenzano, F., Pirro, M., Bagaglia, F., Kawarai, T., Zampolini, M., Orlacchio, A., & Orlacchio, A. miR128 up-regulation correlates with impaired amyloid β(1-42) degradation in monocytes from patients with sporadic Alzheimer’s disease. Neurobiol. Aging, 35: 345–356, 2014; doi: 10.1016/j.neurobiolaging.2013.08.003
Tsunemi, T., Ashe, T. D., Morrison, B. E., Soriano, K. R., Au, J., Roque, R. A. V., Lazarowski, E. R., Damian, V. A., Masliah, E., & La Spada, A. R. PGC-1α rescues Huntington’s disease proteotoxicity by preventing oxidative stress and promoting TFEB function. Sci. Transl. Med., 4: 142ra97-142ra97, 2012; doi: 10.1126/scitranslmed.3003799
Vodicka, P., Chase, K., Iuliano, M., Tousley, A., Valentine, D. T., Sapp, E., Kegel-Gleason, K. B., Sena-Esteves, M., Aronin, N., & DiFiglia, M. Autophagy activation by transcription factor EB (TFEB) in striatum of HD Q175/Q7 mice. J. Huntington’s Dis., 5: 249–260, 2016; doi: 10.3233/JHD-160211
Wang, G., Wang, F., Huang, Q., Li, Y., Liu, Y., & Wang, Y. Understanding transcription factor regulation by integrating gene expression and DNase I hypersensitive sites. Biomed. Res. Int., 2015: 757530, 2015; doi: 10.1155/2015/757530
Wang, S., Chen, Y., Li, X., Zhang, W., Liu, Z., Wu, M., Pan, Q., & Liu, H. Emerging role of transcription factor EB in mitochondrial quality control. Biomed. Pharmacother., 128: 110272, 2020; doi: 10.1016/j.biopha.2020.110272
Wang, S., Ni, H.-M., Chao, X., Wang, H., Bridges, B., Kumer, S., Schmitt, T., Mareninova, O., Gukovskaya, A., De Lisle, R. C., Ballabio, A., Pacher, P., & Ding, W.-X. Impaired TFEB-mediated lysosomal biogenesis promotes the development of pancreatitis in mice and is associated with human pancreatitis. Autophagy, 15: 1954–1969, 2019; doi: 10.1080/15548627.2019.1596486
Young, P.R., DeDuck, K., Bedell, B.J. AIT-101 improves functional deficits in a human TDP-43 animal model of ALS. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration, 24(sup1): 129, 2023; doi: 10.1080/21678421.2023.2260194
Zhang, W., Li, X., Wang, S., Chen, Y., & Liu, H. Regulation of TFEB activity and its potential as a therapeutic target against kidney diseases. Cell Death Discov., 6: 1–10, 2020; doi: 10.1038/s41420-020-0265-4