小胶质细胞自噬是什么?
小胶质细胞是中枢神经系统(CNS)的驻留免疫细胞,对维持脑内稳态至关重要。这些高度动态的细胞有助于调节血脑屏障(BBB)、修剪突触并协调免疫反应。通过持续监测其微环境,小胶质细胞可识别并清除病原体、细胞碎片及蛋白质聚集物,这一过程常通过受体介导,例如 Toll样受体(TLRs)。
当神经毒性蛋白质聚集物积累时,它们会刺激释放促炎细胞因子,如白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)。这种情况会形成一个促炎环境,加速蛋白质进一步错误折叠和聚集,从而引发神经炎症和神经元损伤的恶性循环。尽管大多数研究聚焦于神经元,但蛋白质聚集物也在胶质细胞(包括小胶质细胞)中积累,这表明它们在神经退行性病理中发挥作用。
自噬和吞噬作用是两种关键的细胞降解过程。吞噬作用主要清除细胞外碎片,而自噬则针对细胞内成分,如受损的细胞器和错误折叠的蛋白质,将其导向溶酶体进行降解。在小胶质细胞中,自噬不仅参与细胞内质量控制,还调节免疫活性。这一功能随着年龄增长愈发重要,因自噬效率下降——这是衰老的已知标志之一。
自噬主要有三种形式(Jülg, 2021)。微自噬涉及溶酶体直接吞噬细胞质物质。伴侣蛋白介导的自噬通过伴侣蛋白识别选择性靶向特定蛋白质。巨自噬是最广泛研究的类型,涉及形成双层膜的自噬体,吞噬细胞成分并随后与溶酶体融合形成自噬溶酶体进行降解。
巨自噬受自噬相关(ATG)蛋白严格调控。该过程包括ULK1复合体的激活、Beclin1-PIK3C3复合体的形成,以及LC3-I向LC3-II的转化(Jülg, 2021)。关键调节因子包括哺乳动物雷帕霉素靶蛋白复合物1(mTORC1),其抑制自噬,以及AMP激活蛋白激酶(AMPK),其促进自噬。自噬的正常进行依赖于这些相反信号之间的平衡(Lin, 2023;Ou-Yang, 2023)。在小胶质细胞中,额外的调节通路包括p38 MAPK信号通路和适应蛋白p62,后者常被用作自噬缺陷的标志物(Lin, 2023;Ou-Yang, 2023)。
新兴证据强调了小胶质细胞自噬在调节中枢神经系统炎症中的作用(Zhu, 2022)。当自噬受损时,小胶质细胞的 essential 功能,如吞噬作用和免疫调节,会受到损害,导致慢性神经炎症(Zhu, 2022)。由于神经炎症是许多神经退行性疾病的特征性表现,自噬通过清除炎症介质在达到有害水平前发挥保护作用。当该系统失效时,持续性炎症和神经元损伤随之发生(Lin, 2023)。
小胶质细胞自噬的核心抗炎功能在于抑制NLRP3炎症小体,这一多蛋白复合体可激活促炎细胞因子。自噬功能障碍导致NLRP3活化增强,进而促进神经毒性。这种关系具有双向性——NLRP3活性亦可扰乱自噬,形成反馈回路,在中枢神经系统(CNS)免疫紊乱中发挥关键作用。
尽管以神经元为重点的研究主导了自噬研究,但越来越多的证据支持小胶质细胞自噬功能障碍对神经退行性疾病具有重要贡献的观点。增强小胶质细胞的自噬活性正作为治疗策略进行探索。通过改善异常蛋白质的清除并缓解慢性炎症,恢复小胶质细胞的自噬功能可能减缓或预防由蛋白质聚集和免疫失衡共同驱动的疾病进展。
在神经退行性疾病(如阿尔茨海默病、帕金森病和肌萎缩侧索硬化症)中,小胶质细胞自噬是如何受损的?
阿尔茨海默病(AD)
阿尔茨海默病(AD)是最常见的神经退行性疾病,以进行性认知功能衰退和细胞外β淀粉样蛋白(Aβ)斑块及细胞内tau蛋白缠结的积累为特征。小胶质细胞在AD中发挥双重作用,既参与病理聚集物的清除,又参与炎症反应(Cho, 2014)。
与小胶质细胞功能相关的关键自噬调节因子包括PPAR-α、Atg1 、Map1lc3b 和BECN1。PPAR-α的激活可增强人类小胶质细胞及AD小鼠模型中的自噬,从而减少Aβ斑块负荷、改善认知功能并增加斑块周围胶质细胞活性(Luo, 2020)。相反,敲低Atg1或 Map1lc3b会阻碍Aβ降解并增强实验模型中的炎症信号传导(Cho, 2014)
小鼠中BECN1功能部分缺失导致小胶质细胞NLRP3炎症小体活性升高,并增加IL-1β和IL-18的产生(Houtman, 2019)。在APP/PS1小鼠中,BECN1表达 降低导致NLRP3和caspase-1活化增强。超分辨率成像研究证实NLRP3与LC3阳性囊泡共定位,提示自噬可能直接降解炎症小体组分(Houtman, 2019)。
这些发现得到了人类数据的支持。来自阿尔茨海默病患者的小胶质细胞显示Beclin1水平降低,这可能导致自噬体形成和吞噬功能受损,从而影响Aβ的清除(Lucin, 2013)。Aβ吞噬后,小胶质细胞通过涉及LC3-II和适应蛋白optineurin(OPTN)的机制降解Aβ,该过程受STK11/LKB1-AMPKα通路调节。这些发现进一步强调了完整自噬在限制AD中Aβ积累和炎症中的关键作用。
帕金森病(PD)
PD是第二常见的神经退行性疾病,特征为黑质致密部(SNc)多巴胺能神经元的进行性退化。临床上,PD表现为运动症状,如震颤、肌强直、运动迟缓和姿势不稳,以及非运动症状,包括认知衰退和睡眠障碍。病理学特征是Lewy小体和神经元中α-synuclein的积累。
小胶质细胞自噬在调节炎症和清除α-突触核蛋白中发挥关键作用。过量的α-突触核蛋白会扰乱自噬流并诱导氧化应激。与家族性帕金森病相关的DJ-1基因调控小胶质细胞自噬。其缺失会阻碍α-突触核蛋白的清除并加剧炎症(Nash, 2017)。在小胶质细胞中删除Atg5会增加NLRP3活化并加重MPTP模型中的神经元死亡(Qin, 2021)。药理学抑制Drp1可恢复自噬并减少α-突触核蛋白积累(Fan, 2019)。
细胞外α-突触核蛋白通过TLR4介导的p38和Akt/mTOR信号通路抑制自噬。阻断这些通路中的任何一个均有助于恢复自噬功能(Tu, 2021)。小胶质细胞也参与“synucleinphagy”,即一种依赖于TLR4信号传导和NF-κB驱动的p62诱导的自噬过程,用于降解神经元释放的α-synuclein(Choi, 2020)。
衰老会加重这些缺陷。与年轻小鼠相比,老年小鼠在注射人α-synuclein后保留α-synuclein的时间更长,这表明自噬效率随年龄下降,从而促进疾病进展(Hong, 2024)。
肌萎缩侧索硬化症(ALS)
ALS是一种进行性致死性神经退行性疾病,以运动神经元丧失为特征。该病伴有TDP-43胞质包涵体,并与C9ORF72和SOD1基因突变遗传相关。小胶质细胞活化和功能障碍在ALS病理中显著存在,但自噬的具体作用尚不明确。
携带PFN1突变的人诱导多能干细胞(hiPSC)来源的小胶质细胞样细胞(hiPSC-MG)表现出自噬和吞噬作用受损(Funes, 2024)。这些缺陷可被雷帕霉素逆转,表明存在自噬依赖性机制(Funes, 2024)。携带C9ORF72突变的hiPSC来源小胶质细胞自噬能力降低且免疫活性增强,而药理学刺激自噬可改善运动神经元存活(Banerjee, 2023)。
在SOD1G93AALS小鼠与LC3报告基因小鼠杂交后,症状期小胶质细胞和星形胶质细胞的细胞流失增加,但少突胶质细胞中未观察到此反应(Perera, 2025)。此外,自噬功能障碍在脊髓中出现早于运动皮层,提示疾病进展存在区域性和细胞类型特异性(Perera, 2025)。
综合阿尔茨海默病(AD)、帕金森病(PD)和ALS的研究证据表明,存在一种共同机制:小胶质细胞自噬受损导致蛋白质积累和慢性炎症,从而加速神经元退化。因此,增强小胶质细胞的自噬可能代表一种延缓疾病进展的可行策略。
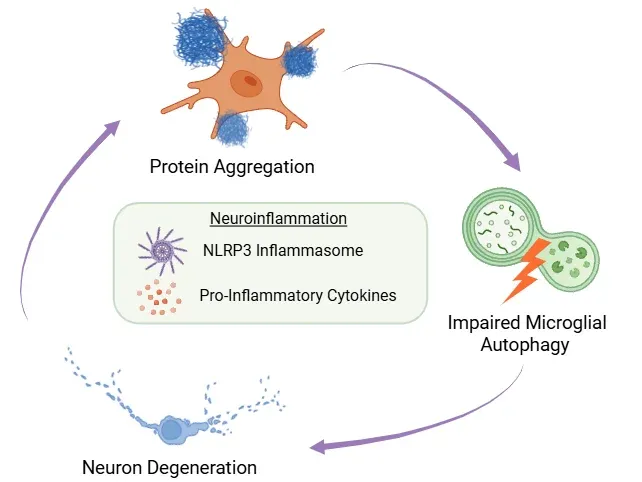
错误折叠蛋白质积累、小胶质细胞自噬受损与神经元退化之间的反馈循环示意图。该循环的核心是神经炎症,由NLRP3炎症小体激活及促炎细胞因子的释放驱动。
如何通过靶向小胶质细胞自噬实现对神经退行性疾病的治疗?
靶向小胶质细胞自噬为治疗阿尔茨海默病(AD)、帕金森病(PD)和肌萎缩侧索硬化症(ALS)等神经退行性疾病提供了有前景的治疗途径。尽管目前尚无获批的治疗方法能选择性调节小胶质细胞自噬,但越来越多的前临床证据支持通过增强自噬活性改善病理蛋白清除、减轻炎症并促进中枢神经系统(CNS)稳态的观点。
已有多种药物被研究。雷帕霉素(mTOR抑制剂)可诱导自噬并减少TLR2介导的α-突触核蛋白表达(Dzamko, 2017)。然而,在ALS模型中,雷帕霉素加剧了运动神经元死亡(Zhang, 2011),且临床试验尚未显示显著益处(Mandrioli, 2023)。二甲双胍通过激活AMPK在帕金森病模型中显示出神经保护作用,可减少α-突触核蛋白聚集,但其对小胶质细胞自噬的直接影响尚不明确(Lu, 2016)。氟西汀通过增加LC3-II水平和自噬体形成增强小胶质细胞自噬,具有潜在的抗炎和清除聚集物作用(Park, 2021)。槲皮素可增强小胶质细胞自噬并抑制NLRP3激活,从而减少小胶质细胞细胞因子分泌(Han, 2019)。作为自噬诱导剂,海藻糖在早期ALS研究中显示出潜力,但近期临床试验结果尚不明确(HEALEY ALS Platform Trial, 2025)。
鉴于这些不一致的结果,研究人员正在开发细胞类型特异性递送策略。能够穿过血脑屏障并靶向小胶质细胞的纳米颗粒,如MCPZFS纳米颗粒,已显示出增强Aβ清除和减少细胞因子释放的能力。这些颗粒可能将蛋白质降解从自噬重定向至蛋白酶体通路(Liu, 2019)。然而,BBB穿透性、靶向精度及纳米颗粒变异性等挑战仍待解决(Lin, 2023)。
石墨烯氧化物(GO)是一种碳基纳米材料,通过激活AMPK抑制mTOR信号传导以促进自噬。研究表明,GO可增强小胶质细胞对Aβ的清除并降低疾病模型中的神经毒性(Li, 2020)。
基因治疗方法也正在探索中。携带胶质细胞特异性启动子的腺相关病毒(AAV)载体可实现对小胶质细胞中自噬基因的靶向调控(O’Carroll, 2021)。与全身给药相比,该方法具有优势,尤其考虑到BBB穿透的困难。
将自噬诱导剂与炎症小体抑制剂联合使用可能产生协同效应。同时靶向这两条通路在抑制蛋白质积累和炎症方面比单独干预更有效(Wang, 2023)。
综上所述,尽管目前调节小胶质细胞自噬的大多数策略仍处于早期开发阶段,但该领域正迅速发展。需要进一步研究以优化递送系统、增强细胞特异性并确立长期安全性。通过恢复小胶质细胞自噬功能的疗法,有望通过同时解决蛋白质病变和免疫紊乱,为延缓神经退行性疾病提供重要治疗策略。
我们的团队很乐意回答关于神经退行性疾病中小胶质细胞自噬异常的任何问题,或提供我们用于治疗效果研究的模型相关具体信息。
相关内容
关于神经炎症的最新信息以及在神经退行性疾病动物模型中评估治疗药物的最佳实践。
微胶质细胞和星形胶质细胞的溶酶体功能障碍
关于小胶质细胞和星形胶质细胞溶酶体功能障碍及其在神经退行性疾病中作用的概述。
自噬、帕金森氏症和多巴胺能神经元
概述了受损的自动回收功能如何导致帕金森病多巴胺能神经元的病理变化和神经变性。
自噬与神经退行性疾病
细胞自噬在脑健康和神经退行性疾病中发挥作用的概述。
NLRP3炎症小体与神经退行性疾病
NLRP3炎症小体及其在神经退行性疾病(包括阿尔茨海默病、帕金森病和肌萎缩性脊髓侧索硬化症)中作用的概述。
神经退行性疾病中的TNF-α和微胶质细胞
概述肿瘤坏死因子-α(TNF-α)在小胶质细胞中的作用及其对神经退行性病变进展的影响。
自噬和转录因子EB(TFEB)
转录因子EB(TFEB)及其在自噬和神经退行性疾病中的作用概述。