아교세포와 소교세포에서 리소좀의 역할은 무엇인가요?
리소좀은 세포질 소기관으로, 주로 다양한 세포 파편을 분해하는 역할을 하는 것으로 알려져 있습니다 (Perera, 2016). 리소좀 생성은 주로 리소좀 단백질과 효소를 담당하는 유전자의 발현을 조절하는 전사 인자 EB(TFEB)에 의해 조절됩니다. 리소좀은 리소좀 관련 막 단백질(LAMP)로 구성된 특수 막에 의해 포함된 진공-ATP 분해효소(v-ATPase) 양성자 펌프를 통해 산성 내강을 유지합니다. 리소좀에는 이화 작용을 수행하는 수많은 가수분해 효소가 들어 있습니다.
리소좀은 세포 외 물질과 세포 내 물질을 분해하는 데 중요한 역할을 합니다 (Perera, 2016). 세포 외 물질의 섭취는 세포 내 물질 섭취를 통해 이루어지며, 이 과정에서 노폐물은 소포체에 포장되어 나중에 리소좀과 융합되어 분해됩니다. 이와는 대조적으로, 세포 내 물질은 자가포식 작용을 통해 분해되고 재활용되는데, 이 과정에서 오래되거나 손상된 세포 기관은 자가포식체(autophagosome)에 포장되어 리소좀과 융합되어 재활용 또는 분해됩니다. 따라서 리소좀은 거대 분자를 구성 요소로 분해하여 제거하거나 재활용하는 공통의 종착지 역할을 합니다.
성상교세포와 소교세포는 신경세포 신호 전달을 지원하고 조절하는 데 매우 중요합니다. 성상교세포는 과도한 신경전달물질을 재활용하여 신경세포 신호를 조절하고, 혈액-뇌 장벽을 유지하는 등 여러 가지 기능을 수행합니다. 소교세포는 중추신경계(CNS)의 주요 면역세포입니다. 소교세포는 신경퇴행성 질환에서 발견되는 단백질 응집체를 포함하여 병원체와 세포 파편을 제거하는 데 중요한 식세포입니다 (Kreher, 2021). 세포 파편이 분해되는 주요 지표인 리소좀은 성상교세포와 소교세포의 최적 기능에 필수적입니다 (Kreher, 2021).
미세아교세포의 자식작용 장애가 신경퇴행성 질환으로 이어지는 메커니즘에 대한 자세한 내용은 다음을 참고하시기 바랍니다: 신경퇴행성 질환에서의 미세아교세포 자식작용 장애
참고 자료: 자식작용, 파킨슨병, 도파민 신경세포
리소좀 기능 장애가 알츠하이머병, 파킨슨병, 루게릭병에 어떤 영향을 미치나요?
리소좀 기능 장애는 다양한 방식으로 나타날 수 있습니다. 리소좀 산성화, 리소좀 가수분해 효소 활성, 리소좀 막의 투과성, 자가포식체 또는 엔도솜과 리소좀의 융합 장애와 같은 리소좀 기능 장애는 일반적으로 신경 퇴행성 질환에서 발견됩니다 (Kreher, 2021; Quick, 2023). 이러한 리소좀 기능 장애는 세포 파편의 비효율적인 분해를 초래하여 추가적인 병인을 유발할 수 있습니다.
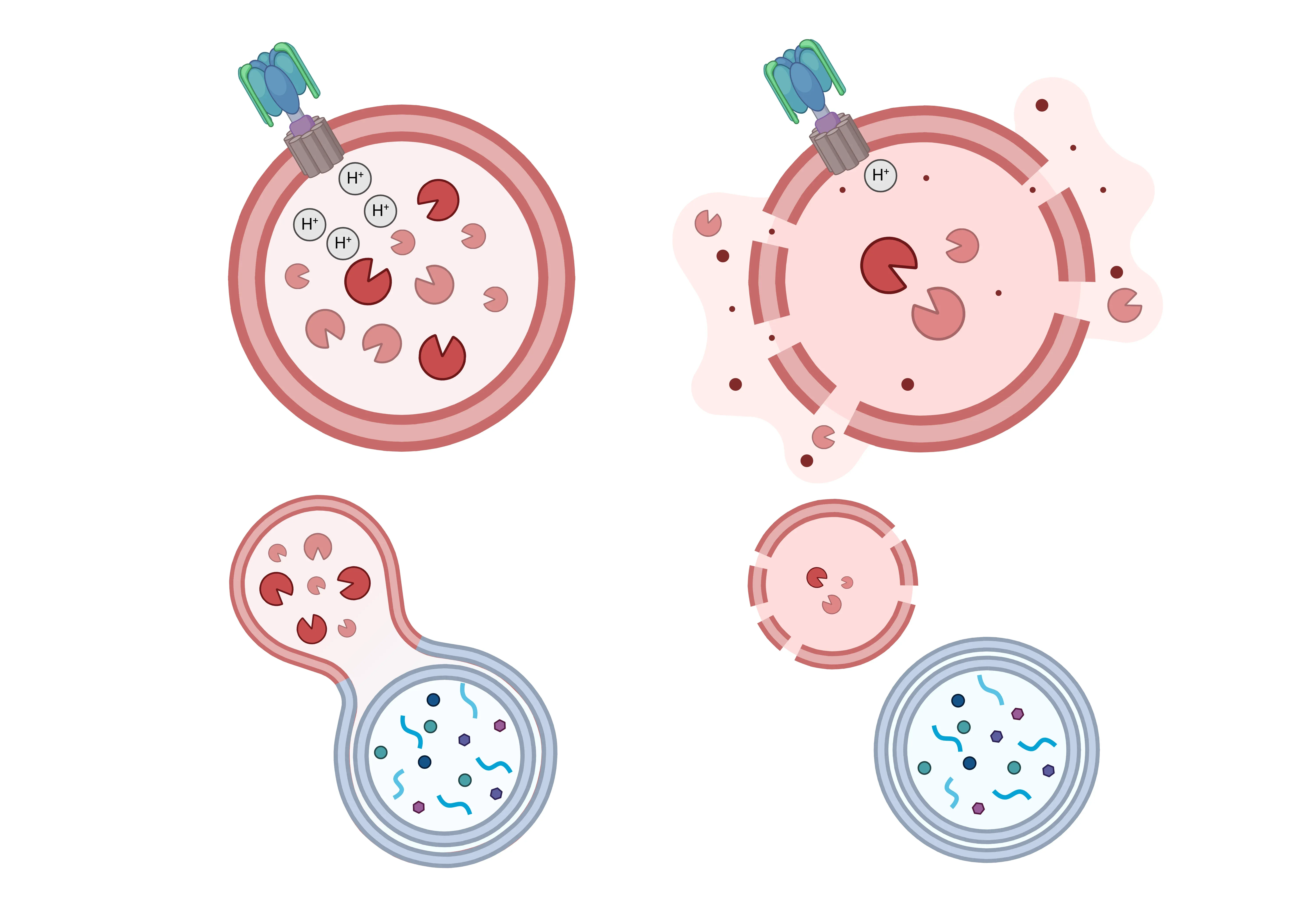
많은 신경 퇴행성 질환에서 정상적인 리소좀 기능(왼쪽)이 손상되고, 다양한 리소좀 기능 장애(오른쪽)가 발생합니다. 리소좀 산성화는 v-ATPase 기능의 결핍으로 인해 리소좀 내강에서 pH가 높아짐으로써 영향을 받을 수 있습니다. 또한, 리소좀 막의 투과성이 높아져 리소좀 가수분해효소가 세포질로 방출됩니다. 리소좀 효소의 가용성도 감소되어 분해 능력이 감소합니다. 마지막으로, 리소좀과 엔도좀, 오토파지좀의 융합이 손상되어 분해되지 않은 물질이 축적될 수 있습니다.
클릭하여 링크 복사
알츠하이머병(AD)
AD는 아밀로이드-베타(Aβ)와 타우 응집체의 축적을 특징으로 하는 신경 퇴행성 질환입니다. 성상교세포와 소교세포의 리소좀은 이러한 독성 단백질 응집체의 내재화와 분해에 중요한 역할을 합니다 (Kreher, 2021). 그러나 Aβ의 식세포 작용과 분해는 소교세포에서 더 두드러지는 것으로 보입니다 (Prakash, 2021). 자가포식 기능이 결핍된 미세아교세포를 가진 생쥐는 이용 가능한 리소좀 효소의 감소와 Aβ의 제거 장애를 보입니다 (Choi, 2023). 또한, 알츠하이머병 환자의 경우 리소좀 효소의 손실로 인해 단백질 응집체의 분해 능력이 감소합니다 (Kim, 2025). 리소좀의 적절한 산성화는 리소좀이 이화 작용을 수행하는 데 필수적이며, 알츠하이머병에서는 이 기능이 손상됩니다. 염화수소 이온 수송체인 ClC-7의 유전적 결핍은 미세아교세포 리소좀의 부적절한 산성화로 이어져, Aβ 단백질 응집체의 분해 장애를 초래합니다 (Majumdar, 2011). 또한, 알츠하이머병의 발병과 밀접하게 연관되어 있는 프레세닐린 1(PS1)의 돌연변이는 리소좀 v-ATPase의 조립을 방해하여 리소좀의 부적절한 산성화와 미세아교세포에 의한 A&베타의 비효율적인 분해를 초래합니다 (Ledo, 2021). 또한, PS1 돌연변이는 미세아교세포에서 TFEB mRNA 수준의 감소와 관련이 있으며, 이로 인해 리소좀 생성이 감소하고 자가포식 작용이 손상됩니다 (Ledo, 2021).
또한, AD와 단백질 응집체의 축적은 신경교세포의 리소좀 기능 장애를 더욱 악화시킬 수 있습니다. 예를 들어, Aβ 응집체의 존재는 TFEB의 이동에 영향을 미쳐, 리소좀의 부적절한 산성화와 단백질 응집체의 제거 감소로 이어집니다 (Guo, 2017). 장기간의 Aβ 노출은 리소좀 막의 투과성을 증가시켜 미세아교세포의 자가포식 및 리소좀 기능을 더욱 억제합니다 (Pomilio, 2020). 따라서, 리소좀 기능 장애와 신경독성 단백질 응집체의 축적에 의한 피드포워드 메커니즘은 알츠하이머병의 신경 퇴화를 더욱 촉진할 수 있습니다.
파킨슨병(PD)
PD는 AD 다음으로 두 번째로 흔한 신경 퇴행성 질환이며, 운동 기능의 현저한 변화와 비운동 기능의 특징이 특징입니다. PD의 주요 신경 병리학적 특징은 흑질 내의 도파민성 신경 세포의 죽음입니다. PD는 또한 루이 소체의 주요 구성 요소인 α-시누클레인(α-Syn) 단백질 응집체의 존재로 특징지어집니다. PD에서 단백질 응집체는 주로 뉴런에서 발견되지만, 성상교세포와 소교세포에서도 발견됩니다 (Tremblay, 2019). 성상교세포와 소교세포는 뉴런에서 분비된 α-Syn이 리소좀 의존적인 방식으로 분해되도록 하는 데 중요한 역할을 할 수 있습니다 (Lee, 2010; Choi, 2020). 비록 미세아교세포가 α-Syn의 흡수를 담당하는 주요 청소세포이지만 (Filippini, 2019), 성상교세포에 의한 α-Syn의 과도한 흡수는 리소좀 경로를 압도하여 α-Syn이 성상교세포에 축적되도록 할 수 있습니다 (Tremblay, 2019).
류신-풍부 반복 키나제 2(LRRK2)와 글루코세레브로시다제(GBA)는 파킨슨병과 관련된 가장 흔한 유전자 중 두 가지입니다 (Pang, 2022), 그리고 둘 다 성상교세포와 소교세포의 리소좀 기능에 중요한 역할을 합니다 (Tremblay, 2019). 성상교세포에서 LRRK2는 리소좀과 엔도좀, 그리고 자가포식체와의 융합을 촉진하는 데 중요한 역할을 하는 리소좀 관련 막 단백질(LAMP)과 함께 발견됩니다 (Henry, 2015; Tremblay, 2019). 파킨슨병과 관련이 있는 LRRK2의 돌연변이는 리소좀이 커지고 분해 능력이 감소한 성상교세포를 나타냅니다 (Henry, 2015). LRRK2는 TFEB에 대한 영향을 통해 잠재적으로 성상교세포와 소교세포의 리소좀 분해를 부정적으로 조절하는 것으로 나타났습니다 (Henry,2015; Yadavalli, 2023). LRRK2의 활동이 높을수록 성상교세포의 리소좀 수가 감소하고 소교세포의 리소좀 가수분해효소의 발현이 감소합니다 (Henry, 2015; Yadavalli, 2023). GBA 유전자는 리소좀 효소인 글루코세레브로시다아제(GCase)를 암호화하는데, 이 효소는 또한 PD와도 관련이 있는 것으로 알려져 있습니다. GBA는 신경 퇴화에 대한 반응으로 성상교세포와 소교세포의 이동에 관여합니다 (Tremblay, 2019). 또한, GBA의 발현을 억제하면 GCase의 활성이 감소하고, 그 결과 리소좀 기능 장애가 발생하여 α-Syn 응집체의 축적이 증가할 수 있습니다 (Schönndorf, 2014). 따라서, PD와 가장 관련이 있는 두 유전자는 성상교세포와 소교세포 내 리소좀 기능에 영향을 미치는 것으로 보입니다.
근위축성 측삭 경화증(ALS)
ALS는 중추신경계(CNS)의 운동 뉴런의 퇴행을 특징으로 하는 치명적인 질병입니다. 염색체 9번 개방형 읽기 프레임 72 유전자(C9orf72)의 비코딩 영역에서 헥사뉴클레오티드 반복 확장이 이 질병의 주요 근본적인 유전적 원인 중 하나라는 사실이 밝혀졌습니다 (Root, 2021). 흥미롭게도, C9orf72 유전자의 돌연변이는 리소좀 기능에 중요한 역할을 하는 것으로 나타났습니다. C9orf72 단백질은 리소좀에 국한되어있으며(Amick, 2016; Laflamme, 2019), 미세아교세포에서 많이 발현됩니다 (O'Rourke, 2016). C9orf72 돌연변이는 리소좀의 산성화에 장애를 일으켜 분해 기능을 손상시킬 수 있습니다 (Shao, 2019). 또한, C9orf72 결핍 마우스는 미세아교세포에서 특이적으로 분해되는 리소좀 트래픽의 장애를 보입니다 (O'Rourke, 2016). C9orf72 돌연변이에 의해 유발되는 리소좀 분해 경로의 기능 장애는 ALS에서 신경 퇴화에 기여하는 단백질 응집체의 축적을 유발할 수 있습니다 (Root, 2021).
Transactive response DNA binding protein 43 kDa (TDP-43)는 TARDBP 유전자에 의해 암호화된 단백질로, ALS와도 관련이 있는 것으로 알려져 있습니다 (Root, 2021). TDP-43은 리소좀과 리소좀 분해 경로의 정상적인 기능에 중요한 역할을 합니다. 예를 들어, TDP-43은 리소좀 기능과 생합성을 조절하는 TFEB의 발현을 매개합니다 (Root, 2021). 또한, TDP-43의 변이는 리소좀 기능 장애와 관련이 있습니다 (Kreiter, 2018). 흥미롭게도, 소교세포에서 TDP-43의 손실이 리소좀 생성을 촉진하여 소교세포의 식세포 작용과 단백질 응집체 제거를 촉진하는 것으로 나타났습니다 (Paolicelli, 2017). TDP-43 응집체는 또한 ALS를 포함한 많은 신경 퇴행성 질환에서 뉴런과 신경교에 축적될 수 있습니다 (Root, 2021). 과도한 TDP-43은 리소좀의 분해 능력을 방해할 수 있으며, 이로 인해 비정상적인 자가포식 작용이 유발될 수 있을 뿐만 아니라 TDP-43 응집체를 제거하는 능력이 감소할 수 있습니다 (Leibiger, 2018). 이 효과는 매우 해롭습니다. 왜냐하면 다른 분해 시스템이 압도당하게 되면, ALS에서 TDP-43 응집체의 제거는 자가포식-리소좀 경로에 의존하게 되기 때문입니다 (Root, 2021).
신경 퇴행성 질환을 치료하기 위해 리소좀 기능을 어떻게 표적화합니까?
신경퇴행성 질환과 리소좀 기능 장애 사이의 연관성을 뒷받침하는 강력한 증거가 있습니다. 따라서, 리소좀 기능을 개선하거나 회복시키는 치료 전략을 활용하면 신경퇴행의 병리학적 증상을 줄일 수 있습니다. 이러한 전략은 리소좀 기능을 회복시키거나 개선함으로써 단백질 응집체의 제거율을 높이는 데 초점을 맞추는 경우가 많습니다. 예를 들어, 현재 2단계 위약 대조 임상 시험 (NCT02914366)이 진행 중인데, 이 시험에서는 리소좀 효소 GCase의 활성을 증가시키고 마우스에서 α-Syn 응집체를 감소시키는 것으로 밝혀진 암브록솔(Ambroxol)을 테스트하고 있습니다 (Migdalska-Richards, 2016). 임상 시험에서 연구되고 있는 또 다른 방법은 LRRK2 억제제를 사용하여 중추신경계의 리소좀 기능 장애를 교정하는 것입니다 (NCT04557800 및 NCT04056689). 이 LRRK2 억제제는 건강한 대조군과 파킨슨병 환자 모두에게서 일반적으로 안전하고 내약성이 좋은 것으로 밝혀졌지만, 그 효능은 아직 확인되지 않았습니다 (Jennings, 2023).
리소좀을 통한 신경퇴행성 질환 치료의 공통 목표는 리소좀 생성과 기능에 크게 관여하는 TFEB를 이용하는 것입니다 (Kim, 2025). TFEB는 라파마이신(rapamycin)과 같은 분자에 의해 달성되는 라파마이신(mTOR) 경로의 억제를 통해 활성화될 수 있습니다 (Kim, 2025). 다른 분자들도 mTOR와 무관한 경로로 TFEB를 증가시킬 수 있으며, Aβ 단백질 응집체의 분해를 증가시키는 것으로 나타났습니다 (Portbury, 2017). 또한, TFEB 활성화는 다른 상류 과정을 억제함으로써 달성될 수 있습니다. 예를 들어, AIT-101을 사용하여 지질 키나아제 PIKfyve를 선택적으로 억제하면 TFEB가 활성화되고, TDP-43 응집체의 리소좀 제거가 촉진되며, ALS 마우스 모델에서 신경염증과 기능적 결함이 감소합니다 (Young, 2023). 특히 신경교세포에서 TFEB를 활성화하고 리소좀 제거를 촉진하는 분자의 추가 개발은 신경퇴행성 질환 치료에 큰 잠재력을 보여줍니다. TFEB 및 자가포식 작용에 관여하는 다른 단백질의 발현을 강화하면 신경염증과 싸우기 위한 미세교세포 활성화 및 α-Syn 응집체의 제거가 개선됩니다 (Chen, 2021). 또한, TFEB의 더 큰 발현은 리소좀 생성과 Aβ와 Tau 응집체의 성상교세포 흡수를 향상시킵니다 (Xiao, 2014; Martini-Stoica, 2018). 신경교세포의 리소좀 기능을 회복하는 것은 신경퇴행성 질환의 치료에 새로운 접근법을 제공할 수 있습니다.
저희 팀은 신경 퇴행성 질환의 미세아교세포 및 성상교세포의 리소좀 기능 장애에 대한 질문이나 치료 효능 연구에 사용하는 AD, ALS 및 PD 모델에 대한 구체적인 정보를 기꺼이 답변해 드립니다.
관련 콘텐츠
미세아교세포 및 성상세포의 리소좀 기능 장애에 대한 최신 정보와 신경 퇴행성 질환의 동물 모델에서 치료제의 평가와 관련된 모범 사례에 대해 알아보세요.
미토콘드리아 기능 장애와 미세아교세포 및 별아교세포
미토콘드리아 기능 장애가 알츠하이머 병, 파킨슨 병, ALS를 포함한 신경퇴행성 질환에서 미세아교세포와 별아교세포에 미치는 역할.
자가포식 및 전사 인자 EB(TFEB)
전사 인자 EB(TFEB)와 자가포식 및 신경 퇴행성 질환에서의 역할에 대한 개요.
자가포식 및 신경퇴행성 질환
세포 자가포식이 뇌 건강과 신경 퇴화에 어떤 역할을 하는지에 대한 개요.
자가포식, 파킨슨병, 도파민성 신경세포
파킨슨병에서 손상된 자가포식 작용이 어떻게 도파민성 뉴런의 병리학적 변화와 신경 퇴화로 이어질 수 있는지에 대한 개요.