この資料では以下の内容について説明しております:
PS19マウスモデルとは何でしょうか?
タウ病変は、神経細胞の細胞構造維持に関与する微小管関連タンパク質であるタウの異常凝集を特徴とする神経変性疾患群です。これらの疾患では、タウが過剰リン酸化されることで微小管から離脱し、神経細胞内に蓄積します。その結果生じる凝集は神経細胞の細胞骨格を不安定化し、神経毒性を引き起こし、最終的に細胞死に至ります (Wang, 2016)。これまでに、 アルツハイマー病、17番染色体関連前頭側頭型認知症およびパーキンソニズム(FTDP-17)、進行性核上性麻痺など、 26種類以上の異なるタウ病変が同定されています (セクストン、2022年 ) 。
タウタンパク質と神経変性への関与に関する研究は急速に進展しております。技術の進歩と タウ病変の表現型を正確に再現する動物モデルの開発により 、タウの蓄積と拡散を標的とする薬剤の開発が可能となり、関連する運動機能、認知機能、行動結果への影響に関する研究も進められております (Soeda,2020 ) 。
PS19マウスモデルは、神経変性性タウ病の研究において最も広く用いられているマウスモデルの一つです。PS19マウスは、マウスプリオンタンパク質プロモーター(PrP)によって駆動される、ヒトタウタンパク質のP301S変異体(タウ遺伝子におけるミスセンス変異)を発現します。この強力で恒常的なプロモーターは、タウ発現を内因性産生量の約5倍まで高めます( Yoshiyama, 2007)。さらに、P301S変異はタウタンパク質の立体構造を変化させ、複数の部位でタウをリン酸化するキナーゼへのアクセス性を高めます。その結果生じる過剰リン酸化は、タウの微小管からの離脱を促進し、タウ分子の凝集能とシード能の両方を増強します( Strang, 2019) 。
タウ病変の研究には数多くの動物モデルが存在しますが、PS19モデルはタウ凝集と拡散を標的とした薬剤開発において優先的に用いられるモデルの一つです (Götz, 2019)。このモデルは、ヒトのタウ病変で観察されるものと同様の、臨床的に関連性の高い多様な表現型を再現します 。 具体的には 以下の通りです:
- ・進行性のタウ凝集
- 神経炎症
- 運動機能障害
- 認知機能 障害
また、P301S変異は複数の脳領域において病理を促進します。具体的には :
- 大脳皮質
- 海馬
- 脳幹
- 脊髄
この広範な病理スペクトルは、アルツハイマー病やFTDP-17などの疾患で見られる空間的側面をよりよく模倣しており、認知症状と運動症状の両方を研究する上で本モデルの有用性を高めています(Alves, 2025) 。
PS19モデルが、複数の標的に対する疾患修飾療法の試験に適している主な特徴は以下の通りです:
- 認知機能障害および運動機能障害に対応する、強力かつ進行性のタウシードおよび拡散バイオアクティビティ
- ミクログリア増生とアストロサイト増生を伴う強力な神経炎症プロファイル
- 複数の脳領域に及ぶ広範な神経細胞死と脳萎縮
- 加齢に伴う認知機能障害
- 病態の後期段階における顕著な運動機能の低下と筋力低下
- 生存率の低下
このモデルではどのような神経病理学的変化が 観察されますか ?
- 生後3ヶ月頃、PS19マウスではシナプス機能障害やミクログリア増殖など、タウ病理の初期兆候が現れ始めます。
- 生後5~6ヶ月までに、過リン酸化タウタンパク質の細胞内凝集体(神経原線維変化:NFT)が、大脳皮質、海馬、扁桃体、脳幹、脊髄など複数の脳領域に現れ始めます。
- 生後6ヶ月頃には、PS19マウスにおいてIL-1β、IL-6、 TNF-αなどの炎症性サイトカインの放出が漸進的に増加し始めます。このサイトカインの上昇は 星状膠細胞増殖やミクログリア活性化を促進し 、神経変性過程を悪化させます。これらの変化は様々な免疫測定法により検出可能です (Jati, 2025)。
- 生後8ヶ月までに、これらのマウスでは明らかな神経細胞喪失と海馬萎縮が進行し、体積測定磁気共鳴画像法(MRI)により明らかになったように、生後9ヶ月までに新皮質や内嗅皮質などの他の脳領域へ徐々に拡大します(Yoshiyama, 2007)。この段階では、広範な 神経炎症、 ミトコンドリア機能障害、活性酸素種の産生増加も病理学的特徴として顕著です 。
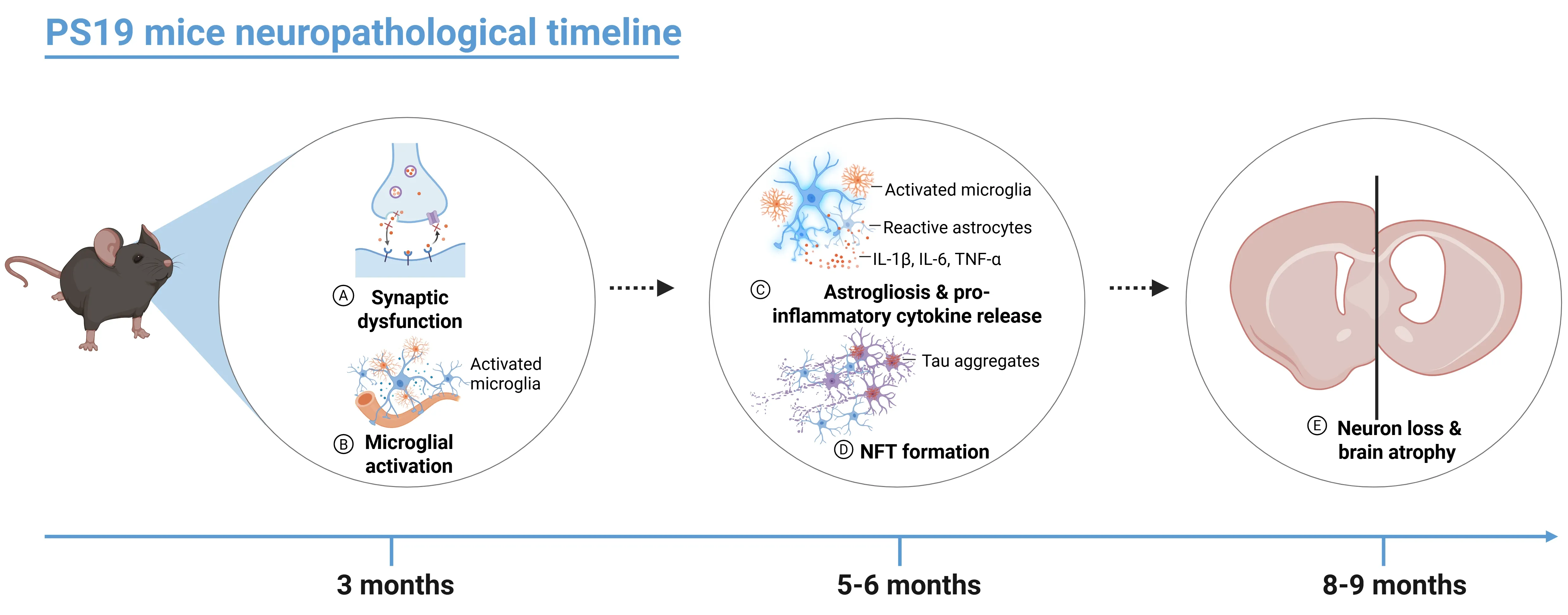
PS19(P310S)マウスにおける神経病理学的変化の発現時期の推移
PS19マウスにおけるタウ病変は、 タウ前駆体線維(PFF)の定位注射によっても実験的に誘導することが可能です 。海馬および上皮皮質に投与されたタウPFFは、注入部位において急速にNFT様凝集物を形成します。これらの凝集物は神経ネットワークを介して接続された脳領域へ拡散し、誘導された病理はアルツハイマー病におけるタウ病理( Iba, 2013)と極めて類似しており 、以下のような主要な特徴を示します :
- タウタンパク質のリン酸化およびアセチル化増加
- β-シートアミロイド構造(チオフラビンS陽性)
- プロテイナーゼK 消化 に対する耐性
この神経病理学的プロファイルにより、PS19モデルはアルツハイマー病や前頭側頭型認知症などのタウ病変を標的とする薬剤開発に適したモデルとなります。これらのタウ病変の多くの病理学的・臨床的特徴を再現するため、タウ関連メカニズムの修飾を目的とした創薬研究において貴重なプラットフォームとなります 。
バイオスペクティブ社では、 PS19マウスの海馬および上皮皮質への超音波処理済み組換えヒトタウPFFsまたは脳抽出物の定位的投与により 、投与なしのPS19マウスで観察される自然発生的な加齢依存性発症と比較して、本モデルにおけるタウ病理の発現を加速・同期化することが可能です 。
本モデルでは、 以下の手法 を用いて一般的な神経病理学的所見を検出することが可能です :
- 脳萎縮および脳室拡大を測定する体積磁気共鳴画像法(MRI)
- 免疫組織化学染色、イメージング、および 解析による神経細胞喪失、星状膠細胞増生、小膠細胞増生、ならびにタウ病理の拡散の検出
- ELISAおよび関連する免疫測定技術を用いた、IL-1β、IL-6、 TNF-αなどの炎症性サイトカイン産生量の変化の検出。
PS19マウスはどのような認知および運動の表現型を示しますか?
PS19マウスは、ヒトのタウ病変で観察される表現型を再現する進行性の認知機能障害および運動機能障害を発症します。生後約6ヶ月齢で、特に記憶と学習における認知機能障害が典型的に現れ始めます (Ahmad, 2021)。これらの障害は 、 以下の課題において観察されます :
- 新規物体認識 試験
- Y字型迷路
- 高架十字迷路
- モリス水迷路
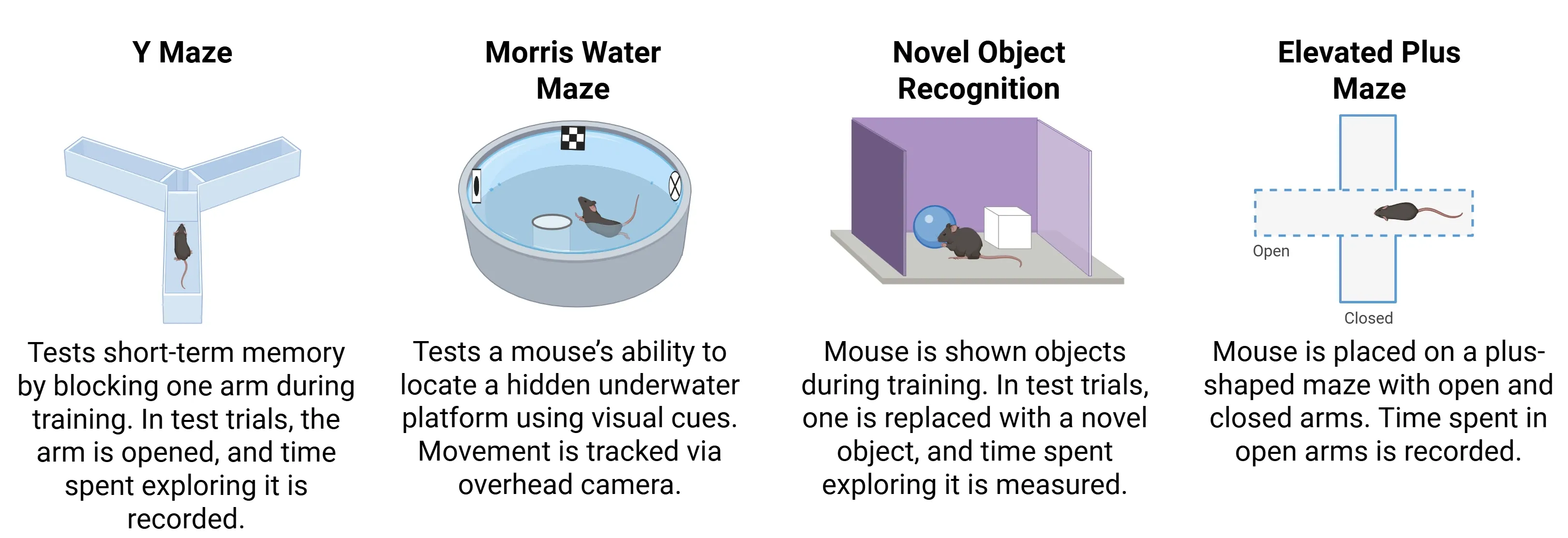
PS19マウスにおける認知機能の変化を評価するために一般的に用いられる試験。
認知機能の低下に加え、PS19マウスではタウ病理の進行に伴い 、特徴的な運動機能および生理学的異常が現れます (Dumont, 2011;Patel, 2022)。生後9ヶ月までに、これらのマウスは運動活動量の著しい増加を示し、これは多動性や行動抑制の欠如と関連しています。 この状態は、以下のような様々な運動機能検査を用いて評価されます:

PS19マウスにおける運動表現型を評価するために一般的に用いられる試験。
同時に、PS19マウスは運動機能の低下を示すとともに、体重減少、体温低下、虚弱化といった全身的な衰弱の明らかな兆候が現れ始めます(Patel, 2022)。これらの特徴はタウ病理の広範な生理的影響を反映しており、ヒトのタウ病変で観察される身体的衰弱の側面と密接に類似しています 。
これらの認知機能および運動機能の表現型は 、タウ前駆体線維(PFF)の定位注入によりさらに加速・同期化されます 。海馬および上皮質にPFFを導入すると、注入後わずか1ヶ月で成熟したNFT様タウ凝集体が形成されます (Iba, 2015)。 タウPFFを注入したPS19マウスは 、非注入マウス(通常6ヶ月頃に障害が現れる)と比較して、記憶障害や学習障害を含む認知障害が早期かつより顕著に発現します。また、タウPFFの定位的投与は、青斑核などの領域における神経細胞の早期喪失を招き、運動障害の早期発症と相関します 。
これらの認知機能、行動、運動機能の表現型を総合すると、PS19モデルはタウ標的治療法の効果を評価する強力なプラットフォームとなります 。
当社チームは、タウ標的薬開発のためのPS19マウスモデルに関するご質問や、治療効果試験に使用するモデルに関する具体的な情報について、喜んでご回答いたします。
当社の神経変性疾患モデルについて、さらに詳しくご覧ください
関連コンテンツ
神経炎症に関する最新情報と、神経変性疾患の動物モデルにおける治療薬評価に関連するベストプラクティスについて。
前頭側頭型認知症における神経画像診断と臨床試験
前頭側頭型認知症(FTD)の変異型に対する理解におけるMRIおよびPET画像診断によるバイオマーカーの有用性、およびFTD臨床試験におけるエンドポイントとしてのその使用。
進行性核上性麻痺(PSP)の画像診断バイオマーカー
PSPの臨床試験において、疾患修飾療法の有効性を評価するために利用可能な各種の脳画像診断法(MRI、PET、SPECT)の概要。
MCIとアルツハイマー病におけるタウPETの経時的変化
軽度認知障害(MCI)およびアルツハイマー病(AD)におけるタウPETトレーサーの取り込みと結合の変化に関する自然史の概要。