Qu'est-ce que le modèle murin PS19 ?
Les tauopathies sont un groupe de troubles neurodégénératifs caractérisés par l'agrégation anormale de la protéine tau, une protéine associée aux microtubules qui contribue au maintien de l'architecture cellulaire des neurones. Dans ces troubles, la protéine tau devient hyperphosphorylée, ce qui la détache des microtubules et la fait s'accumuler à l'intérieur des neurones ; l'agrégation qui en résulte déstabilise le cytosquelette neuronal, entraînant une neurotoxicité et finalement la mort cellulaire (Wang, 2016). À ce jour, plus de 26 tauopathies distinctes ont été identifiées, notamment la maladie d'Alzheimer,la démence frontotemporale et le parkinsonisme lié au chromosome 17 (FTDP-17), ainsi que la paralysie supranucléaire progressive (Sexton, 2022).
Les recherches sur la protéine tau et son implication dans la neurodégénérescence progressent rapidement. Les avancées technologiques et la création de modèles animaux reproduisant fidèlement les phénotypes des tauopathies ont permis le développement de médicaments ciblant l'accumulation et la propagation de la protéine tau, ainsi que la recherche sur leurs effets sur les résultats moteurs, cognitifs et comportementaux associés (Soeda, 2020).
Le modèle PS19 est l'un des modèles murins les plus largement utilisés pour étudier les tauopathies neurodégénératives. Les souris PS19 expriment la protéine tau humaine avec la mutation P301S, une mutation faux-sens dans le gène tau, sous l'effet du promoteur de la protéine prion de souris (PrP). Ce promoteur puissant et constitutif entraîne une expression de la protéine tau environ cinq fois supérieure à celle produite de manière endogène (Yoshiyama, 2007). De plus , la mutation P301S modifie la conformation de la protéine tau, la rendant plus accessible aux kinases qui la phosphorylent à plusieurs endroits. L'hyperphosphorylation qui en résulte favorise le détachement de la protéine tau des microtubules et renforce à la fois la capacité d'agrégation et le potentiel de germination des molécules de tau (Strang, 2019).
Il existe de nombreux modèles animaux pour étudier les tauopathies ; cependant, le modèle PS19 est l'un des modèles privilégiés pour le développement de médicaments ciblant l'agrégation et la propagation de la protéine tau (Götz, 2019). Ce modèle offre un large éventail de phénotypes cliniquement pertinents qui reproduisent ceux observés dans les tauopathies humaines, notamment:
- L'agrégation progressive de la protéine tau
- Neuroinflammation
- Déficits moteurs
- Déficience cognitive
La mutation P301S entraîne également une pathologie dans plusieurs régions du cerveau, notamment:
- Le cortex cérébral
- L'hippocampe
- Le tronc cérébral
- La moelle épinière
Ce large spectre pathologique reproduit mieux l'aspect spatial de la maladie tel qu'il apparaît dans des affections telles que la maladie d'Alzheimer et la FTDP-17, ce qui renforce l'utilité du modèle pour l'étude des symptômes cognitifs et moteurs (Alves, 2025).
Les caractéristiques les plus importantes du modèle PS19 qui le rendent adapté aux essais de thérapies modificatrices de la maladie à cibles multiples sont les suivantes :
- Une bioactivité robuste et progressive de propagation et de dissémination de la protéine tau, qui correspond à des troubles cognitifs et moteurs
- Un profil de neuroinflammation important avec microgliose et astrogliose
- Une mort cellulaire neuronale généralisée et une atrophie cérébrale dans plusieurs régions du cerveau
- Des troubles cognitifs liés à l'âge
- Un déclin moteur prononcé et une faiblesse musculaire aux stades avancés de la pathologie
- Survie réduite
Quels changements neuropathologiques peut-on observer dans ce modèle ?
- Vers l'âge de 3 mois, les souris PS19 commencent à présenter les premiers signes d'une pathologie tau, notamment un dysfonctionnement synaptique et une microgliose.
- À l'âge de 5 à 6 mois, des agrégats intracellulaires de tau hyperphosphorylée, appelés enchevêtrements neurofibrillaires (NFT), commencent à apparaître dans plusieurs régions du cerveau, notamment le cortex, l'hippocampe, l'amygdale, le tronc cérébral et la moelle épinière.
- Vers l'âge de 6 mois, les souris PS19 commencent à présenter une augmentation progressive de la libération de cytokines pro-inflammatoires telles que l'IL-1β, l'IL-6 et le TNF-α; cette élévation des cytokines favorise l'astrogliose et l'activation microgliale, qui exacerbent le processus neurodégénératif et peuvent être détectées à l'aide de divers tests immunologiques (Jati, 2025).
- À l'âge de 8 mois, ces souris développent une perte neuronale manifeste et une atrophie de l'hippocampe, qui s'étend progressivement à d'autres régions du cerveau telles que le néocortex et le cortex entorhinal à l'âge de 9 mois, comme le révèle l'imagerie par résonance magnétique volumétrique (IRM) (Yoshiyama, 2007). À ce stade, la pathologie se caractérise également par une neuroinflammation généralisée , un dysfonctionnement mitochondrial et une production accrue d'espèces réactives de l'oxygène.
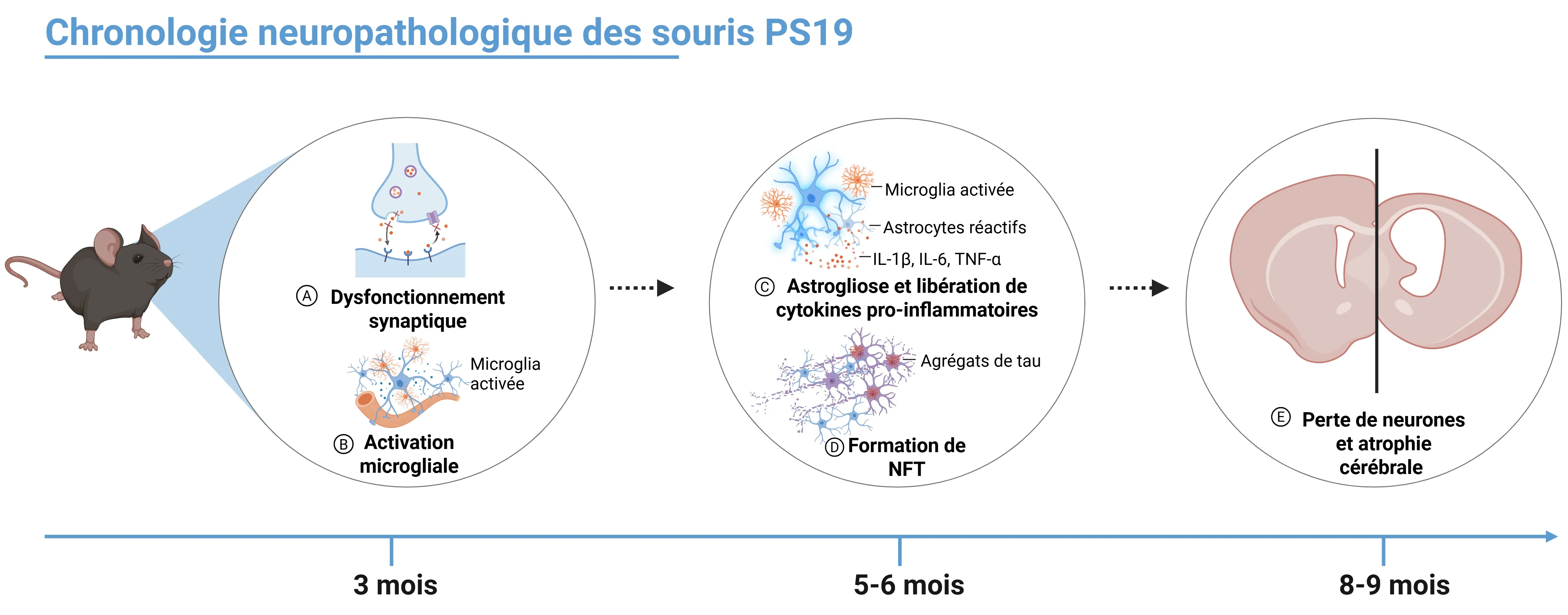
Chronologie de l'apparition des modifications neuropathologiques chez les souris PS19 (P310S).
La pathologie tau chez les souris PS19 peut également être induite expérimentalement par injection stéréotaxique de fibrilles tau préformées (PFF). Lorsqu'elles sont administrées dans l'hippocampe et le cortex sus-jacent, les PFF tau forment rapidement des agrégats de type NFT au site d'injection. Ces agrégats se propagent ensuite vers les régions cérébrales connectées via les réseaux neuronaux ; la pathologie induite ressemble étroitement à la pathologie tau dans la maladie d'Alzheimer (Iba, 2013), présentant des caractéristiques clés telles que:
- Augmentation de la phosphorylation et de l'acétylation de la protéine tau
- structures amyloïdes en feuillets β (Thioflavine S-positives)
- Résistance à la digestion par la protéinase K
Ce profil neuropathologique fait du PS19 un modèle approprié pour le développement de médicaments ciblant la tauopathie dans des maladies telles que la maladie d'Alzheimer et la démence frontotemporale. Il récapitule de nombreuses caractéristiques pathologiques et cliniques de ces tauopathies, ce qui en fait une plateforme précieuse pour la découverte de médicaments visant à modifier les mécanismes liés à la protéine tau.
Chez Biospective, notre administration stéréotaxique de PFF tau humaines recombinantes soniquées ou d'extraits cérébraux dans l'hippocampe et le cortex sus-jacent de souris PS19 contribue à accélérer et à synchroniser l'apparition de la pathologie tau dans ce modèle, par rapport au développement spontané et dépendant de l'âge observé chez les souris PS19 sans injection.
Les résultats neuropathologiques courants peuvent être détectés dans ce modèle à l'aide de:
- L'imagerie par résonance magnétique volumétrique (IRM) pour mesurer l'atrophie cérébrale et l'élargissement ventriculaire
- La coloration, l'imagerie et l'analyse immunohistologiques pour détecter la perte de neurones, l'astrogliose, la microgliose et la propagation de la pathologie tau.
- L'ELISA et les technologies connexes basées sur les immunoessais pour détecter les changements dans la production de cytokines inflammatoires telles que l'IL-1β, l'IL-6 et le TNF-α.
Quels phénotypes cognitifs et moteurs les souris PS19 présentent-elles ?
Les souris PS19 développent des déficits cognitifs et moteurs progressifs qui reproduisent les phénotypes observés dans les tauopathies humaines. Vers l'âge de 6 mois, des déficits cognitifs, notamment au niveau de la mémoire et de l'apprentissage, commencent généralement à apparaître (Ahmad, 2021). Ces troubles peuvent être observés dans des tâches telles que :
- Test de reconnaissance d'objets nouveaux
- Labyrinthe en Y
- Labyrinthe en croix surélevé
- Labyrinthe aquatique de Morris
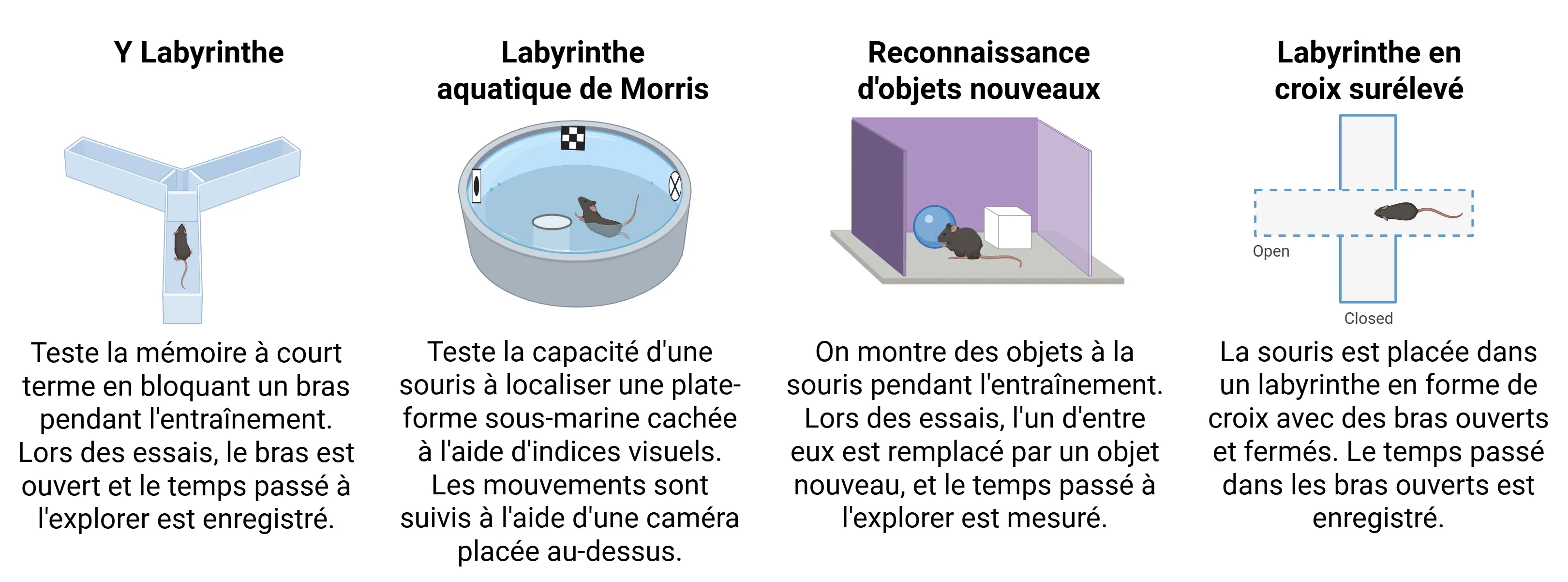
Tests couramment utilisés pour évaluer les changements cognitifs chez les souris PS19.
En plus des déficits cognitifs, les souris PS19 développent des anomalies locomotrices et physiologiques distinctes à mesure que la pathologie tau progresse (Dumont, 2011; Patel, 2022). À l'âge de 9 mois, ces souris présentent une augmentation marquée de l'activité locomotrice associée à une hyperactivité et à une désinhibition comportementale, généralement évaluées à l'aide de divers tests moteurs, notamment :
- Test de force de préhension
- Test en champ libre
- Test du rotarod
- Analyse de la marche/démarche
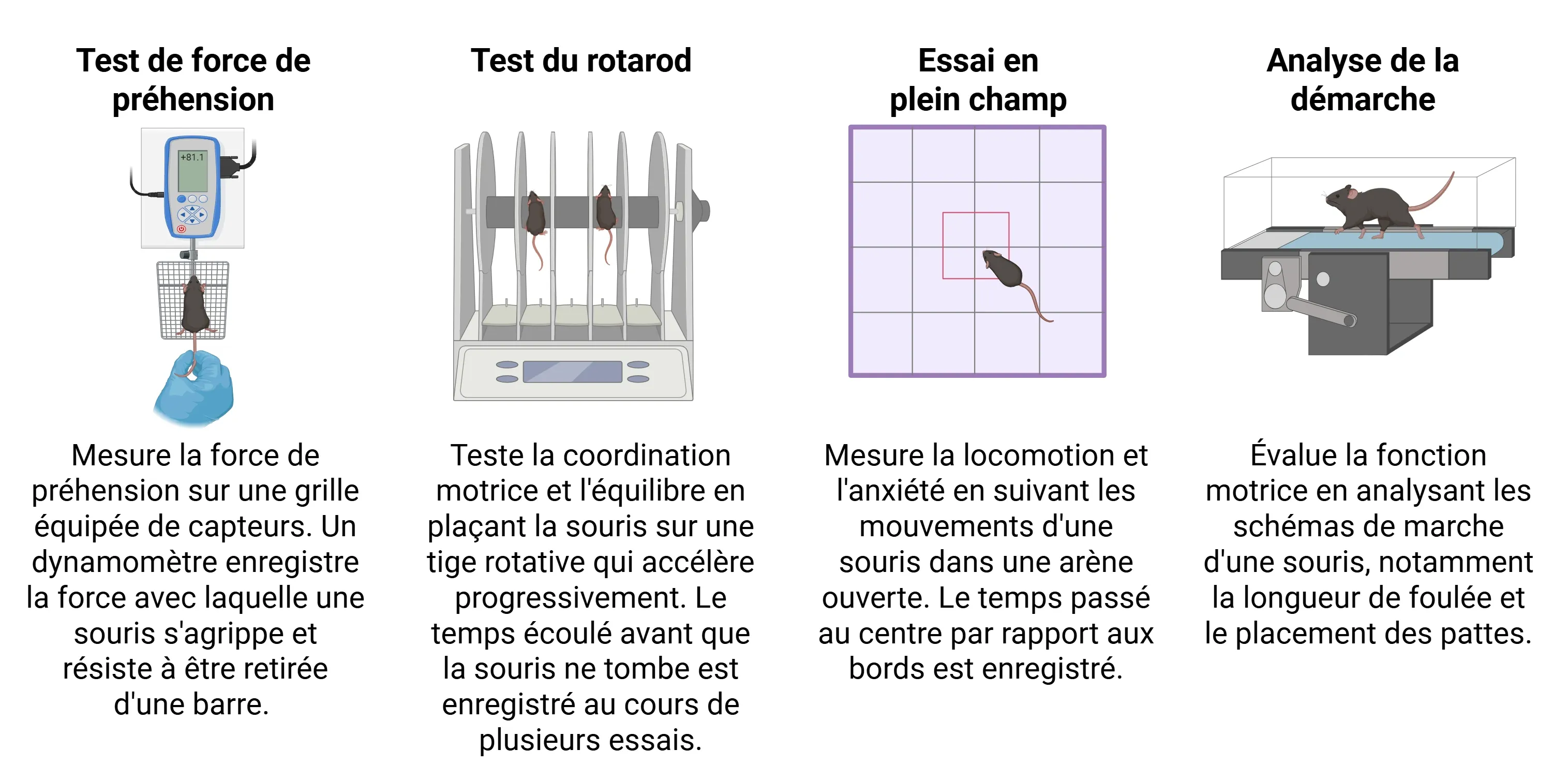
Tests couramment utilisés pour évaluer les phénotypes moteurs chez les souris PS19.
Parallèlement, les souris PS19 commencent à présenter une faiblesse motrice ainsi que des signes évidents de déclin systémique, notamment une perte de poids, une baisse de la température corporelle et une fragilité accrue (Patel, 2022). Ces caractéristiques reflètent l'impact physiologique plus large de la pathologie tau et correspondent étroitement aux aspects de détérioration physique observés dans les tauopathies humaines.
Ces phénotypes cognitifs et moteurs peuvent être encore accélérés et synchronisés par l'injection stéréotaxique de fibrilles préformées de tau (PFF). Lorsque des PFF sont introduites dans l'hippocampe et le cortex sus-jacent, des agrégats de tau matures, semblables à des NFT, se forment dès le premier mois suivant l'injection (Iba, 2015). Les souris PS19 ayant reçu une injection de PFF tau développent des troubles cognitifs plus précoces et plus importants, notamment des déficits de mémoire et d'apprentissage, par rapport aux souris non injectées, chez lesquelles ces déficits apparaissent généralement vers 6 mois. L'administration stéréotaxique de PFF tau entraîne également une perte neuronale plus précoce dans des régions telles que le locus coeruleus et est corrélée à l'apparition prématurée de déficits moteurs.
Ensemble, ces phénotypes cognitifs, comportementaux et moteurs font du modèle PS19 une plateforme puissante pour évaluer les effets des thérapies ciblant la protéine tau.
Notre équipe se fera un plaisir de répondre à toutes vos questions concernant le modèle murin PS19 pour le développement de médicaments ciblant la protéine tau ou de vous fournir des informations spécifiques sur les modèles que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur la neuroinflammation et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de maladies neurodégénératives.
La neuroimagerie dans la démence frontotemporale et les essais cliniques
L'utilité des biomarqueurs d'imagerie IRM et TEP dans notre compréhension des variantes de la démence frontotemporale (DFT) et leur utilisation comme critères d'évaluation dans les essais cliniques sur la DFT.
Biomarqueurs d'imagerie pour la paralysie supranucléaire progressive (PSP)
Aperçu des différentes méthodes d'imagerie cérébrale (IRM, PET, SPECT) disponibles pour évaluer l'efficacité des traitements de fond dans les essais cliniques sur la PSP.
Évolution longitudinale de la TEP Tau dans la MCI et la maladie d'Alzheimer
Vue d'ensemble de l'histoire naturelle de l'évolution de l'absorption et de la fixation du traceur de la TEP Tau dans les troubles cognitifs légers (MCI) et la maladie d'Alzheimer (AD).
Démence frontotemporale (DFT) et atrophie cérébrale par IRM
Biomarqueurs IRM (y compris l'atrophie cérébrale) issus des études FTLDNI sur l'histoire naturelle de la démence frontotemporale (DFT).