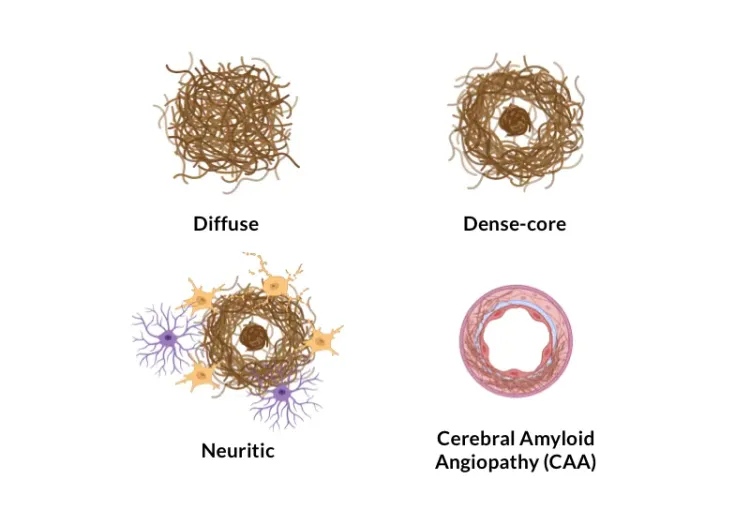
概要
本リソースは、アミロイドβ(Aβ)に起因するアルツハイマー病(AD)病態研究において最も広く用いられている2つのトランスジェニックマウスモデル、すなわち5xFADモデルとAPP/PS1モデルの比較的・機序的概要を提供します。両モデルとも、家族性AD変異を有するヒトAPPおよびPSEN1を過剰発現させ、Aβプラーク形成を促進しますが、病理の進行時期や局在分布、ならびに神経炎症および脳血管プロファイルにおいて著しい差異を示します。
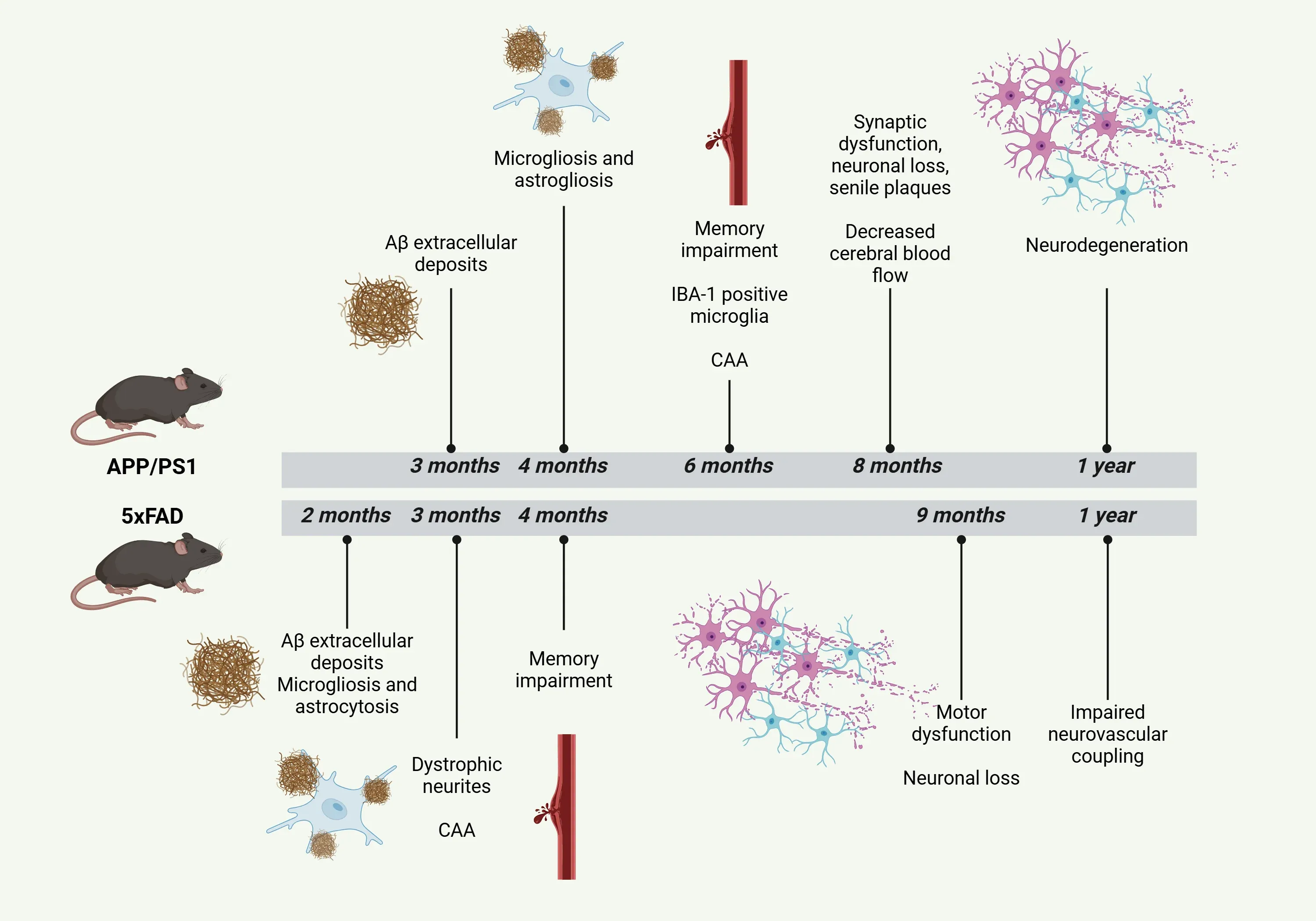
APP/PS1モデルでは、皮質と海馬にAβが局所的に集中して蓄積し、特定の系統では脳血管アミロイド血管症(CAA)を発症しますが、運動行動は比較的安定しています。 一方、5xFADマウスでは、早期から進行性かつ広範なAβ沈着が認められ、それに伴いミクログリア増殖・アストロサイト増殖が急速に進行し、行動障害も生じます。
本比較では、両モデルの遺伝的設計、病理の時間的進行、炎症性および血管性表現型、ARIA研究への関連性(タウ病変の欠如などの制限事項を含む)をまとめ、アルツハイマー病治療研究における情報に基づいたモデル選択を支援します。
APP/PS1および5xFADマウスモデルとは何ですか?
APP/PS1および5xFADマウスモデルは、アミロイドβ(Aβ)病理を加速・増強するように特別に設計された、広く使用されている二重トランスジェニックアルツハイマー病(AD)モデルです。 これらのモデルは、若年性家族性アルツハイマー病(FAD)の原因として知られる変異型ヒトアミロイド前駆体タンパク質(APP)およびプレセニリン1(PSEN1)遺伝子を過剰発現させ、それによって急速なAβプラーク形成を促進します(Sasaguri, 2017;Fang, 2024)。
両モデルとも顕著なAβ沈着を示しますが、以下の点で著しく異なります:
- 遺伝的構成
- 病理進行速度
- Aβプラークの特性
- 神経炎症プロファイル
- 行動障害
重要な点として、これらのモデルではタウ病変は自然発生しません(ただし、Biospective社は高度なアルツハイマー病研究向けにAPP/PS1とヒトタウの共病変モデルを開発しています)。これらの2つのトランスジェニックマウスモデルは、アルツハイマー病の基盤となるメカニズムの解明や新たな治療介入法の検証において、貴重なツールとして機能します。
アルツハイマー病研究におけるAPP/PS1マウスモデルと5xFADマウスモデルの比較概要
| カテゴリー |
APP/PS1 (ARTE10) |
5xFAD |
| 遺伝学 |
|
|
| 疾患の進行 |
|
|
| 主な特徴 |
|
|
APP/PS1および5xFADアルツハイマー病マウスモデルの比較概要。遺伝的背景、アミロイドβ沈着の時間的動態、関連する神経炎症および神経変性マーカー、研究に関連する表現型特徴における主な相違点を強調しています。
アミロイドβ病理、神経炎症、および脳血管変化に関して、両モデルの特徴は何でしょうか?
APP/PS1マウスと5xFADマウスにおけるアミロイドβ病理の違いは何でしょうか?
APP/PS1モデル
- APP/PS1モデルは 、加速された強力なAβ病理を示し、生後3~4ヶ月という早い時期から沈着が認められ、主に大脳皮質と海馬に集中しています(Zhong, 2024)。
- 空間記憶および全体的な認知機能の障害は生後6ヶ月頃に観察されますが、一部の研究では生後17週という早い段階で記憶障害が報告されています(Fang, 2024;Noto, 2025)。
- 組織学的解析により、生後8ヶ月までに緻密で成熟した老人斑の存在が確認されています(Shen, 2018)。
- これらのマウスにおけるAβ沈着は、8~10ヶ月頃にアミロイド斑付近でのシナプス機能障害や軽度の神経細胞喪失など、様々な下流効果と関連しています(Zhong, 2024)。
- 全体として、運動能力は概ね維持されています(Webster, 2013)。
空間病理学の探求:
APP/PS1モデルにおけるAβおよび炎症細胞の詳細な空間解析については、当社のイノベーション「アルツハイマー病APP/PS1マウスモデルにおけるアミロイドβと炎症性微小環境」をご参照ください。
5xFADモデル
- 5xFADモデルでは、2ヶ月齢から脳全体でアミロイド斑が容易に識別可能となり、5ヶ月齢頃に蓄積がピークに達します。ただし、疾患はその後も進行する可能性があります(Oblak, 2021;Bader, 2023;Padua, 2024)。
- 初期の細胞外アミロイド斑は海馬の亜鉤状回および前頭皮質に形成され、その後脳の他の領域へ広がります。IL-1βやTNF-αなどの炎症性サイトカインの増加も観察されます(Fang, 2024)。
- 空間記憶障害は生後4~5ヶ月頃から現れ始めます(Fang, 2024)。
- 運動機能障害は、およそ9ヶ月頃から発現し始めます(Zhong, 2024)。
APP/PS1(ARTE10)トランスジェニックマウスモデルおよび野生型マウスの脳切片を、様々な時点において、Aβ(赤)、Iba-1(緑)、GFAP(紫)、およびDAPI対比染色(青)で染色したものです。
APP/PS1マウスと5xFADマウスにおける神経炎症の違いは何でしょうか?
APP/PS1モデル
- このモデルでは、生後4か月という早い段階でミクログリアおよびアストロサイトの活性化が増加することが観察されています(Zhong, 2024;Fang, 2024)。
- 生後6~7か月までに、海馬のアミロイド沈着周囲を中心に、Iba-1陽性ミクログリア細胞の数が顕著に増加します(Campos, 2023)。
- 多胞体、エンドソーム、リソソームの蓄積が報告されています(Zhong, 2024)。
- 1歳までに線条体における明らかな神経変性が認められます(Fang, 2024)。
- ARTE10モデルは 新規抗ASC免疫療法によるインフラマソーム経路の標的化に用いられています
5xFADモデル
- 5xFADモデルでは、生後2ヶ月で反応性ミクログリアおよびアストロサイトが検出可能です(Padua, 2024)。
- 3ヶ月齢までにジストロフィックな神経突起が出現し始め、生後約4ヶ月齢までにシナプス伝達に明らかな障害が生じます(Padua, 2024)。
- 生後1年までに、皮質および海馬の両方でミクログリア増生およびアストロサイト増生が明らかになります(Oblak, 2021;Fang, 2024)。
- 生後6か月頃にはシナプスの著しい喪失が認められ、生後1年までにニューロンの40%が失われます。ニューロンの健康状態は生後9か月頃までに顕著な低下を示します(Fang, 2024;Padua, 2024)。
- 無関心様行動は、Aβ病理、特に前頭前野および海馬における可溶性Aβ42の存在と正の相関関係が認められています(Keszycki, 2023)。
APP/PS1マウスと5xFADマウスにおける脳血管病理の違いは何でしょうか?
脳アミロイド血管症(CAA)を含む脳血管機能障害は、ADに関連する初期の病原性変化において重要な役割を果たしています。
APP/PS1モデル
- 標準的なAPP/PS1モデルではCAAは限定的にしか見られませんが、特定のモデルではCAAが認められます(Fang, 2024)。ARTE10モデルでは生後9ヶ月までに広範なCAAが観察されます。
- スウェーデン型およびΔE9変異を有するAPP/PS1マウスモデルでは、CAAの発症は生後6か月という早い時期から始まり、広範なプラーク形成とAβ42レベルの上昇を伴います(Noto, 2025)。
- APP/PS1ラットモデル(TgF344)は、スウェーデン型変異とΔE9変異をPrPプロモーターで組み込み、CAA、アミロイド斑、認知障害、神経原線維変化(NFT)を発症します(Fang, 2024)。
- 動脈スピンラベリング(ASL)MRIを用いた8ヶ月齢APP/PS1マウスでは、左海馬、左視床、右皮質における脳血流の低下が確認されており、このアルツハイマー病モデルにおける血管機能障害を示唆しています(Shen, 2018)。
- APP/PS1マウスモデル では、血管壁へのアミロイド沈着により動脈基底膜の完全性と形態が損なわれます。CAAが進行するにつれて、血管平滑筋細胞の被覆率が低下し、血管内膜周囲の排液や血管周囲の脳脊髄液流入を含むAβクリアランス機構が損なわれます(Kim, 2020)。
5xFADモデル
- 全体として、このモデルは一般的に脳血管機能障害が限定的であると見なされています(Fang, 2024)。
- しかしながら、生後3ヶ月という早い段階でCAAが観察されることが報告されています。生後12ヶ月では、脳血流は変化しないものの、神経血管結合の障害が認められます(Fang, 2024)。
APP/PS1および5xFADアルツハイマー病マウスモデルの病理学的特徴の経過
APP/PS1マウスと5xFADマウスにおけるアミロイド関連画像異常(ARIA)のモデル化の違いは何でしょうか?
ARIA(アミロイド関連画像異常)には、浮腫/滲出液(ARIA-E)およびヘモジデローシス/微小出血(ARIA-H)が含まれ、これらは抗βアミロイド抗体治療に関連する有害事象です(Hampel, 2023;Grenon, 2024)。
- これらの異常は、APOE4アレルを保有する個人においてより多く見られます。
- ARIA のほとんどの症例は無症状です。しかし、ARIA は頭痛、錯乱、吐き気、嘔吐、視覚障害や歩行障害などの症状を引き起こす可能性があります。
- ARIAの特定と管理には、MRIによる経過観察が極めて重要です。
- 通常、薬物の調整または中止により、ARIAは3~4か月以内に解消します。
- また、CAA を患っている人間においても、自然発生的な ARIA が発生する可能性があります。
したがって、ARIAの病態生理をより深く理解するためには、動物モデルが不可欠です。
APP/PS1モデル
- ARTE10モデル(生後約9ヶ月)では広範なCAAおよび血管病変が認められるため、抗アミロイド療法(例:免疫療法)の薬理学的研究において、このモデルをARIAの研究に活用する大きな可能性があります。
- 最近の研究では、APOE4遺伝子を有するAPP/PS1モデルを用いて、ADにおける抗アミロイド療法の血管系副作用を調査しています(Grenon, 2024)。
- APP/PS1-21モデルは、バピネウザマブ、3D6、およびABBV-916(N末端が切断され、アミノ酸位置3でピログルタミン酸修飾されたAβ(AβpE3)に結合する臨床段階ヒトIgG1モノクローナル抗体のマウス前駆体)を代表するマウス前駆体mIgG2a抗体による治療時の微小出血を評価するために使用されてきました。 およびABBV-916(アッヴィ社が開発中の、N末端が欠損しアミノ酸位置3でピログルタミン酸修飾を受けたAβ(AβpE3)に結合する臨床段階ヒトIgG1モノクローナル抗体のマウス前駆体)を投与した場合の微小出血を評価するために使用されています(Liao, 2025)。
5xFADモデル
- 本モデルは、文献においてARIA研究に一般的に使用されるものではありません。しかしながら、最近の研究では、APOE4対立遺伝子を発現する5xFADマウスにおける抗APOE(HAE-4)の治療効果が検討されました(Xiong, 2021)。したがって、5xFAD×APOE4二重トランスジェニックモデルは、ARIA事象の研究に利用可能です。
APP/PS1マウスおよび5xFADマウスには神経原線維変化(NFT)は存在しますか?
いずれのモデルも、アルツハイマー病の重要な病理学的特徴である神経原線維変化(NFT)を欠いています。この制限を克服するため、Biospective社はAPP/PS1/hTauアミロイドβとタウの共病理マウスモデルを開発・特性評価しました。詳細は以下をご参照ください:アミロイドβ&タウ共病理マウスモデル(APP/PS1/hTau)。
APP/PS1モデルと5xFADモデルはどのように比較されますか?
| 病理学的特徴 |
APP/PS1 |
5xFAD |
APP/PS1モデルを使用する利点 |
| アミロイド病理 |
|
|
|
| 神経炎症 |
|
|
|
| 脳血管病変 |
|
|
|
| ARIAモデリング |
|
|
|
本表は、APP/PS1モデルと5xFADモデルを、アミロイドβ病理、神経炎症、脳血管病理、ARIAモデリングという4つの主要な病理学的特徴について並列比較したものです。また、各領域におけるAPP/PS1モデルの使用利点についても強調しております。
5xFADマウスおよびAPP/PS1マウスに関するご質問や、治療効果試験に使用するモデルに関する詳細情報につきましては、当チームが喜んでご回答いたします。
当社の神経変性疾患モデルについて、さらに詳しくご覧ください
関連コンテンツ
神経炎症に関する最新情報と、神経変性疾患の動物モデルにおける治療薬評価に関連するベストプラクティスについて。
アルツハイマー病におけるアミロイドβプラーク分析
ヒトおよびアルツハイマー病動物モデル(トランスジェニックマウスおよびラット)の脳組織切片におけるAβプラークの分類および定量化方法の概要。