Résumé
Cette ressource fournit une vue d'ensemble comparative et mécanistique des modèles de souris transgéniques 5xFAD et APP/PS1, deux des modèles les plus largement utilisés pour étudier la pathologie de la maladie d'Alzheimer (MA) induite par l'amyloïde-β. Les deux modèles surexpriment les gènes humains APP et PSEN1 avec des mutations AB familiales afin d'accélérer la formation de plaques Aβ, mais ils diffèrent considérablement en termes de timing et de distribution régionale de la pathologie, ainsi que de profils neuroinflammatoires et cérébrovasculaires.
Le modèle APP/PS1 présente une accumulation régionale concentrée d'Aβ dans le cortex et l'hippocampe, et développe une angiopathie amyloïde cérébrovasculaire (CAA) dans des lignées spécifiques, tout en conservant un comportement moteur relativement stable. En revanche, les souris 5xFAD présentent un dépôt précoce, progressif et généralisé d'Aβ, accompagné d'une apparition rapide de microgliose et d'astrogliose, ainsi que de troubles du comportement.
Cette comparaison résume leur conception génétique, la progression temporelle de la pathologie, les phénotypes inflammatoires et vasculaires, et la pertinence pour les études ARIA - ainsi que les limites telles que l'absence de tauopathie - afin de faciliter le choix éclairé d'un modèle pour la recherche thérapeutique sur la MA.
Que sont les modèles murins APP/PS1 et 5xFAD ?
Les modèles murins APP/PS1 et 5xFAD sont des modèles doublement transgéniques de la maladie d'Alzheimer (MA) largement utilisés, spécialement conçus pour accélérer et intensifier la pathologie amyloïde-β (Aβ). Ces modèles surexpriment les gènes mutés de la protéine précurseur amyloïde humaine (APP) et de la préséniline 1 (PSEN1), connus pour causer la maladie d'Alzheimer familiale à début précoce (FAD), entraînant ainsi une formation rapide de plaques Aβ (Sasaguri, 2017; Fang, 2024).
Bien que les deux modèles présentent un dépôt important d'Aβ, ils diffèrent considérablement par :
- Composition génétique
- Vitesse de développement de la pathologie
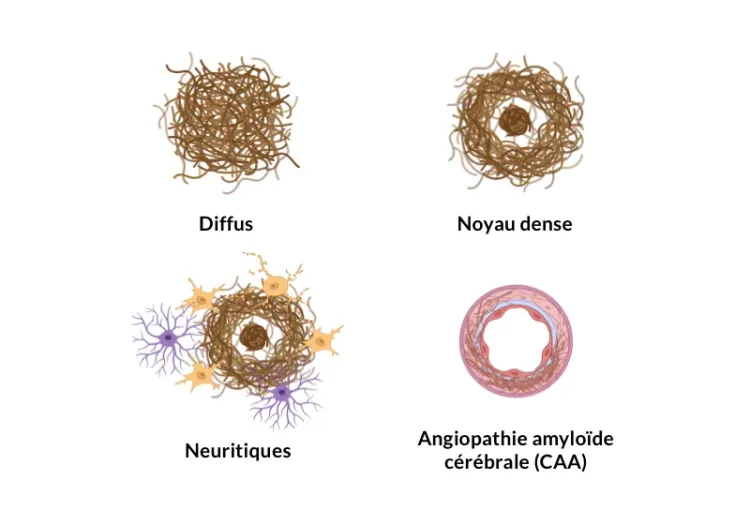
- Caractéristiques des plaques Aβ
- Profil neuroinflammatoire
- Déficits comportementaux
Il est important de noter que la tauopathie ne se développe pas naturellement dans ces modèles (bien que Biospective ait développé un modèle de co-pathologie APP/PS1 et Tau humaine pour la recherche avancée sur la MA). Ces deux modèles de souris transgéniques constituent des outils précieux pour explorer les mécanismes sous-jacents de la MA et tester de nouvelles interventions thérapeutiques.
Aperçu comparatif des modèles murins APP/PS1 et 5xFAD dans la recherche sur la maladie d'Alzheimer
| Catégorie |
APP/PS1 (ARTE10) |
5xFAD |
| Génétique |
|
|
| Progression de la maladie |
|
|
| Caractéristiques principales |
|
|
Aperçu comparatif des modèles murins APP/PS1 et 5xFAD de la maladie d'Alzheimer, mettant en évidence les principales différences en termes de contexte génétique, de dynamique temporelle du dépôt d'amyloïde-β, de résultats neuroinflammatoires et neurodégénératifs associés, et de caractéristiques phénotypiques pertinentes pour la recherche.
Quelles sont les caractéristiques des deux modèles en ce qui concerne la pathologie amyloïde bêta, la neuroinflammation et les modifications cérébrovasculaires?
Quelles sont les différences entre les souris APP/PS1 et 5xFAD en matière de pathologie amyloïde bêta?
Modèle APP/PS1
- Le modèle APP/PS1 présente une pathologie Aβ accélérée et robuste, avec des dépôts apparaissant dès l'âge de 3 à 4 mois, principalement concentrés dans le cortex cérébral et l'hippocampe (Zhong, 2024).
- Des troubles de la mémoire spatiale et de la fonction cognitive globale sont observés vers l'âge de 6 mois, bien que certaines études aient signalé des troubles de la mémoire dès l'âge de 17 semaines (Fang, 2024; Noto, 2025).
- L'analyse histologique montre la présence de plaques séniles denses et matures dès l'âge de 8 mois (Shen, 2018).
- Le dépôt d'Aβ chez ces souris est associé à une série d'effets en aval, notamment un dysfonctionnement synaptique et une perte neuronale mineure près des plaques amyloïdes vers l'âge de 8 à 10 mois (Zhong, 2024).
- Dans l'ensemble, les capacités motrices restent généralement intactes (Webster, 2013).
Explorer la pathologie spatiale :
Pour une analyse spatiale détaillée de l'Aβ et des cellules inflammatoires dans le modèle APP/PS1, veuillez consulter notre article Innovation : Amyloid-β & the Inflammatory Microenvironment in an APP/PS1 Mouse Model of Alzheimer's Disease(Innovation : l'amyloïde-β et le microenvironnement inflammatoire dans un modèle murin APP/PS1 de la maladie d'Alzheimer).
Modèle 5xFAD
- Dans le modèle 5xFAD, les plaques amyloïdes deviennent facilement identifiables dans tout le cerveau à partir de 2 mois, leur accumulation atteignant son pic vers 5 mois, bien que la maladie puisse progresser avec le temps (Oblak, 2021; Bader, 2023; Padua, 2024).
- Les premières plaques amyloïdes extracellulaires se forment dans le subiculum de l'hippocampe et le cortex frontal, puis se propagent à d'autres régions du cerveau. On observe également une augmentation des cytokines pro-inflammatoires, telles que l'IL-1β et le TNF-α(Fang, 2024).
- Les troubles de la mémoire spatiale apparaissent vers 4 à 5 mois (Fang, 2024).
- Les dysfonctionnements moteurs commencent à se développer vers 9 mois (Zhong, 2024).
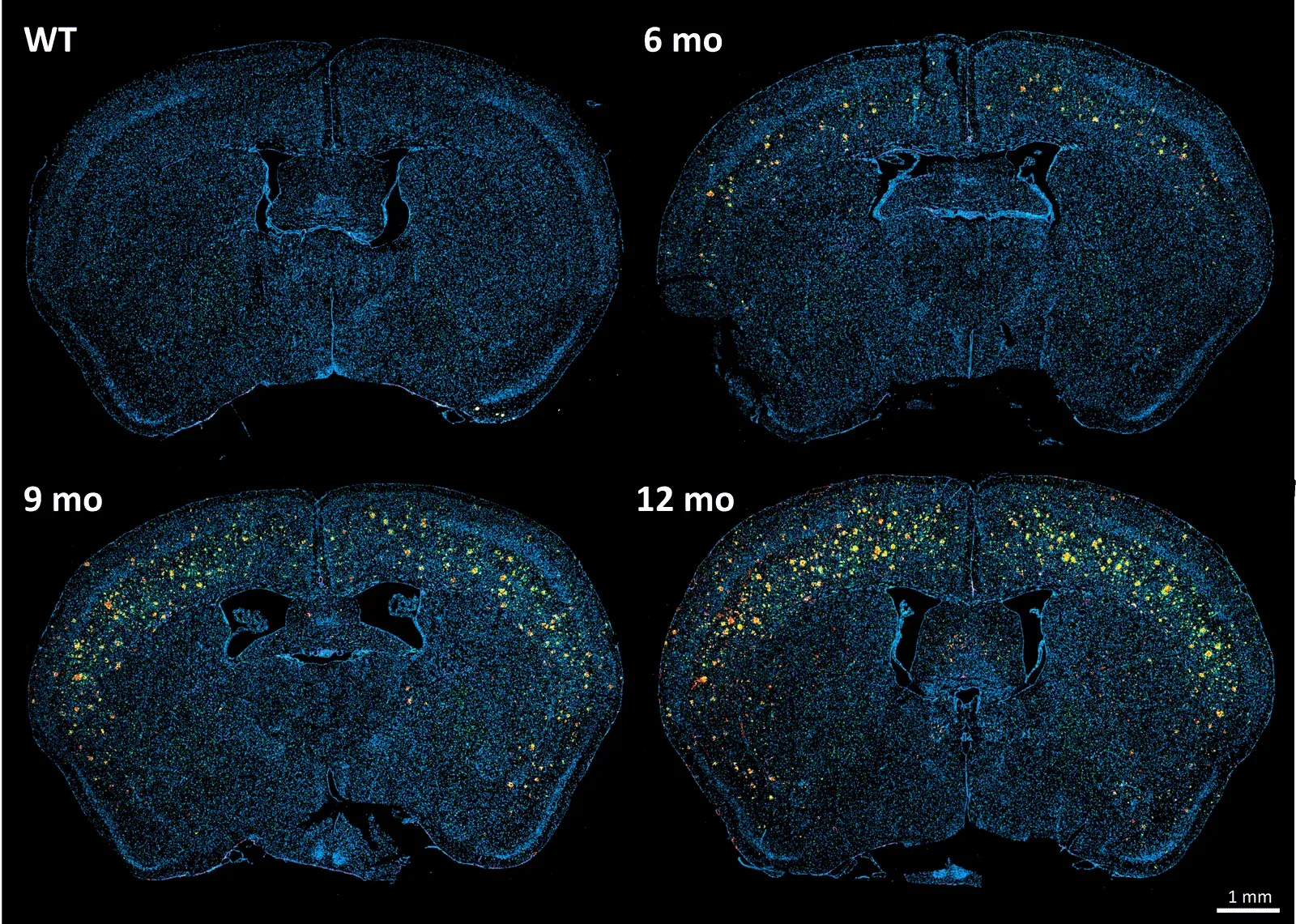
Coupes cérébrales du modèle murin transgénique APP/PS1 (ARTE10) et de souris de type sauvage à différents moments, colorées pour Aβ (rouge), Iba-1 (vert), GFAP (violet) et contre-coloration DAPI (bleu).
Quelles sont les différences en matière de neuroinflammation entre les souris APP/PS1 et 5xFAD ?
Modèle APP/PS1
- Dans ce modèle, on observe une activation accrue des microglies et des astrocytes dès l'âge de 4 mois (Zhong, 2024; Fang, 2024).
- À l'âge de 6-7 mois, on constate une augmentation notable du nombre de cellules microgliales Iba-1 positives, principalement autour des dépôts amyloïdes dans l'hippocampe (Campos, 2023).
- L'accumulation de corps multivésiculaires, d'endosomes et de lysosomes a été rapportée (Zhong, 2024).
- Une neurodégénérescence manifeste dans le striatum est évidente à l'âge d'un an (Fang, 2024).
- Le modèle ARTE10 a été utilisé pour cibler la voie inflammasome avec une nouvelle immunothérapie anti-ASC. cibler la voie inflammasome avec une nouvelle immunothérapie anti-ASC
Modèle 5xFAD
- Dans le modèle 5xFAD, les microglies et les astrocytes réactifs peuvent être détectés dès l'âge de 2 mois (Padua, 2024).
- Les neurites dystrophiques commencent à apparaître à l'âge de 3 mois, entraînant des déficiences observables dans la transmission synaptique vers l'âge de 4 mois (Padua, 2024).
- À l'âge d'un an, la microgliose et l'astrogliose sont évidentes dans le cortex et l'hippocampe (Oblak, 2021; Fang, 2024).
- On observe une perte significative de synapses vers l'âge de 6 mois, entraînant une perte de 40 % des neurones à l'âge d'un an, avec un déclin substantiel de la santé neuronale observé vers l'âge de 9 mois (Fang, 2024; Padua, 2024).
- On a observé que les comportements de type apathique étaient en corrélation positive avec la pathologie Aβ, en particulier la présence d'Aβ42 soluble dans le cortex préfrontal et l'hippocampe (Keszycki, 2023).
Quelles sont les différences entre la pathologie cérébrovasculaire des souris APP/PS1 et 5xFAD ?
Les dysfonctionnements cérébrovasculaires, notamment l'angiopathie amyloïde cérébrale (CAA), jouent un rôle important dans les changements pathogènes initiaux associés à la MA.
Modèle APP/PS1
- Alors que le modèle APP/PS1 standard présente une CAA limitée, certains modèles présentent une CAA (Fang, 2024). Le modèle ARTE10 présente une CAA étendue à l'âge de 9 mois.
- Dans les modèles murins APP/PS1 présentant les mutations suédoise et ΔE9, la CAA peut apparaître dès l'âge de 6 mois, accompagnée d'une formation importante de plaques et de taux élevés d'Aβ42 (Noto, 2025).
- Un modèle de rat APP/PS1 (TgF344) intègre les mutations suédoise et ΔE9 avec un promoteur PrP et développe une CAA, des plaques amyloïdes, des troubles cognitifs et des enchevêtrements neurofibrillaires (NFT) (Fang, 2024).
- Une diminution du débit sanguin cérébral dans l'hippocampe gauche, le thalamus gauche et le cortex droit a été détectée chez des souris APP/PS1 âgées de 8 mois à l'aide d'une IRM par marquage artériel (ASL), indiquant un dysfonctionnement vasculaire dans ce modèle de MA (Shen, 2018).
- Le dépôt d'amyloïde sur la paroi vasculaire perturbe l'intégrité et la morphologie de la membrane basale artérielle dans les modèles murins APP/PS1 . À mesure que l'ACA progresse, on observe une diminution de la couverture des cellules musculaires lisses vasculaires et une altération des mécanismes de clairance de l'Aβ, notamment le drainage périartériel intramural et l'afflux périvasculaire de LCR (Kim, 2020).
Modèle 5xFAD
- Dans l'ensemble, ce modèle est généralement considéré comme présentant un dysfonctionnement cérébrovasculaire limité (Fang, 2024).
- Cependant, il a été rapporté que l'ACA peut être observée dès l'âge de 3 mois. Une altération du couplage neurovasculaire est observée à 12 mois, bien que le débit sanguin cérébral reste inchangé (Fang, 2024).
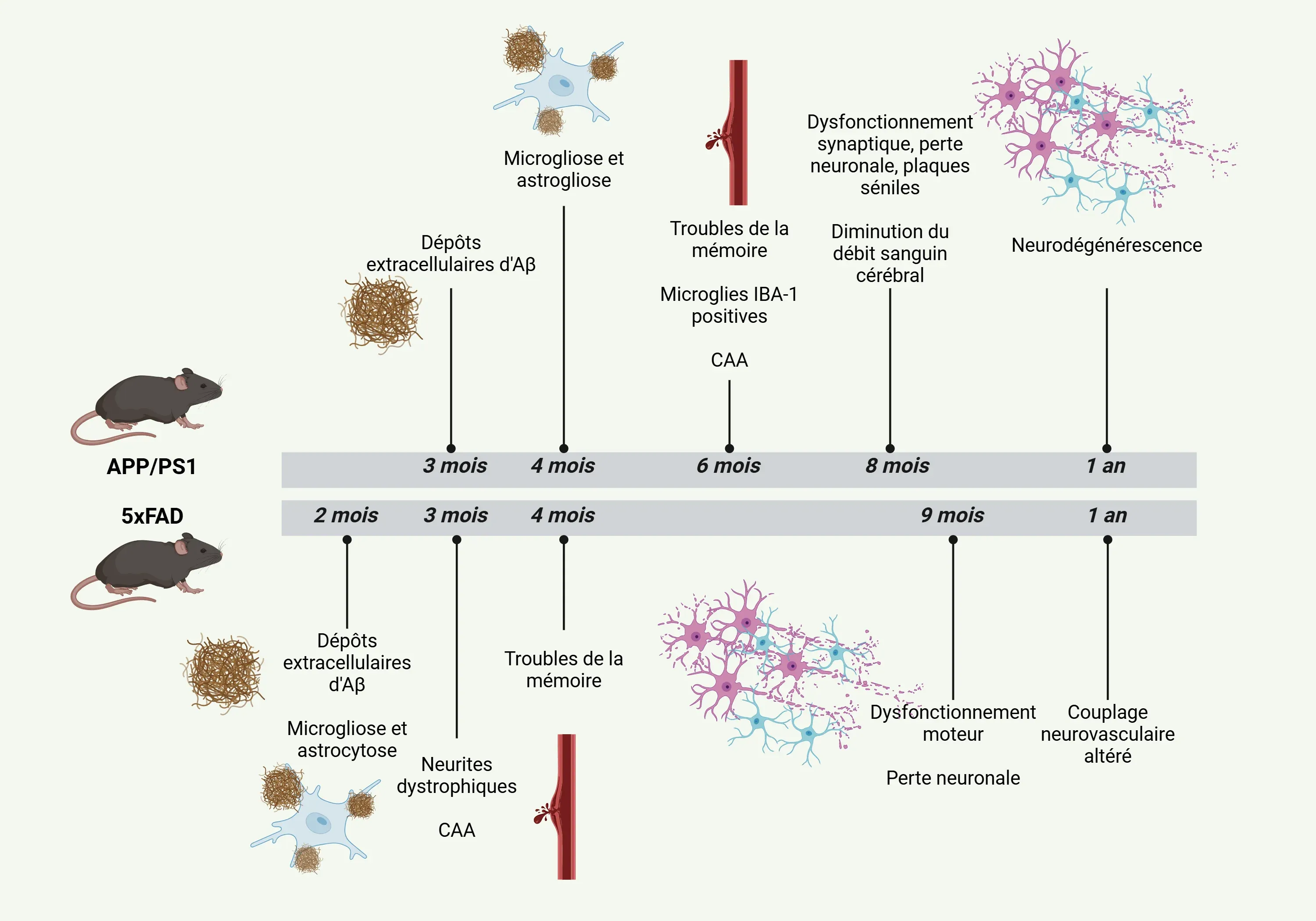
Chronologie des caractéristiques pathologiques des modèles murins APP/PS1 et 5xFAD pour la MA.
Quelles sont les différences entre les modèles d'anomalies d'imagerie liées à l'amyloïde (ARIA) chez les souris APP/PS1 et 5xFAD ?
Les ARIA, qui comprennent l'œdème/épanchement (ARIA-E) et l'hémosidérose/microhémorragie (ARIA-H), sont des événements indésirables associés aux traitements par anticorps anti-Aβ (Hampel, 2023; Grenon, 2024).
- Ces anomalies sont plus fréquentes chez les personnes porteuses de l'allèle APOE4.
- La plupart des cas d'ARIA sont asymptomatiques. Cependant, l'ARIA peut entraîner des symptômes tels que maux de tête, confusion, nausées, vomissements et troubles de la vision et de la marche.
- La surveillance par IRM est essentielle pour identifier et prendre en charge l'ARIA.
- En général, l'ARIA disparaît en 3 à 4 mois grâce à l'ajustement ou à l'arrêt du traitement.
- L'ARIA spontanée peut également survenir chez les personnes atteintes d'CAA.
Par conséquent, les modèles animaux sont essentiels pour mieux comprendre la physiopathologie de l'ARIA.
Modèle APP/PS1
- Compte tenu de la CAA étendue et de la pathologie vasculaire dans le modèle ARTE10 (à environ 9 mois), il existe un potentiel important pour utiliser ce modèle afin d'étudier l'ARIA dans le cadre d'études pharmacologiques sur les traitements anti-amyloïdes (par exemple, l'immunothérapie).
- Des études récentes ont utilisé le modèle APP/PS1 porteur du gène APOE4 pour explorer les effets secondaires vasculaires du traitement anti-amyloïde dans la MA (Grenon, 2024).
- Le modèle APP/PS1-21 a été utilisé pour évaluer les microhémorragies lors d'un traitement avec l'anticorps précurseur murin mIgG2a représentant le bapineuzumab, le 3D6 et ABBV-916, le précurseur murin d'un anticorps monoclonal IgG1 humain en phase clinique qui se lie à l'Aβ tronqué en N-terminal, modifié par le pyroglutamate en position 3 de l'acide aminé, Aβ (AβpE3) en cours de développement par AbbVie (Liao, 2025).
Modèle 5xFAD
- Ce modèle n'est pas couramment utilisé pour les études ARIA dans la littérature. Cependant, une étude récente a examiné les effets thérapeutiques de l'anti-APOE (HAE-4) chez des souris 5xFAD exprimant l'allèle APOE4 (Xiong, 2021). Ainsi, le modèle double transgénique 5xFAD x APOE4 peut être utilisé pour étudier les événements ARIA.
Les enchevêtrements neurofibrillaires (NFT) sont-ils présents chez les souris APP/PS1 et 5xFAD ?
Les deux modèles se caractérisent par l'absence d'enchevêtrements neurofibrillaires (NFT), qui sont des caractéristiques pathologiques cruciales de la MA. Pour surmonter cette limitation, Biospective a développé et caractérisé un modèle murin APP/PS1/hTau présentant une co-pathologie amyloïde bêta et tau, voir : Modèle murin présentant une co-pathologie amyloïde bêta et tau (APP/PS1/hTau).
Comment le modèle APP/PS1 se compare-t-il au modèle 5xFAD ?
| Caractéristique pathologique |
APP/PS1 |
5xFAD |
Avantage de l'utilisation du modèle APP/PS1 |
| Pathologie amyloïde |
|
|
|
| Neuroinflammation |
|
|
|
| Pathologie cérébrovasculaire |
|
|
|
| Modélisation de l'ARIA |
|
|
|
Ce tableau présente une comparaison côte à côte des modèles APP/PS1 et 5xFAD pour quatre caractéristiques pathologiques clés : pathologie amyloïde-β, neuroinflammation, pathologie cérébrovasculaire et modélisation de l'ARIA. Il met également en évidence les avantages de l'utilisation du modèle APP/PS1 dans chacun de ces domaines.
Notre équipe se fera un plaisir de répondre à toutes vos questions concernant les souris 5xFAD et APP/PS1 ou de vous fournir des informations spécifiques sur les modèles que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur la neuroinflammation et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de maladies neurodégénératives.
Amyloïde-β et microenvironnement inflammatoire chez la souris Alzheimer
Nous avons analysé les relations spatiales complexes entre les plaques β-amyloïdes, la microglie activée et au repos, et les astrocytes dans un modèle transgénique APP/PS1.
Analyse des plaques amyloïdes-β dans la maladie d'Alzheimer
Aperçu des méthodes de classification et de quantification des plaques Aβ dans les coupes de tissus cérébraux provenant d'humains et de modèles animaux de la maladie d'Alzheimer (souris et rats transgéniques).
Astrocytes et modèles murins β amyloïde de la maladie d’Alzheimer
L'analyse de la morphologie des astrocytes dans le microenvironnement de la plaque amyloïde-β fournit une mesure sensible de la progression de la maladie chez les souris transgéniques.