摘要
本资源对5xFAD与APP/PS1转基因小鼠模型进行了比较性机制综述——这两种模型是研究β淀粉样蛋白驱动型阿尔茨海默病(AD)病理机制最广泛使用的模型。两种模型均通过过表达携带家族性AD突变的人源APP和PSEN1基因来加速Aβ斑块形成,但在病理进程的时间节点、区域分布特征,以及神经炎症和脑血管病理表现方面存在显著差异。
APP/PS1模型呈现皮层与海马区Aβ的区域性聚集,特定品系会发展为脑血管淀粉样血管病(CAA),但运动行为相对稳定。 相比之下,5xFAD小鼠表现出早期、渐进且广泛的Aβ沉积,伴随小胶质细胞增生、星形胶质细胞增生及行为障碍的快速出现。
本比较总结了两种模型的遗传设计、病理时间进程、炎症与血管表型特征,及其对ARIA研究的相关性——同时指出其局限性(如缺乏tau病变)——以支持阿尔茨海默病治疗研究中明智的模型选择。
APP/PS1与5xFAD小鼠模型是什么?
APP/PS1与5xFAD小鼠模型是广泛应用的双转基因阿尔茨海默病(AD)模型,其设计旨在加速并强化淀粉样β(Aβ)病理进程。 这些模型通过过表达突变型人类淀粉样前体蛋白(APP)和早老素1(PSEN1)——已知会导致早发性家族性阿尔茨海默病(FAD)的基因——从而驱动快速的Aβ斑块形成(Sasaguri, 2017;Fang, 2024)。
尽管两种模型均呈现显著的Aβ沉积,但在以下方面存在显著差异:
- 遗传构成
- 病理发展速度
- β淀粉样斑块特征
- 神经炎症谱
- 行为缺陷
重要的是,这些模型中不会自然发生tau病变(尽管Biospective已开发出APP/PS1与人类tau共病理模型用于晚期阿尔茨海默病研究)。这两种转基因小鼠模型是探索阿尔茨海默病发病机制及测试新型治疗干预措施的宝贵工具。
阿尔茨海默病研究中APP/PS1与5xFAD小鼠模型的比较概述
| 类别 |
APP/PS1 (ARTE10) |
5xFAD |
| 遗传学 |
|
|
| 疾病进展 |
|
|
| 关键特征 |
|
|
APP/PS1与5xFAD阿尔茨海默病小鼠模型的比较综述,重点阐明其遗传背景、淀粉样β沉积时序动态、相关神经炎症与神经退行性病变指标,以及研究相关表型特征的关键差异。
这两种模型在淀粉样β病理、神经炎症和脑血管变化方面具有哪些特征?
APP/PS1小鼠与5xFAD小鼠在β淀粉样蛋白病理方面有何差异?
APP/PS1模型
- APP/PS1模型 表现出加速且强烈的Aβ病理变化,沉积物最早在3至4月龄出现,主要集中于大脑皮层和海马区(Zhong, 2024)。
- 约6个月大时可见空间记忆及整体认知功能障碍,但部分研究指出记忆损伤可早至17周出现(Fang, 2024;Noto, 2025)。
- 组织学分析显示,8 个月时出现密集且成熟的老年斑(Shen,2018)。
- 这些小鼠中的Aβ沉积与一系列下游效应相关,包括突触功能障碍以及在8至10个月左右淀粉样斑块附近出现轻微神经元丧失(Zhong,2024)。
- 总体而言,运动技能通常保持完整(Webster, 2013)。
探索空间病理学:
有关APP/PS1模型中Aβ与炎症细胞的详细空间分析,请参阅我们的创新成果:《阿尔茨海默病APP/PS1小鼠模型中的淀粉样蛋白-β与炎症微环境》。
5xFAD模型
- 在5xFAD模型中,淀粉样斑块自2月龄起即可在全脑范围内清晰识别,其积累在5月龄左右达到峰值,但疾病可能随时间持续进展(Oblak, 2021;Bader, 2023;Padua, 2024)。
- 最初的细胞外淀粉样斑块形成于海马齿状回和额叶皮层,随后扩散至大脑其他区域。同时观察到促炎细胞因子(如IL-1β和 TNF-α)水平升高(Fang, 2024)。
- 空间记忆障碍约在4至5个月时开始显现(Fang, 2024)。
- 运动功能障碍约在9个月时开始显现(Zhong, 2024)。
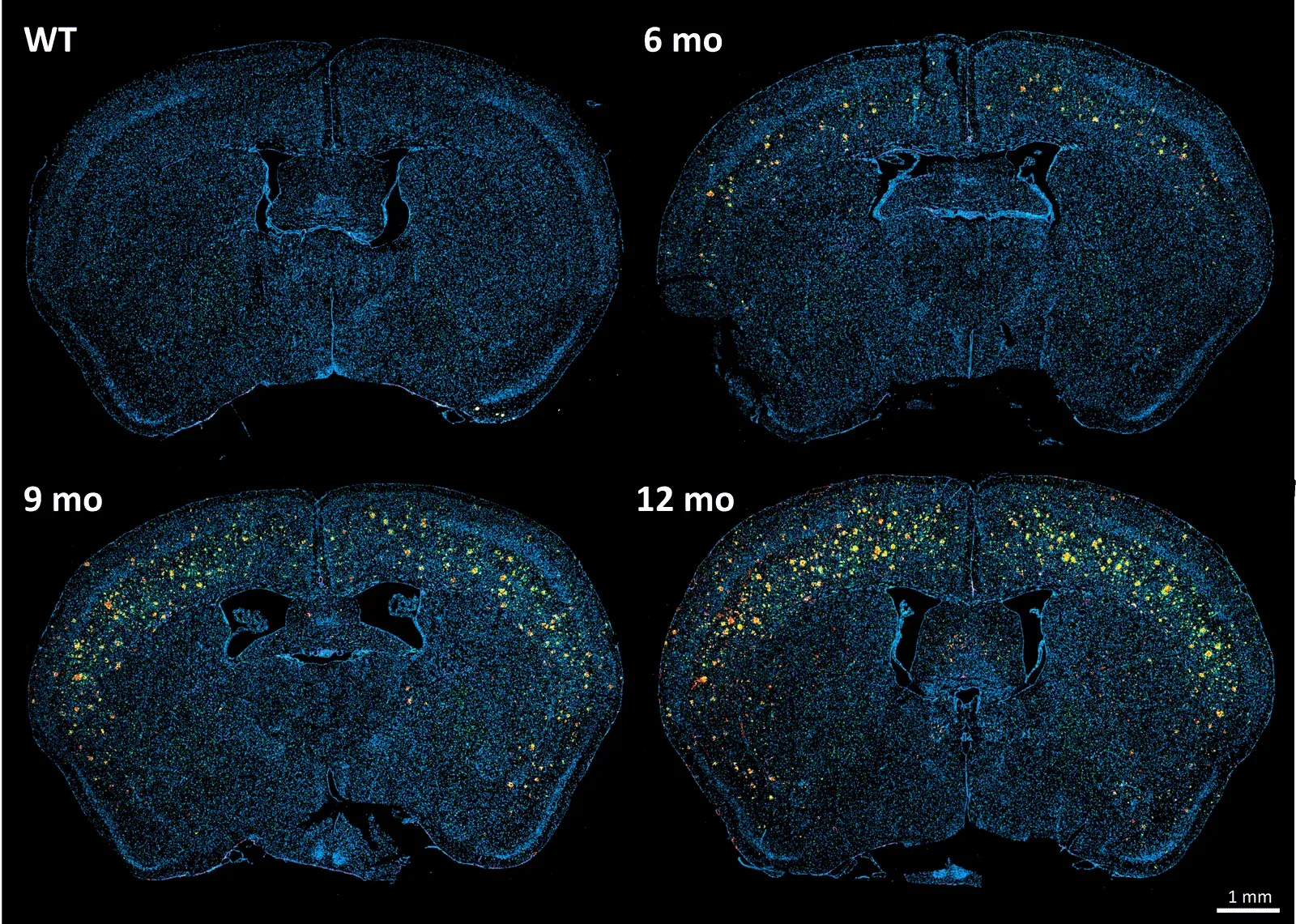
APP/PS1(ARTE10)转基因小鼠模型与野生型小鼠在不同时间点的脑组织切片,经Aβ(红色)、Iba-1(绿色)、GFAP(紫色)及DAPI反染(蓝色)染色。
APP/PS1小鼠与5xFAD小鼠在神经炎症方面有何差异?
APP/PS1模型
- 该模型中,小胶质细胞和星形胶质细胞的活化早在4月龄时即显著增强(Zhong, 2024;Fang, 2024)。
- 到6-7个月时,Iba-1阳性小胶质细胞数量显著增加,主要分布于海马区淀粉样蛋白沉积周围(Campos, 2023)。
- 研究证实存在多囊泡体、内体和溶酶体的聚集(Zhong, 2024)。
- 到1岁时,纹状体出现明显的神经退行性变(Fang, 2024)。
- ARTE10模型已被用于 通过新型抗ASC免疫疗法靶向炎症小体通路
5xFAD模型
- 在5xFAD模型中,2个月大时即可检测到反应性小胶质细胞和星形胶质细胞(Padua, 2024)。
- 3月龄时开始出现营养不良性神经突,约4月龄时可观察到突触传递缺陷(Padua, 2024)。
- 1月龄时,皮质和海马区均出现明显的小胶质细胞增生和星形胶质细胞增生(Oblak, 2021;Fang, 2024)。
- 约6个月时突触显著丧失,导致1岁时神经元损失达40%,约9个月时神经元健康状况明显恶化(Fang, 2024;Padua, 2024)。
- 研究发现,类似冷漠的行为表现与Aβ病理呈正相关,尤其与前额叶皮层和海马区可溶性Aβ42的存在密切相关(Keszycki, 2023)。
APP/PS1与5xFAD小鼠在脑血管病理学上存在哪些差异?
脑血管功能障碍(包括脑淀粉样血管病变)在阿尔茨海默病(AD)的早期病理变化中起着重要作用。
APP/PS1模型
- 标准APP/PS1模型虽表现出有限的CAA,但某些模型会出现CAA(Fang, 2024)。ARTE10模型在9个月龄时已出现广泛CAA。
- 在携带瑞典型和ΔE9突变的APP/PS1小鼠模型中,CAA最早可于6月龄发作,伴随广泛斑块形成及Aβ42水平升高(Noto, 2025)。
- 一种APP/PS1大鼠模型(TgF344)整合了瑞典突变和ΔE9突变,并带有PrP启动子,可发展出动脉粥样硬化、淀粉样斑块、认知障碍和神经原纤维缠结(NFT)(Fang, 2024)。
- 通过动脉自旋标记(ASL)MRI技术检测发现,8月龄APP/PS1小鼠左侧海马体、左侧丘脑及右侧皮层脑血流减少,表明该AD模型存在血管功能障碍(Shen, 2018)。
- 在APP/PS1小鼠模型 中,血管壁上的淀粉样蛋白沉积破坏了动脉基底膜的完整性和形态。随着动脉粥样硬化性脑病(CAA)的进展,血管平滑肌细胞覆盖率降低,Aβ清除机制受损,包括壁内动脉周围引流和血管周围脑脊液流入(Kim, 2020)。
5xFAD模型
- 总体而言,该模型通常被认为具有有限的脑血管功能障碍(Fang, 2024)。
- 但研究显示,该模型3月龄即可观察到脑动脉粥样硬化(CAA),12月龄出现神经血管耦合功能障碍,尽管此时脑血流量保持稳定(Fang, 2024)。
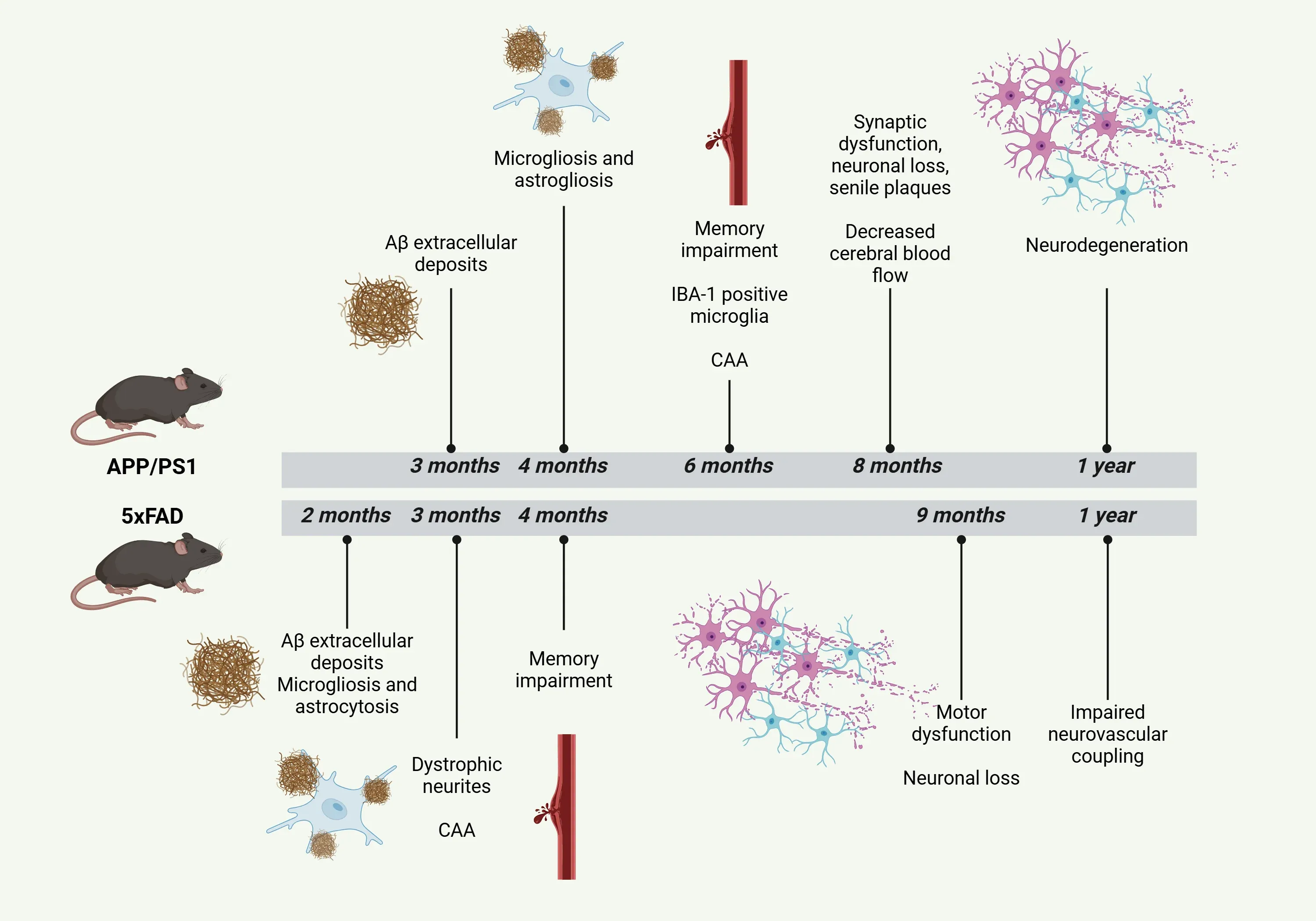
APP/PS1和小鼠模型5xFAD的病理特征时间线。
APP/PS1小鼠与5xFAD小鼠在淀粉样蛋白相关成像异常(ARIA)建模方面存在哪些差异?
ARIA包括水肿/渗出(ARIA-E)和含铁血黄素沉着/微出血(ARIA-H),是抗Aβ抗体治疗相关的不良事件(Hampel, 2023;Grenon, 2024)。
- 携带APOE4等位基因的个体更易出现此类异常。
- 多数ARIA病例无症状表现。但该异常可能引发头痛、意识模糊、恶心呕吐、视力障碍及步态异常等症状。
- 磁共振成像监测对识别和管理ARIA至关重要。
- 通常通过调整或停用药物,ARIA可在3至4个月内自行消退。
- 在患有脑动脉粥样硬化的患者中,也可能出现自发性ARIA。
因此,动物模型对于深入理解ARIA的病理生理学至关重要。
APP/PS1模型
- 鉴于ARTE10模型(约9月龄)存在广泛的脑动脉硬化和血管病理改变,该模型在抗淀粉样蛋白疗法(如免疫疗法)的药理学研究中具有显著潜力用于研究ARIA。
- 近期研究采用携带APOE4基因的 APP/PS1模型,探索AD中抗淀粉样蛋白疗法的血管副作用(Grenon, 2024)。
- APP/PS1-21模型已被用于评估小鼠前体mIgG2a抗体(代表巴匹那单抗、3D6及ABBV-916)治疗时的微出血情况。 以及ABBV-916(艾伯维公司研发的临床阶段人源化IgG1单克隆抗体小鼠前体,可结合N端截短且第3位氨基酸发生焦谷氨酸修饰的Aβ(AβpE3))(Liao, 2025)。
5xFAD模型
- 该模型在文献中不常用于ARIA研究。但近期研究考察了抗APOE(HAE-4)抗体在表达APOE4等位基因的5xFAD小鼠中的治疗效果(Xiong, 2021)。因此,5xFAD×APOE4双转基因模型可用于研究ARIA事件。
APP/PS1和小鼠和5xFAD小鼠是否存在神经原纤维缠结(NFTs)?
这两种模型均缺乏神经原纤维缠结(NFTs),而该结构是AD的关键病理特征。为克服此局限,Biospective公司开发并表征了APP/PS1/hTau淀粉样β与tau蛋白共病理小鼠模型,详见:淀粉样β与tau蛋白共病理小鼠模型(APP/PS1/hTau)。
APP/PS1模型与5xFAD模型有何异同?
| 病理特征 |
APP/PS1 |
5xFAD |
使用APP/PS1模型的优势 |
| 淀粉样病理 |
|
|
|
| 神经炎症 |
|
|
|
| 脑血管病理 |
|
|
|
| ARIA模型 |
|
|
|
下表通过四项关键病理特征——β淀粉样蛋白病理、神经炎症、脑血管病理及ARIA建模——对APP/PS1与5xFAD模型进行并列比较,同时突显了在各领域使用APP/PS1模型的优势。
我们的团队很乐意解答关于5xFAD及APP/PS1小鼠的任何问题,或提供我们用于治疗有效性研究的模型相关具体信息。
了解更多关于我们的神经退行性疾病模型
相关内容
关于神经炎症的最新信息,以及在神经退行性疾病动物模型中评估治疗药物的最佳实践。
阿尔茨海默氏症中的淀粉样蛋白斑块分析
人类和阿尔茨海默病动物模型(转基因小鼠和大鼠)脑组织切片中的Aβ斑块分类和量化方法概述。