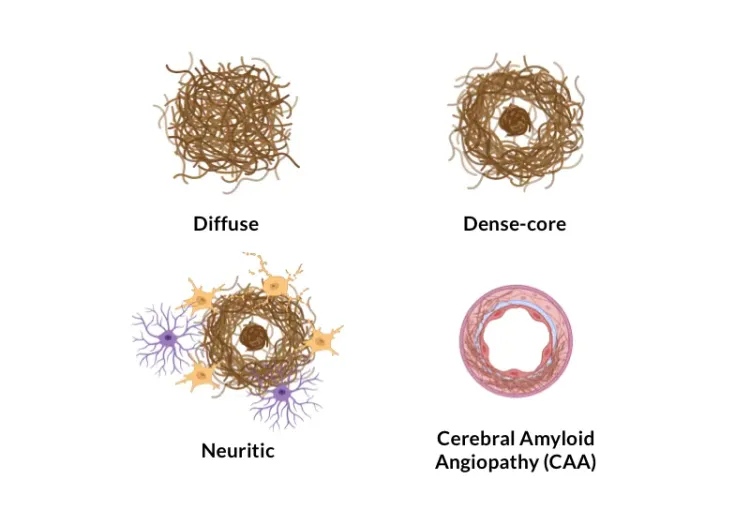
요약
본 자료는 아밀로이드-β에 의한 알츠하이머병(AD) 병리 연구에 가장 널리 사용되는 두 가지 모델인 5xFAD 및 APP/PS1 트랜스제닉 마우스 모델에 대한 비교적, 기전적 개요를 제공합니다. 두 모델 모두 가족성 AB 돌연변이를 가진 인간 APP 및 PSEN1을 과발현하여 Aβ 플라크 형성을 촉진하지만, 병리의 발생 시기 및 지역적 분포, 신경염증 및 뇌혈관 프로파일에서 상당한 차이를 보입니다.
APP/PS1 모델은 피질과 해마에 Aβ가 국소적으로 집중 축적되며, 특정 계통에서는 뇌혈관 아밀로이드 혈관병증(CAA)이 발생하지만 운동 기능은 비교적 안정적으로 유지됩니다. 반면 5xFAD 마우스는 조기부터 진행성으로 광범위한 Aβ 침착이 나타나며, 미세아교세포증 및 성상교세포증의 급속한 발현과 행동 장애를 동반합니다.
본 비교 연구는 유전적 설계, 병리의 시간적 진행, 염증 및 혈관 표현형, ARIA 연구와의 관련성(타우병증 부재 등의 한계 포함)을 종합하여 알츠하이머병 치료 연구를 위한 정보 기반 모델 선택을 지원합니다.
APP/PS1 및 5xFAD 마우스 모델이란 무엇인가요?
APP/PS1 및 5xFAD 마우스 모델은 널리 사용되는 이중 형질 전환 알츠하이머병(AD) 모델로, 아밀로이드-β(Aβ) 병리를 가속화하고 강화하도록 특별히 설계되었습니다. 이 모델들은 조기 발병 가족성 알츠하이머병(FAD)을 유발하는 것으로 알려진 돌연변이 인간 아밀로이드 전구체 단백질(APP) 및 프레세닐린 1(PSEN1) 유전자를 과발현하여, 신속한 Aβ 플라크 형성을 유도합니다(Sasaguri, 2017; Fang, 2024).
두 모델 모두 강력한 Aβ 침착을 보이지만, 다음과 같은 측면에서 현저한 차이를 보입니다:
- 유전적 구성
- 병리 발달 속도
- Aβ 플라크 특성
- 신경염증 프로파일
- 행동 장애
중요한 점은, 이러한 모델에서는 타우병증이 자연적으로 발생하지 않는다는 것입니다(비오스펙티브(Biospective)가 진행성 알츠하이머병 연구를 위한 APP/PS1 및 인간 타우 병리 병발 모델을 개발한 경우는 제외). 이 두 가지 형질전환 마우스 모델은 알츠하이머병의 근본적인 기전을 탐구하고 새로운 치료적 중재를 시험하는 데 유용한 도구로 활용됩니다.
알츠하이머병 연구에서 APP/PS1 및 5xFAD 마우스 모델의 비교 개요
| 카테고리 |
APP/PS1 (ARTE10) |
5xFAD |
| 유전학 |
|
|
| 질병 진행 |
|
|
| 주요 특징 |
|
|
APP/PS1 및 5xFAD 알츠하이머병 마우스 모델 비교 개요: 유전적 배경, 아밀로이드-β 침착의 시간적 역학, 연관된 신경염증 및 신경퇴행성 지표, 연구 관련 표현형 특징의 주요 차이점 강조.
두 모델의 아밀로이드-베타 병리, 신경염증 및 뇌혈관 변화와 관련된 특징은 무엇인가?
APP/PS1 마우스와 5xFAD 마우스 간 아밀로이드-β 병리의 차이점은 무엇인가요?
APP/PS1 모델
- APP/PS1 모델은 가속화되고 강력한 Aβ 병리를 보이며, 주로 대뇌 피질과 해마에 집중된 침착물이 생후 3~4개월이라는 이른 시기에 나타납니다 (Zhong, 2024).
- 일부 연구에서는 17주라는 조기에 기억력 장애가 보고되기도 했지만(Fang, 2024; Noto, 2025), 공간 기억 및 전반적인 인지 기능 장애는 생후 6개월 경에 관찰됩니다.
- 조직학적 분석에 따르면 생후 8개월이 되면 조밀하고 성숙한 노인성 플라크가 존재하는 것으로 나타났습니다(Shen, 2018).
- 이 마우스에서 Aβ 침착은 8~10개월 경에 시냅스 기능 장애 및 아밀로이드 플라크 근처의 경미한 신경 세포 손실을 포함한 일련의 하류 효과와 관련이 있습니다 (Zhong, 2024).
- 전반적으로 운동 능력은 대체로 정상적으로 유지됩니다 (Webster, 2013).
공간 병리학 탐구:
APP/PS1 모델에서 Aβ 및 염증 세포에 대한 상세한 공간 분석은 당사의 혁신: 알츠하이머병 APP/PS1 마우스 모델에서 아밀로이드-β 및 염증 미세환경을 참조하십시오.
5xFAD 모델
- 5xFAD 모델에서는 2개월부터 뇌 전체에 걸쳐 아밀로이드 플라크가 쉽게 식별 가능해지며, 5개월경에 축적이 정점에 달하지만, 질병은 시간이 지남에 따라 진행될 수 있습니다(Oblak, 2021; Bader, 2023; Padua, 2024).
- 초기 세포외 아밀로이드 플라크는 해마의 서브이쿨럼과 전두엽 피질에서 형성된 후 뇌의 다른 영역으로 확산됩니다. IL-1β 및 TNF-α와 같은 전염증성 사이토카인의 증가도 관찰됩니다 (Fang, 2024).
- 공간 기억 장애는 약 4~5개월 경에 시작됩니다(Fang, 2024).
- 운동 기능 장애는 약 9개월 경부터 발생하기 시작한다 (Zhong, 2024).
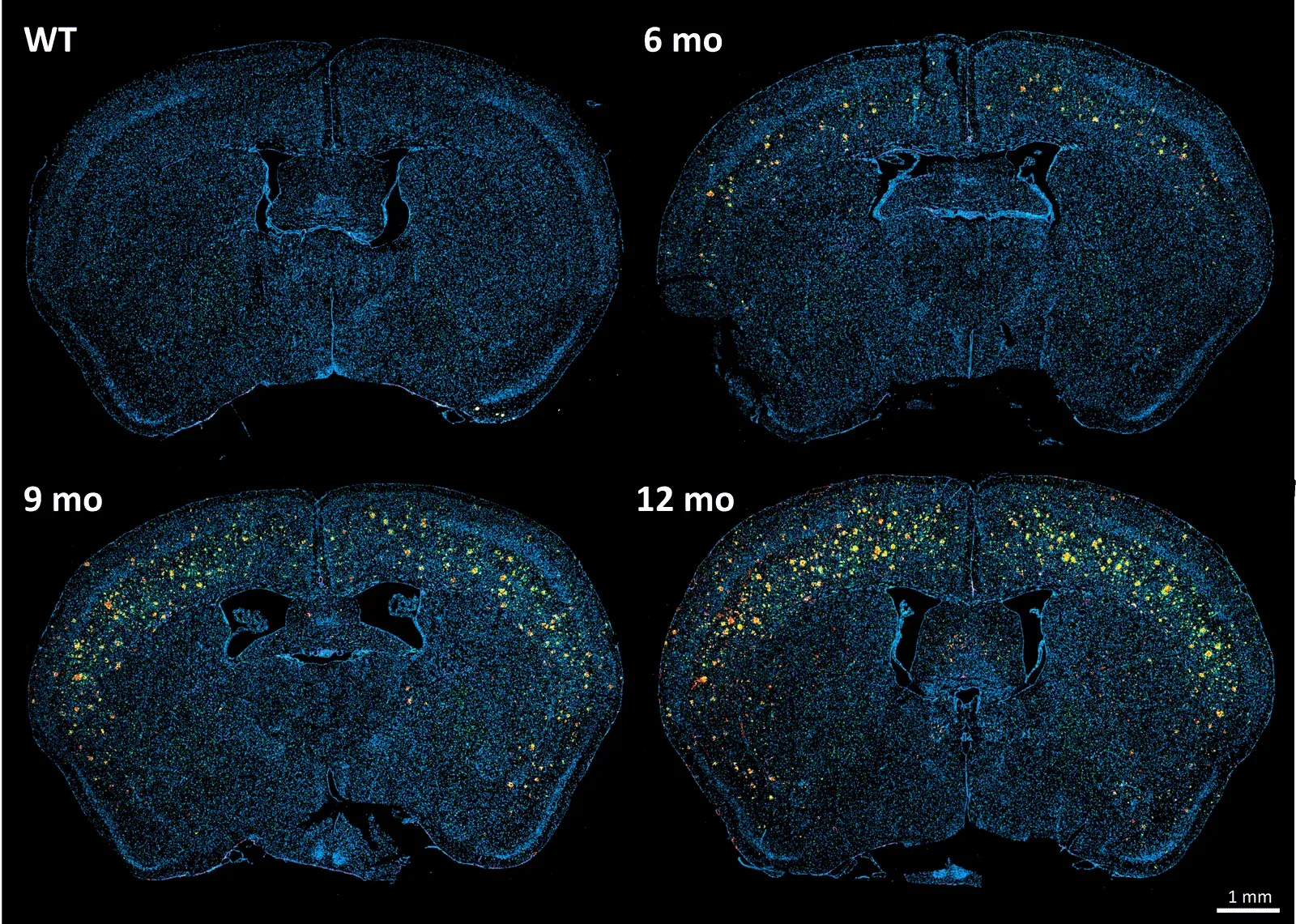
APP/PS1 (ARTE10) 트랜스제닉 마우스 모델과 야생형 마우스의 뇌 조직 절편을 다양한 시점에서 채취하여, Aβ (빨강), Iba-1 (초록), GFAP (보라), DAPI 대조염색 (파랑)으로 염색한 모습.
APP/PS1 마우스와 5xFAD 마우스 간 신경염증의 차이점은 무엇인가?
APP/PS1 모델
- 이 모델에서는 생후 4개월이라는 이른 시점부터 미세아교세포와 성상세포의 활성화 증가가 관찰됩니다(Zhong, 2024; Fang, 2024).
- 6~7개월이 되면, 주로 해마의 아밀로이드 침착물 주변에서 Iba-1 양성 미세아교세포의 수가 현저하게 증가합니다 (Campos, 2023).
- 다중 소포체, 소포체 및 리소좀의 축적이 보고되었습니다 (Zhong, 2024).
- 1세에는 선명하게 선조체에서 신경 퇴행이 나타납니다 (Fang, 2024).
- ARTE10 모델은 새로운 항-ASC 면역요법으로 인플라마좀 경로를 표적화하는 데 사용되었습니다.
5xFAD 모델
- 5xFAD 모델에서는 생후 2개월에 반응성 미세아교세포 및 성상세포를 검출할 수 있다(Padua, 2024).
- 3개월이 지나면 영양 장애성 신경 돌기가 나타나기 시작하여, 생후 약 4개월이 되면 시냅스 전달의 결함을 관찰할 수 있다 (Padua, 2024).
- 1년령이 되면 피질과 해마 모두에서 미세아교세포증과 성상세포증이 뚜렷하게 나타납니다 (Oblak, 2021; Fang, 2024).
- 생후 6개월 경에는 시냅스가 현저히 감소하여 1년 차에는 뉴런의 40%가 소실되며, 생후 약 9개월 경에는 뉴런 건강도가 크게 저하되는 것이 관찰됩니다 (Fang, 2024; Padua, 2024).
- 무관심과 유사한 행동은 Aβ 병리, 특히 전전두엽 피질과 해마에서 용해성 Aβ42의 존재와 양의 상관관계가 있는 것으로 관찰되었습니다 (Keszycki, 2023).
APP/PS1 마우스와 5xFAD 마우스의 뇌혈관 병리학적 차이는 무엇인가?
뇌 아밀로이드 혈관병증(CAA)을 포함한 뇌혈관 기능 장애는 AD와 관련된 초기 병리학적 변화에 중요한 역할을 합니다.
APP/PS1 모델
- 표준 APP/PS1 모델은 제한적인 CAA를 보이지만, 특정 모델은 CAA를 나타냅니다(Fang, 2024). ARTE10 모델은 생후 9개월에 광범위한 CAA를 보입니다.
- 스웨덴형 및 ΔE9 돌연변이를 가진 APP/PS1 마우스 모델에서는 CAA가 생후 6개월부터 시작될 수 있으며, 광범위한 플라크 형성과 Aβ42 수치 상승이 동반됩니다(Noto, 2025).
- APP/PS1 쥐 모델(TgF344)은 스웨덴형 및 ΔE9 돌연변이와 PrP 프로모터를 통합하여 CAA, 아밀로이드 플라크, 인지 장애 및 신경섬유 엉킴(NFT)을 발병합니다(Fang, 2024).
- 동맥 스핀 라벨링(ASL) MRI를 이용한 8개월령 APP/PS1 마우스에서 좌측 해마, 좌측 시상, 우측 피질의 뇌혈류 감소가 관찰되어 이 AD 모델에서 혈관 기능 장애를 시사한다(Shen, 2018).
- 혈관벽에 아밀로이드가 침착되면 APP/PS1 마우스 모델에서 동맥 기저막의 무결성과 형태가 파괴됩니다. CAA가 진행됨에 따라 혈관 평활근 세포의 피복이 감소하고, 동맥 내벽 배액 및 혈관 주위 뇌척수액 유입을 포함한 Aβ 제거 메커니즘이 손상됩니다 (Kim, 2020).
5xFAD 모델
- 전반적으로, 이 모델은 일반적으로 제한된 뇌혈관 기능 장애를 가지고 있는 것으로 간주됩니다 (Fang, 2024).
- 그러나 생후 3개월이라는 이른 시점부터 CAA가 관찰될 수 있다는 보고가 있다. 12개월 시점에서는 신경혈관 결합 기능 장애가 관찰되지만, 뇌혈류는 변함이 없다(Fang, 2024).
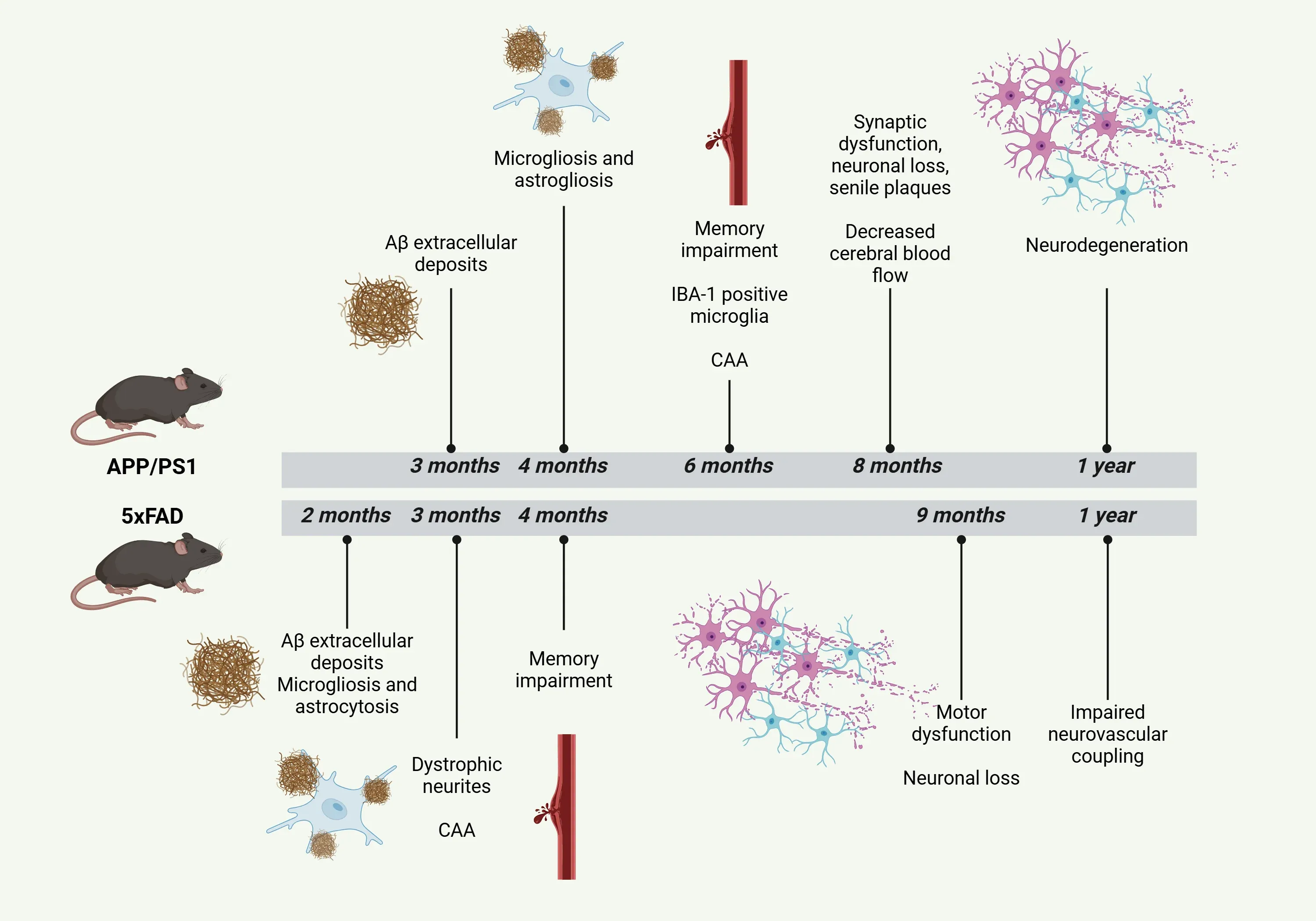
APP/PS1 및 5xFAD 알츠하이머병 마우스 모델의 병리학적 특성 시간대
APP/PS1 마우스와 5xFAD 마우스 간 아밀로이드 관련 영상 이상(ARIA) 모델링의 차이점은 무엇인가?
ARIA에는 부종/삼출(ARIA-E) 및 혈색소증/미세출혈(ARIA-H)이 포함되며, 이는 항-Aβ 항체 치료와 관련된 부작용입니다(Hampel, 2023; Grenon, 2024).
- 이러한 이상 증상은 APOE4 대립 유전자를 보유한 개인에게서 더 흔하게 나타납니다.
- 대부분의 ARIA 사례는 무증상입니다. 그러나 ARIA는 두통, 혼돈, 메스꺼움, 구토, 시력 및 보행 장애와 같은 증상을 유발할 수 있습니다.
- ARIA를 확인하고 관리하기 위해서는 MRI 모니터링이 매우 중요합니다.
- 일반적으로 ARIA는 약물 조정 또는 중단을 통해 3~4개월 이내에 해결됩니다.
- CAA가 있는 사람에게도 자발적인 ARIA가 발생할 수 있습니다.
따라서 ARIA의 병리 생리학을 더 깊이 이해하기 위해서는 동물 모델이 필수적입니다.
APP/PS1 모델
- ARTE10 모델(생후 약 9개월)에서 광범위한 CAA 및 혈관 병리가 관찰되므로, 이 모델을 활용하여 항아밀로이드 치료법(예: 면역요법)의 약리학적 연구에서 ARIA를 연구할 가능성이 매우 높습니다.
- 최근 연구에서는 APOE4 유전자를 보유한 APP/PS1 모델을 사용하여 AD에서 항아밀로이드 치료의 혈관 부작용을 탐구했습니다(Grenon, 2024).
- APP/PS1-21 모델은 Bapineuzumab, 3D6 및 ABBV-916을 대표하는 생쥐 전구체 mIgG2a 항체로 치료할 때 미세출혈을 평가하는 데 사용되었습니다. 및 AbbVie에서 개발 중인 N-말단 절단, 아미노산 위치 3에서 피로글루타메이트 변형된 Aβ(AβpE3)에 결합하는 임상 단계 인간 IgG1 단일클론 항체의 생쥐 전구체인 ABBV-916을 투여했을 때의 미세출혈을 평가하는 데 사용되었다(Liao, 2025).
5xFAD 모델
- 이 모델은 문헌상 ARIA 연구에 흔히 사용되지 않습니다. 그러나 최근 연구에서는 APOE4 대립유전자를 발현하는 5xFAD 마우스에서 항-APOE(HAE-4)의 치료 효과를 조사했습니다(Xiong, 2021). 따라서 5xFAD x APOE4 이중 트랜스제닉 모델을 ARIA 사건 연구에 활용할 수 있습니다.
APP/PS1 및 5xFAD 마우스에 신경섬유 엉킴(NFTs) 이 존재하는가?
두 모델 모두 AD의 핵심 병리학적 특징인 신경섬유 엉킴(NFTs)이 존재하지 않는 것이 특징입니다. 이러한 한계를 극복하기 위해 Biospective는 APP/PS1/hTau 아밀로이드 베타 및 타우 병리 병발 마우스 모델을 개발 및 특성화하였습니다. 참조: 아밀로이드 베타 & 타우 병리 병발 마우스 모델 (APP/PS1/hTau).
APP/PS1 모델과 5xFAD 모델은 어떻게 비교되나요?
| 병리학적 특징 |
APP/PS1 |
5xFAD |
APP/PS1 모델 사용의 장점 |
| 아밀로이드 병리 |
|
|
|
| 신경 염증 |
|
|
|
| 뇌혈관 병리 |
|
|
|
| ARIA 모델링 |
|
|
|
이 표는 아밀로이드-β 병리, 신경염증, 뇌혈관 병리, ARIA 모델링이라는 네 가지 주요 병리학적 특징에 대해 APP/PS1과 5xFAD 모델을 나란히 비교한 것입니다. 또한 각 영역에서 APP/PS1 모델 사용의 장점을 강조하고 있습니다.
저희 팀은 5xFAD 및 APP/PS1 마우스에 관한 모든 질문에 기꺼이 답변해 드리며, 치료 효능 연구에 사용하는 모델에 대한 구체적인 정보도 제공해 드릴 수 있습니다.
신경퇴행성 질환 모델에 대해 자세히 알아보기
관련 콘텐츠
신경염증에 관한 최신 정보 및 신경퇴행성 질환 동물 모델에서 치료제 평가와 관련된 모범 사례.
알츠하이머병의 아밀로이드-베타 플라크 분석
인간과 알츠하이머병 동물 모델(유전자 변형 쥐와 랫트)의 뇌 조직 섹션에서 Aβ 플라크를 분류하고 정량화하는 방법의 개요.