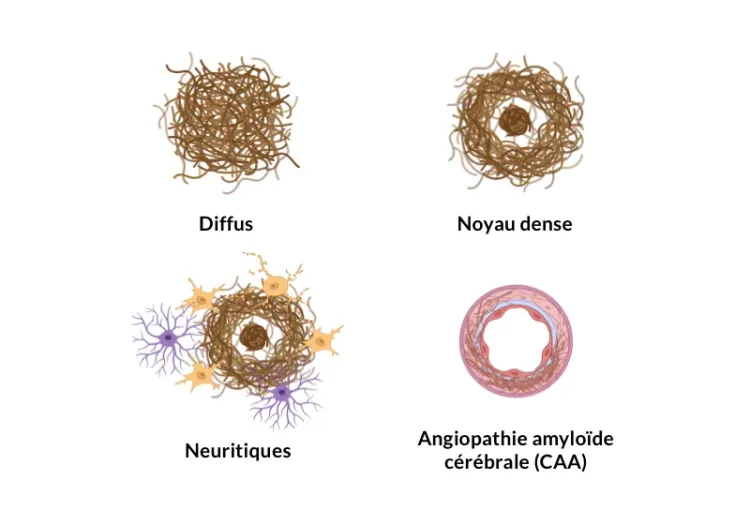
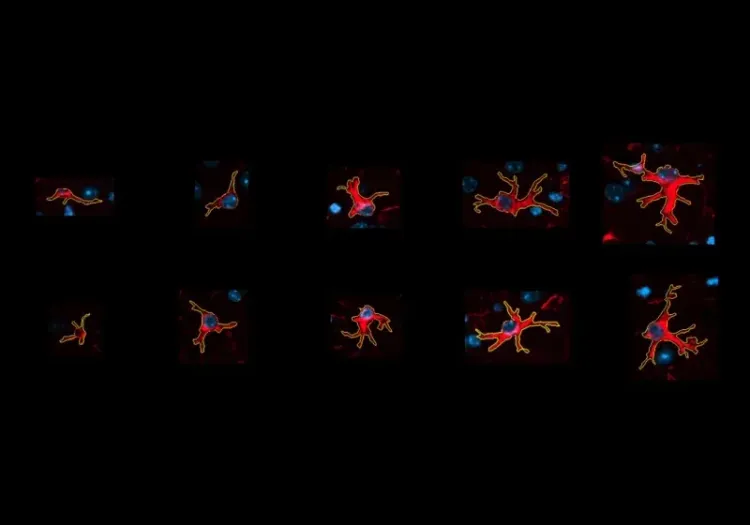
Biospective possède une expertise de pointe dans la fourniture de services d'histologie des plaques bêta-amyloïdes, y compris la marquage par immunofluorescence multiplexe (mIF) à l'aide de divers anticorps. Nous disposons de capacités uniques pour mesurerles caractéristiques des plaques Aβ (par exemple, nombre, taille, surface, type, morphométrie) et analyser les relations spatiales complexes avec la neuroinflammation associée, y compris les microglies activées et les astrocytes réactifs, à l'aide de notre « analyse du microenvironnement » exclusive.
Découvrez nos services :
- Quels sont les services de recherche sous contrat proposés par Biospective pour la marquage et l'analyse des plaques amyloïdes?
- Quel est le processus de Biospective pour la marquage et l'analyse quantitative des plaques amyloïdes bêta?
- Pourquoi quantifier les plaques amyloïdes bêta?
- Comment Biospective procède-t-il à l'analyse des plaques amyloïdes et de la neuroinflammation associée?
Quels services de recherche sous contrat Biospective propose-t-il pour la marquage et l'analyse des plaques amyloïdes ?
Détection haute résolution des plaques Aβ, cartographie spatiale et profilage de la neuroinflammation pour la recherche sur la maladie d'Alzheimer.
Biospective fournit une caractérisation complète des plaques amyloïdes bêta (Aβ) et des réponses du microenvironnement glial à l'aide d'une marquage tissulaire multiplexe par immunofluorescence (mIF) avancée ,d'une imagerie haute résolutionde lames entières etd'une analyse morphologique automatisée basée sur l'apprentissage automatique.
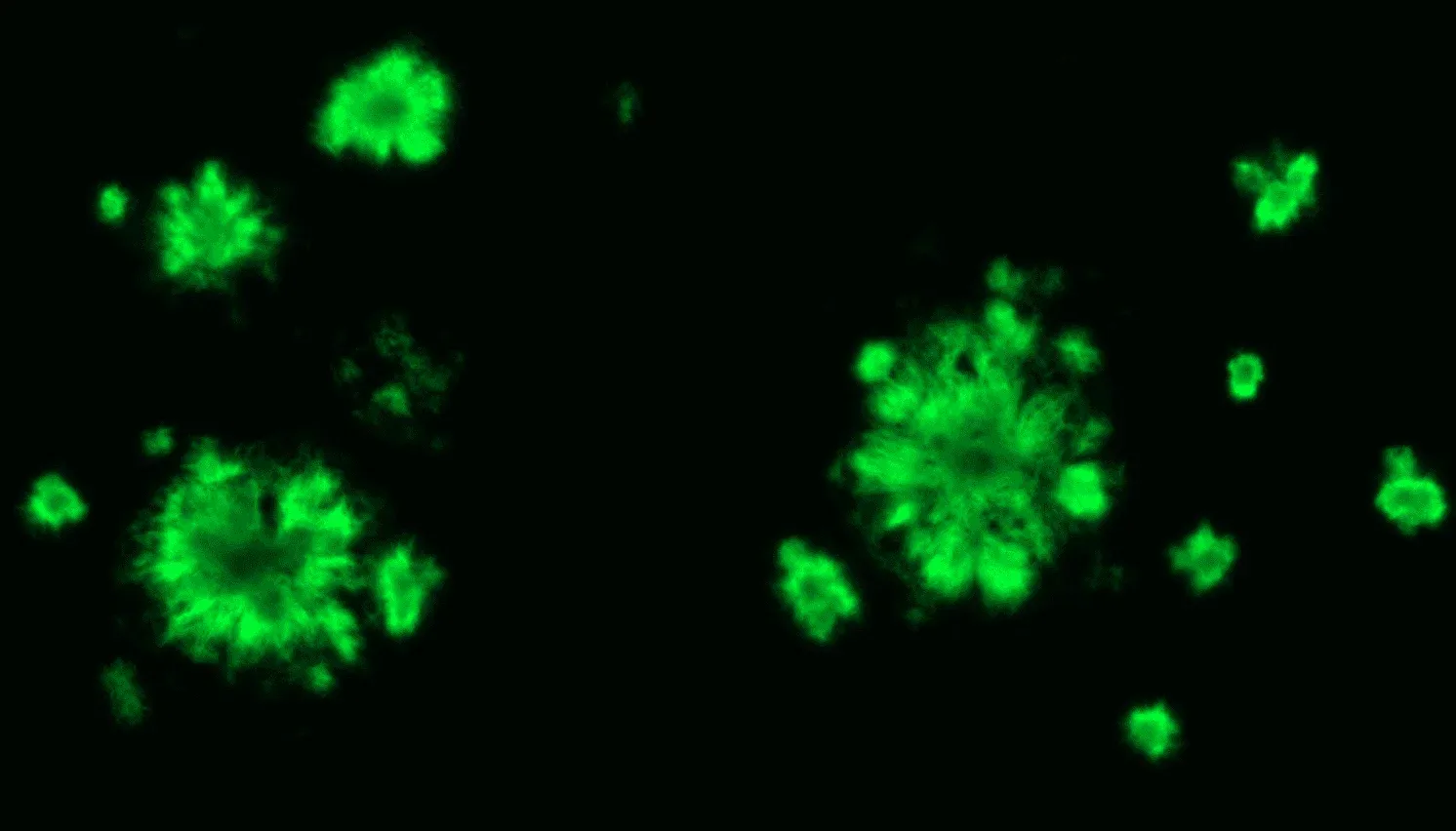
Marquage fluorescente au pFTAA des plaques amyloïdes dans le cortexcérébral de souris APP/PS1.
Notre plateforme permet une analyse quantitative et multiparamétrique de la pathologie amyloïde bêta ainsi que des phénotypes microgliaux et astrocytaires, en intégrant des mesures biologiques à résolution spatiale afin de fournir des évaluations sensibles et complètes de l'efficacité thérapeutique, au-delà des mesures conventionnelles de la charge plaque.
Nos capacités en matière de marquage et d'analyse des plaques amyloïdes
Détection et quantification des plaques amyloïdes
- Détection des amyloïdes fibrillaires à l'aide d'un anticorps OC amyloïde fibrillaire optimisé ( quantification optionnelle des colorants pan-Aβ / Aβ40 / Aβ42 / Aβ43, 4G8, 6E10, pFTAA ).
- Mesures des plaques : nombre, surface, distribution par taille et mesures morphologiques ( par exemple, circularité).
Profilage avancé du microenvironnement des plaques
- Quantification de la densité des marqueurs pertinents, tels que les microglies/Iba1 et les astrocytes/GFAP, à la fois globalement et dans le microenvironnement des plaques en fonction de la distance par rapport à la plaque.
- Détection et classification morphologique des microglies et des astrocytes. Le nombre de cellules gliales de morphologie spécifique peut être mesuré à la fois globalement et localement à différentes distances des plaques amyloïdes individuelles.
- Mesures de l'interaction entre les microglies et les astrocytes, telles que le rapport entre les microglies et les astrocytes dans l'environnement de la plaque.
Imagerie de lames entières et analyse spatiale
- Imagerie par fluorescence multicanaux haute résolution de la lame entière.
- Segmentation neuroanatomique automatisée du cerveau — toutes les mesures sont calculées dans chaque région d'intérêt (ROI) du cerveau, telle que l'hippocampe, l'amygdale, le cortex entorhinal, etc.
Intégration translationnelle
- Quantification précise du volume cérébral et mesure de l'épaisseur corticale à l'aide d'une IRMin vivo.
- Évaluations cognitives et du sommeil
- Biomarqueurs liquides provenant du LCR/sang et des homogénats de tissu cérébral
- Aβ40 et Aβ42
- Cytokines (par exemple IL-1β, TNF-α)
- Chaîne légère du neurofilament (NfL)
- TREM2
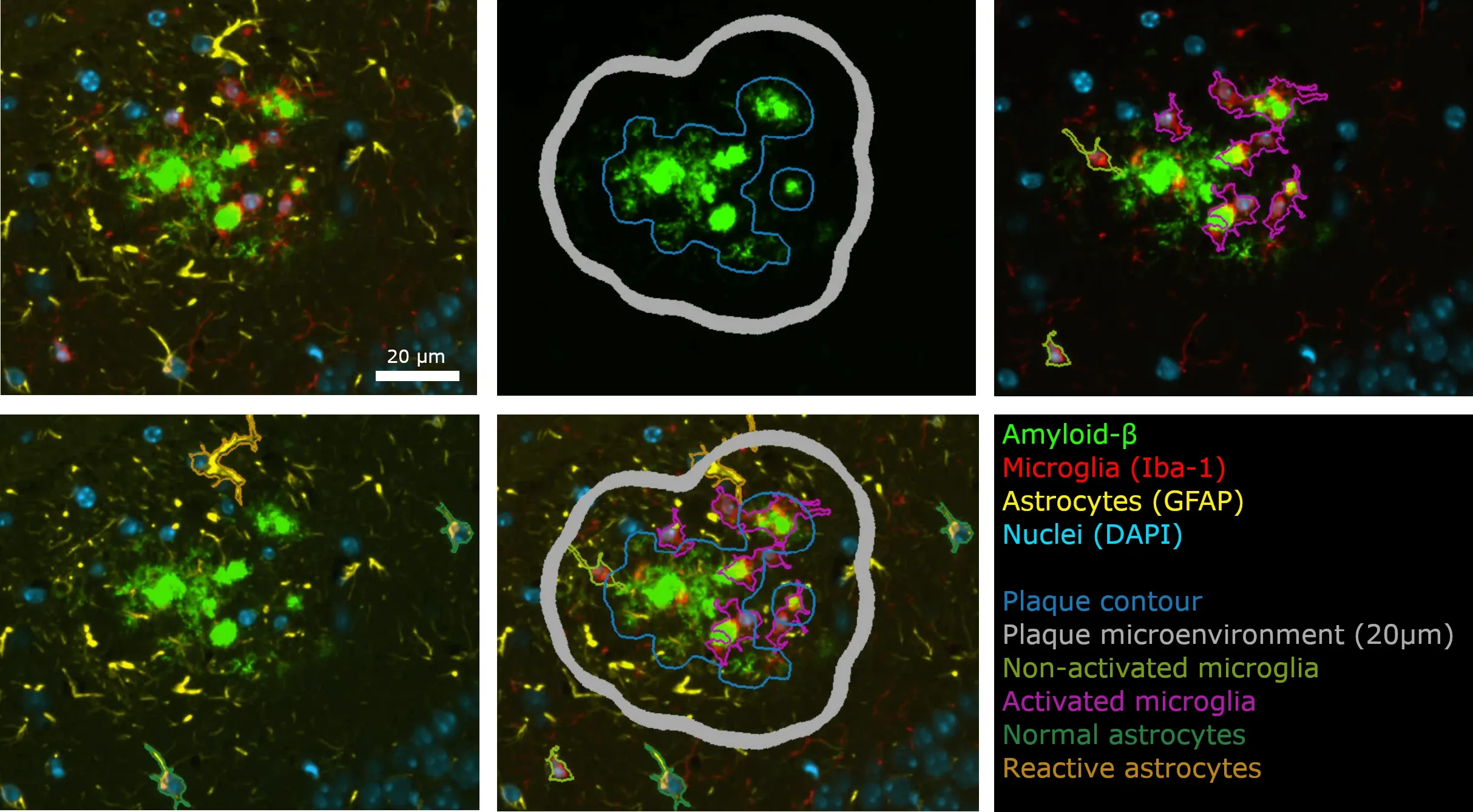
Exemple demontage d'une plaque Aβ à partir de coupes de tissu cérébral provenant d'une souris transgénique APP/PS1 qui ontsubi une marquage automatisée et une analyse d'image à l'aide des processus développés par Biospective.
Types de tissus et modèles de maladies
Espèces
Formats tissulaires
- Coupes FFPE: haut débit, stables
- Coupes fixes congelées: idéales pour les marqueurs inflammatoires difficiles à détecter
Applications
- Études d'efficacité thérapeutique
- Modélisation mécanistique de la neuroinflammation associée à la plaque
Quel est le processus de Biospective pour la marquage et l'analyse quantitative des plaques amyloïdes bêta ?
Des protocoles bien établis pour la préparation des échantillons cérébraux, la marquage, la numérisation des lames et l'analyse quantitative des images.
Notre processus de marquage et d'analyse des plaques Aβ
Chez Biospective, nous avons mis en place un processus standardisé et hautement reproductible en plusieurs étapes pour la marquage et l'analyse des plaques amyloïdes bêta provenant de cerveaux fixés au formol :
- Préparation des échantillons
- Microtomie ou cryosection de haute précision de cerveaux FFPE ou fixés et congelés.
- Protocoles de récupération d'antigènes personnalisés optimisés pour l'OC et chaque anticorps spécifique à une isoforme Aβ, garantissant une liaison à haute affinité et la préservation de la morphologie des plaques. Les conditions de récupération sont encore personnalisées pour tout anticorps supplémentaire inclus dans le panel multiplex. Nous effectuons régulièrement une récupération à l'acide formique, une récupération induite par la chaleur (HIER), une récupération enzymatique ou une combinaison de ces méthodes.
- Contrôle qualité (CQ) rigoureux de la qualité et de la spécificité de la marquage ainsi que de l'intégrité des tissus.
- Marquage (IHC ou IF multiplex)
- Marqueurs amyloïdes
- Amyloïde fibrillaire OC (marqueur primaire par défaut)
- Pan-Aβ, Aβ 1–40, 1–42, 1–43, 6E10, 4G8 et MAOB-2 (ou anticorps amyloïde personnalisé)
- Colorant pFTAA
- Marqueurs du microenvironnement
- Iba1 (microglies)
- GFAP (astrocytes)
- TREM2, LAMP1, CD68, NeuN, APP et/ou marqueurs personnalisés
- DAPI (noyaux)
- Avantages du multiplexage
- Le multiplexage permet une analyse spécifique au type de cellule du microenvironnement sur une seule lame, caractérisant avec précision le paysage cellulaire entourant les plaques individuelles.
- Le multiplexage permet une analyse spécifique au type de cellule du microenvironnement sur une seule lame, caractérisant avec précision le paysage cellulaire entourant les plaques individuelles.
- Marqueurs amyloïdes
- Imagerie
- Balayage fluorescent multicanal de la section entière
- Balayage fluorescent multicanal de la section entière
d'analyse quantitativeNous avons développé une analyse quantitative entièrement automatisée pour l'immunofluorescence multiplexe, comprenant la segmentation et le comptage des plaques amyloïdes bêta, l'analyse morphologique des cellules gliales et l'analyse du microenvironnement.
-
- Marquage IF multiplexe
- Détection, segmentation et classification des microglies en fonction de leur morphologie
- Détection, segmentation et classification des astrocytes en fonction de leur morphologie
- Détection et segmentation des plaques amyloïdes (Aβ)
- Analyse du microenvironnement : quantification de la densité de marquage et de la densité des cellules gliales en fonction de la distance par rapport à la plaque et de la taille de la plaque
Illustration du processus de Biospective consistant à prélever des échantillons de tissu cérébral sur des modèles animaux, à réaliser des coupes tissulaires, un marquage immunofluorescent multiplex, un balayage complet des lames et une analyse quantitative des images.
Directives relatives au prélèvement, à la préparation et à l'expédition des échantillons
Nous fournissons une assistance complète afin de garantir l'intégrité des échantillons et la fiabilité des données :
- Collecte des échantillons : les animaux doivent être perfusés avec du PBS froid et/ou du formol tamponné neutre à 10 %, et les cerveaux doivent être soigneusement extraits.
- Préparation des échantillons : les cerveaux doivent être fixés brièvement et correctement dans du formol tamponné neutre à 10 %.
- Expédition des échantillons : les échantillons doivent être expédiés dans du PBS avec de l'azide de sodium.
Pourquoi quantifier les plaques amyloïdes bêta ?
Brève présentation de la pathologie Aβ dans la maladie d'Alzheimer et importance d'une analyse quantitative fiable.
Les plaques amyloïdes sont des dépôts extracellulaires de peptides Aβ agrégés et constituent une caractéristique neuropathologique de la maladie d'Alzheimer(Selkoe, 2016). Les peptides Aβ sont générés par le clivage de la protéine précurseur amyloïde (APP)et peuvent avoir différentes longueurs, les plus courants dans la MAétant les Aβ40 et Aβ42. L'accumulation de plaques Aβ dans le cerveau suit un schéma spatio-temporel distinct , avec une première apparition dans lenéocortex, suivie d'une propagation dans les régions sous-corticales, y compris l'hippocampe(Braak, 1991; Braak, 2006).
Modèle spatio-temporel de la progression de la pathologie β-amyloïde (adaptéde Braak, 1991).
La quantification détaillée des plaques amyloïdes et de leur microenvironnement neuroinflammatoire associé est extrêmement précieuse :
- Les premiers traitements modificateurs de la maladie approuvés pour la MA consistent en des traitements par anticorps ciblant la forme pathologique de l'Aβ, visant à éliminer les plaques amyloïdes (Perneczky, 2024).
- Un microenvironnement inflammatoire est souvent observé à proximité des plaques, qui serait principalement induit par les microglies (Tsering, 2024).
- Des sous-types spécifiques de microglies (microglies associées à la maladie, DAM) et d'astrocytes (astrocytes associés à la maladie, DAA) se sont avérés être enrichis dans la MA (Deczkowska, 2018; Habib, 2020). Il a été constaté que les microglies sont fortement localisées au niveau des plaques, tandis que les astrocytes se trouvent plus loin des plaques (Mallach, 2024).
- Il a été constaté que les interactions entre les microglies et les astrocytes sont perturbées autour des plaques amyloïdes (Mallach, 2024).
- Les microglies (Savage, 2019) et les astrocytes (Patani, 2023) subissent des changements morphologiques drastiques dans des conditions stressantes et joueraient un rôle important dans les troubles neurodégénératifs (Hulshof, 2022; Gao, 2023).
Dans cette vidéo, nous présentons notre plateforme de marquage et d'analyse des plaques amyloïdes. Elle comprend des exemples illustratifs tirés du modèle murin APP/PS1 de la maladie d'Alzheimer, démontrant comment notre immunofluorescence multiplexe et nos analyses spatiales automatisées quantifient la charge plaque, l'activation gliale et les microenvironnements des plaques afin de mesurer la progression de la maladie et de soutenir l'évaluation thérapeutique dans les études précliniques.
Veuillez cliquer pour copier le lien.
Comment Biospective procède-t-elle à l'analyse des plaques amyloïdes et de la neuroinflammation associée ?
Résumé de nos méthodes de quantification de l'Aβ et exemple illustratif tiré d'un modèle murin de la maladie d'Alzheimer.
Afin d'illustrer notre processus de marquage des plaques amyloïdes et d'analyse du microenvironnement, nous avons caractérisé l'accumulation progressive de la charge pathologique dans un modèle murin de la maladie d'Alzheimer présentant des dépôts amyloïdes bêta, le modèle APP/PS1 (ARTE10). Les souris ont été étudiées à l'âge de 6, 9 et 12 mois, puis comparées à des souris témoins âgées de 6 mois.
Flux de travail animé pour l'analyse du microenvironnement des plaques Aβ.
Dans cette étude, nous avons constaté :
- Une augmentation progressive, très significative et par étapes de la densité des plaques amyloïdes dans les différents groupes d'âge.
- Une augmentation globale de la neuroinflammation, quantifiée par la densité de marquage des microglies (Iba1) et des astrocytes (GFAP), selon un schéma spatio-temporel qui suit la pathologie amyloïde.
- Des mesures avancées qui fournissent des indications plus précises sur l'état de la maladie :
- La densité des microglies activées
- Le score moyen d'hypertrophie des astrocytes
- Le rapport microglies/astrocytes à proximité des plaques
- La sensibilité accrue de ces paramètres avancés signifierait que, dans le cadre d'une étude préclinique sur l'efficacité thérapeutique, un effet plus faible pourrait être détecté en utilisant le même nombre d'animaux. En outre, ces paramètres seraient particulièrement pertinents pour les traitements ciblant les microglies, les astrocytes, les interactions microglies-astrocytes ou l'interaction des cellules gliales avec les plaques amyloïdes.
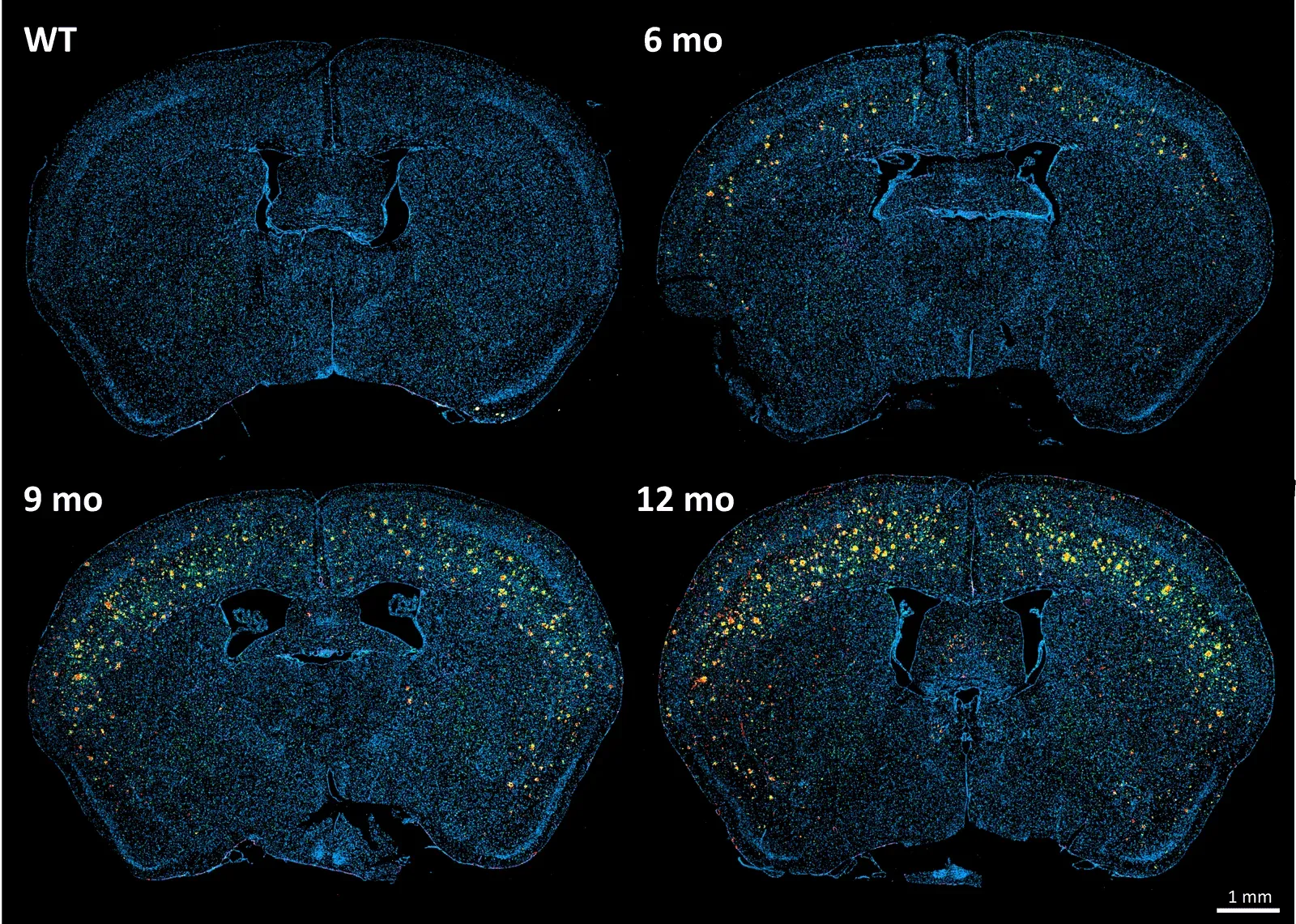
Progression spatio-temporelle de l'amyloïde-β et de la pathologie gliale associée dans un modèle murin APP/PS1 de la maladie d'Alzheimer.
Présentation interactive de notre étude de recherche
Dans l'« Image interactive » ci-dessous, vous trouverez les résultats de notre analyse des plaques amyloïdes bêta et du microenvironnement inflammatoire, y compris des coupes tissulaires à haute résolution obtenues par immunofluorescence multiplexe du cerveau de souris APP/PS1 et de souris témoins.
Comment utiliser notre visionneuse interactive
Naviguez dans l'« histoire en images » à l'aide du panneau de gauche ou des flèches à l'écran. Vous pouvez faire un panoramique sur les images microscopiques haute résolution à l'aide de votre souris et zoomer/dézoomer à l'aide de la molette de défilement ou des commandes +/-. Le panneau de contrôle (en haut à droite) permet de basculer entre les canaux d'image et les superpositions de segmentation. Pour une expérience optimale, nous vous recommandons de passer en mode plein écran. Cette présentation interactive vous permet d'explorer en détail la neuropathologie du modèle et les déficits fonctionnels associés, comme si vous regardiez directement dans le microscope.
Image interactive décrivant notre analyse des plaques amyloïdes et du microenvironnement neuroinflammatoire, y compris des coupes de tissu cérébral à immunofluorescence multiplexe haute résolution, provenant du modèle murin APP/PS1 (ARTE10) et de souris témoins.
Cliquez pour copier le lien
Principaux avantages des services de marquage et d'analyse des plaques amyloïdes proposés par Biospective :
- Détection OChautement sensible des amyloïdes fibrillaires
- Analyse optionnelle des isoformes pan-Aβ, Aβ40, Aβ42 et Aβ43
- Marquage personnalisée par anticorps/marqueur
- Imagerie automatisée à haut débit de lames entières et analyse des régions neuroanatomiques
- Caractérisation et quantification des plaques amyloïdes
- Analyse de la morphologie et du phénotype des cellules gliales
- Mesures avancées de la neuroinflammation et de l'environnement des plaques — très sensibles aux petits changements dans la progression de la maladie
- Compatibilité interespèces (souris, rat)
- Services complémentaires (par exemple, biomarqueurs liquides mesurés par immunoessais)
Sélection de mesures de l'environnement des plaques amyloïdes fournies par la plateforme Biospective
|
Indicateur |
Unités |
Description |
|
Densité des plaques amyloïdes |
Nombre par mm² |
Densité des plaques amyloïdes dans chaque région d'intérêt anatomique |
|
Densité de marquage |
Fraction |
Fraction de pixels positifs pour chaque marquage utilisée dans l'IF ou l'IHC multiplex |
|
Densité des microglies activées |
Nombre par mm² |
Densité des microglies classées comme ayant une morphologie non ramifiée |
|
Score moyen d'hypertrophie des astrocytes |
Score morphologique |
Score morphologique moyen des astrocytes détectés dans une région d'intérêt |
|
Densité des cellules gliales dans le microenvironnement de la plaque |
Nombre par mm² |
Densité des microglies ou des astrocytes dans le microenvironnement de la plaque à différentes distances des plaques amyloïdes (par exemple, jusqu'à 0 µm, 10 µm, 20 µm, 30 µm, etc. de la plaque) |
|
Rapport microglies/astrocytes à proximité de la plaque |
Sans unité |
Rapport entre les microglies et les astrocytes à proximité immédiate du microenvironnement de la plaque (par exemple, jusqu'à 10 µm autour des plaques). |
|
Morphométrie des plaques |
Multiple |
Différentes mesures morphométriques peuvent être extraites de la détection des plaques, telles que la taille des plaques, leur circularité, etc. |
Ce tableau compare les différentes mesures de l'environnement des plaques amyloïdes fournies par la plateforme Biospective.
Pour discuter de vos besoins en matière d'étude ou demander un devis pour les services de marquage et d'analyse quantitative des plaques amyloïdes :
Contenu connexe
Informations actualisées sur les services de marquage et d'analyse quantitative des plaques amyloïdes.
Analyse des plaques amyloïdes-β dans la maladie d'Alzheimer
Aperçu des méthodes de classification et de quantification des plaques Aβ dans les coupes de tissus cérébraux provenant d'humains et de modèles animaux de la maladie d'Alzheimer (souris et rats transgéniques).
Amyloïde-β et microenvironnement inflammatoire chez la souris Alzheimer
Nous avons analysé les relations spatiales complexes entre les plaques β-amyloïdes, la microglie activée et au repos, et les astrocytes dans un modèle transgénique APP/PS1.
Astrocytes et modèles murins β amyloïde de la maladie d’Alzheimer
L'analyse de la morphologie des astrocytes dans le microenvironnement de la plaque amyloïde-β fournit une mesure sensible de la progression de la maladie chez les souris transgéniques.
Morphologie des astrocytes dans la maladie d'Alzheimer
Une vue d'ensemble de l'analyse morphologique des astrocytes et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.
Morphologie de la microglie dans la SLA, la maladie d'Alzheimer et la maladie de Parkinson
Une vue d'ensemble de l'analyse morphologique des microglies et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.