Cette ressource décrit:
- Qu'est-ce qui constitue un bon modèle de SLA pour le développement de médicaments?
- Quelles sont les principales caractéristiques de la SLA humaine qui devraient être présentes dans un modèle animal?
- Quelles mesures (y compris les biomarqueurs translationnels) peuvent être utilisées pour évaluer l'efficacité des modèles de SLA?
Qu'est-ce qui constitue un bon modèle de SLA pour le développement de médicaments?
Les efforts visant à développer de nouvelles thérapies efficaces pour la sclérose latérale amyotrophique (SLA) (la forme la plus courante de la maladie du motoneurone [MND]) se sont accélérés ces dernières années. Un large éventail de cibles et de mécanismes d'action sont activement recherchés. Étant donné que les essais in vivo sur des modèles animaux constituent une phase essentielle entre les études précliniques in vitro et les essais cliniques chez l'homme, il est essentiel d'utiliser des modèles valides qui reproduisent fidèlement les multiples aspects de la maladie humaine. Le modèle animal optimal de la SLA doit présenter plusieurs caractéristiques clés décrites dans l'infographie ci-dessous.
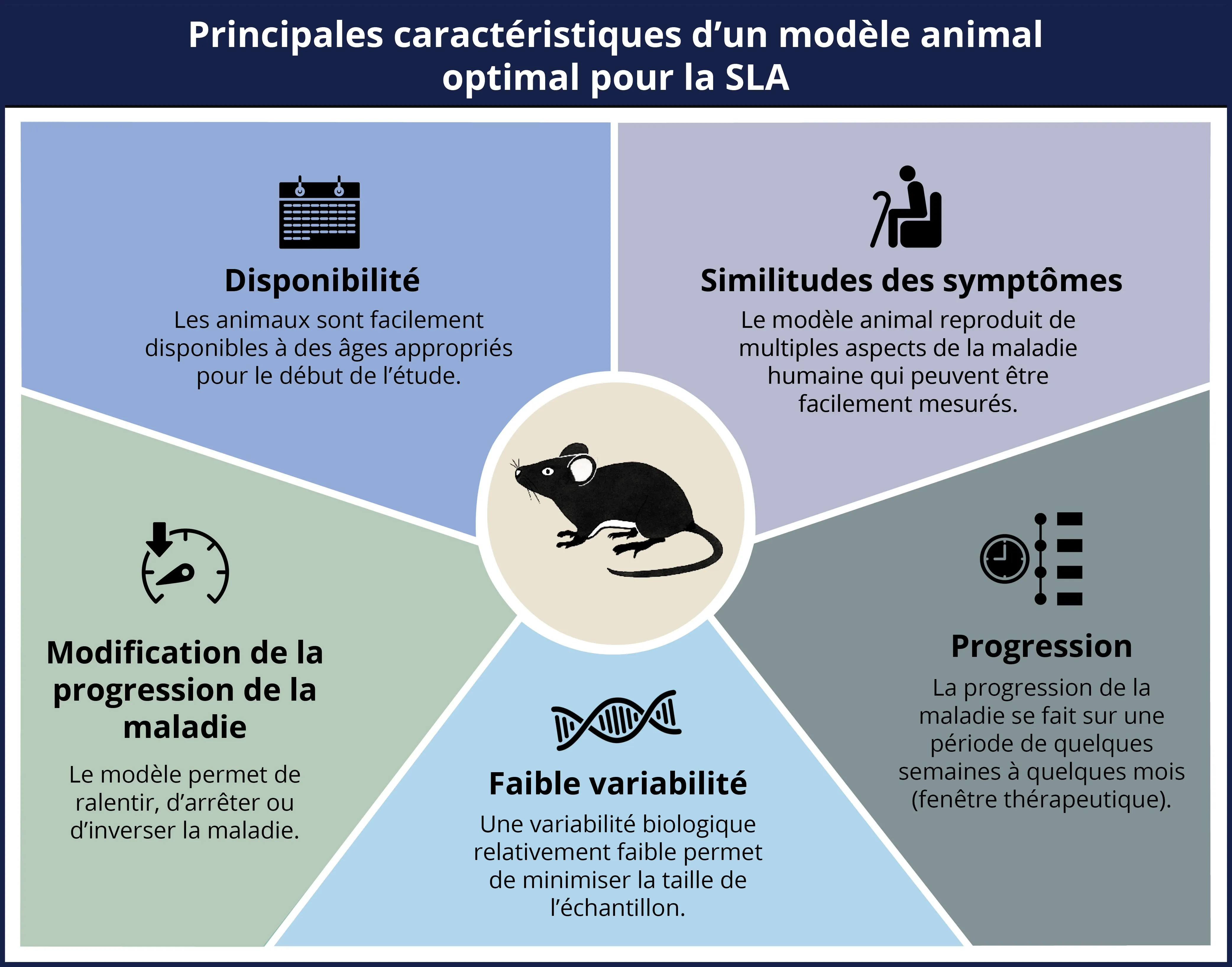
Un modèle animal optimal de la SLA devrait présenter les cinq caractéristiques clés suivantes : disponibilité de souris adaptées à l'âge, similitudes des symptômes entre le modèle et la maladie humaine, faible variabilité entre les animaux, progression de la maladie sur une certaine période, possibilité de modifier la progression de la maladie dans le modèle.
Cliquez pour copier le lien
Quelles sont les principales caractéristiques de la SLA humaine qui devraient être présentes dans un modèle animal?
La SLA est une maladie neuromusculaire progressive caractérisée par la perte de neurones moteurs supérieurs et inférieurs, entraînant une faiblesse musculaire et, à terme, la mort. La maladie peut également présenter une série de caractéristiques non motrices, notamment des altérations cognitives et comportementales. L'une des caractéristiques pathologiques de la SLA, tant sporadique que familiale, est la protéinopathie TDP-43, en particulier l'agrégation de cette protéine mal repliée dans le cytoplasme, ce qui entraîne des effets toxiques de perte et de gain de fonction. Braak et ses collègues ont proposé un schéma spatio-temporel de la pathologie TDP-43, illustré ci-dessous.
Modèle de propagation spatio-temporelle de la pathologie TDP-43 dans le cerveau humain en cas de SLA (adapté de Braak et al.).
Comme d'autres maladies neurodégénératives, la SLA est aujourd'hui considérée comme une maladie multisystémique qui ne se limite pas au système nerveux central (SNC), mais qui touche de nombreuses parties du corps. L'infographie ci-dessous présente quelques-uns des systèmes impliqués dans cette maladie complexe.
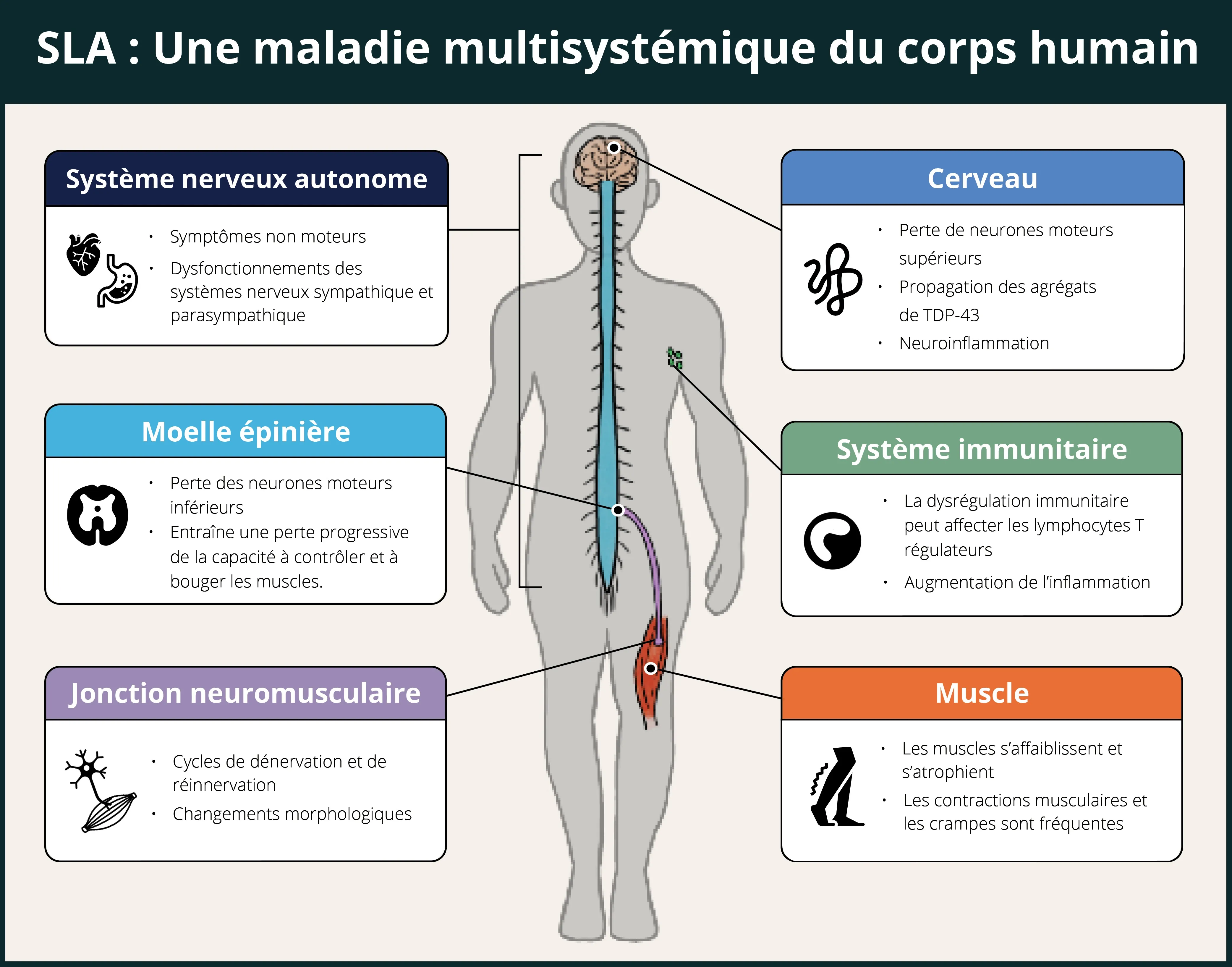
La SLA est une maladie multisystémique qui touche le cerveau, la moelle épinière, le système nerveux autonome, le système immunitaire, les jonctions neuromusculaires et les muscles.
Cliquez pour copier le lien
Quelles mesures (y compris les biomarqueurs translationnels) peuvent être utilisées pour évaluer l'efficacité dans les modèles de la SLA?
Un élément clé de l'utilisation réussie des modèles murins de la SLA pour évaluer l'efficacité des agents thérapeutiques est l'utilisation de tests robustes qui ont la sensibilité nécessaire pour détecter la modification de la maladie. Une approche multimodale est idéale pour comprendre comment une thérapie peut agir au niveau des systèmes, des cellules et des molécules. Des avantages supplémentaires peuvent être obtenus en utilisant des "biomarqueurs translationnels" qui pourraient également être exploités dans des essais cliniques chez l'homme.
L'illustration ci-dessous donne un aperçu de certaines catégories de mesures qui ont été utilisées dans des études d'efficacité impliquant des modèles de SLA. Les mesures d'imagerie non invasives, telles que les volumes cérébraux et l'épaisseur corticale dérivés de l'IRM et le métabolisme du glucose par [18F]FDG PET, sont d'excellents biomarqueurs translationnels car ils peuvent être utilisés efficacement dans les études précliniques sur des modèles animaux et dans les essais cliniques sur l'homme. Une série de tests de la fonction motrice permettant d'évaluer la locomotion générale (par exemple en champ libre), l'équilibre et la coordination (par exemple le rotarod, la traversée d'une poutre), la démarche (par exemple CatWalk), la force musculaire (par exemple la suspension d'un fil, la force de préhension), l'agrippement des membres postérieurs, les tremblements et la paralysie peuvent être utilisés pour évaluer la modification du phénotype clinique dans les modèles murins. Les biomarqueurs de l'électrophysiologie musculaire ont également une application clinique, l'électromyographie (EMG) étant une évaluation standard chez les patients atteints de SLA. Dans les modèles murins de la SLA, le potentiel d'action musculaire composé (CMAP) et l'estimation du nombre d'unités motrices (MUNE) peuvent être facilement mesurées dans les muscles des membres postérieurs de la souris (par exemple, le gastrocnémien). Le neurofilament à chaîne légère est devenue un biomarqueur liquide largement utilisé dans les études sur la SLA, et peut également être utilisée comme mesure de la dégénérescence/lésion axonale et de la neurodégénérescence dans les modèles murins de la SLA. Enfin, un large éventail de techniques, telles que l'immunophénotypage des cellules inflammatoires par cytométrie de flux et l'immunofluorescence multiplex de l'expression des protéines couplée à l'analyse de la biologie spatiale, sont utilisées pour évaluer les changements cellulaires et moléculaires résultant d'une intervention thérapeutique.
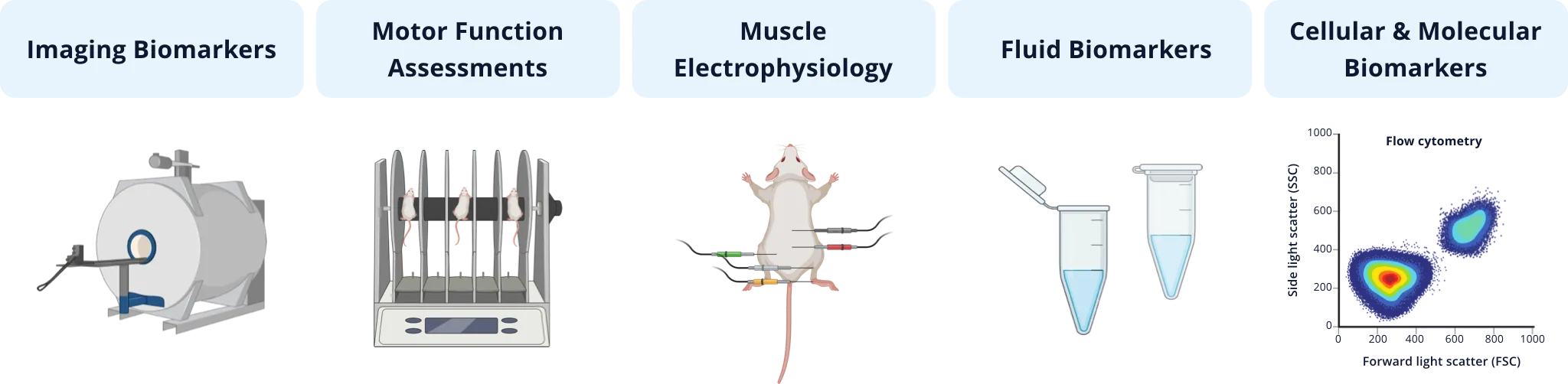
Types de mesures quantitatives qui ont été utilisées dans les études précliniques d'efficacité thérapeutique de la SLA impliquant des modèles de rongeurs.
À titre d'exemple de cette stratégie multimodale, notre équipe à Biospective a validé un ensemble de ces mesures dans le modèle de souris transgénique TDP-43 ΔNLS (rNLS8) de la SLA, et nous évaluons activement un certain nombre d'autres marqueurs qui ont été utilisés dans des études sur l'homme. Nous utilisons généralement une combinaison de ces mesures, souvent en fonction de la ou des cibles et du ou des mécanismes d'action de l'agent thérapeutique à l'étude pour évaluer l'efficacité. À titre d'exemple de biomarqueur translationnel, nous évaluons régulièrement l'atrophie cérébrale dans ce modèle à l'aide de l'IRM, qui montre une réduction progressive du volume et de l'épaisseur corticale dans le cortex moteur, similaire aux résultats des études humaines.
Notre équipe se fera un plaisir de répondre à vos questions sur les modèles de SLA ou de vous fournir des informations spécifiques sur les modèles que nous utilisons pour les études d'efficacité thérapeutique.
Découvrez nos modèles ALS
Contenu connexe
Informations actualisées sur la sclérose latérale amyotrophique et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de la SLA.
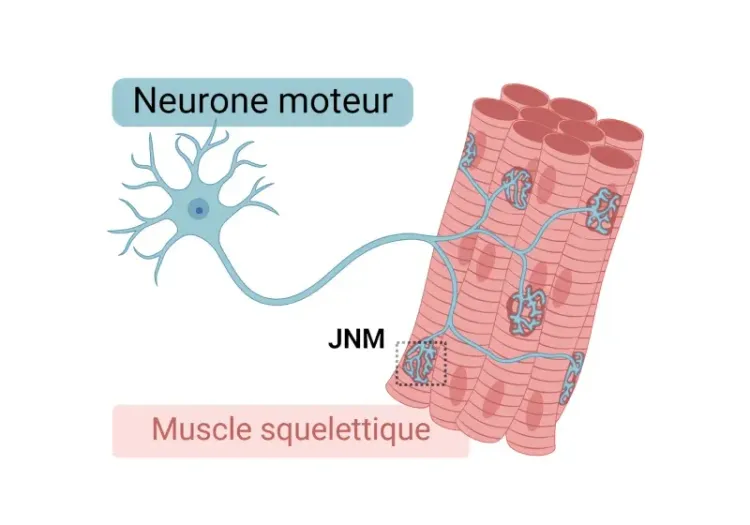
Morphologie de la jonction neuromusculaire (JNM) dans les modèles de SLA
Aperçu de la jonction neuromusculaire (JNM), de son rôle dans la sclérose latérale amyotrophique (SLA) et des outils et méthodes utilisés pour étudier les changements morphologiques dans les JNM.
Modèles de souris SLA et neurones moteurs spinaux
Aperçu de l'implication des motoneurones spinaux dans la progression de la maladie dans les modèles murins de sclérose latérale amyotrophique (SLA).
Souris TDP-43 ΔNLS (rNLS8) pour le développement de médicaments contre la SLA
Cette ressource fournit des informations sur l'utilisation du modèle de souris transgénique TDP-43 ΔNLS (deltaNLS, hTDP-43ΔNLS, hTDP-43DeltaNLS, dNLS, TDP43 NLS, rNLS8) de la SLA pour des études thérapeutiques précliniques.
Analyse de l'atrophie cérébrale dans les modèles murins de neurodégénérescence
Mesures quantitatives automatisées de l'atrophie cérébrale in vivo par IRM (volumes cérébraux régionaux et épaisseur corticale) dans des modèles murins de SLA et de maladie de Parkinson.
Morphologie de la microglie dans la SLA, la maladie d'Alzheimer et la maladie de Parkinson
Une vue d'ensemble de l'analyse morphologique des microglies et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.