Qu'est-ce que la jonction neuromusculaire ?
La jonction neuromusculaire (JNM) est une synapse spécialisée qui permet la communication entre les motoneurones et les fibres musculaires squelettiques, permettant ainsi les contractions musculaires nécessaires au mouvement. La JNM se compose de quatre éléments principaux : les motoneurones présynaptiques, les muscles postsynaptiques, les cellules de Schwann terminales et les kranocytes (Verma, 2022). La composante présynaptique comprend les terminaisons nerveuses, où les axones des motoneurones se ramifient et libèrent des neurotransmetteurs d'acétylcholine (ACh) en réponse à des signaux électriques. Ces neurotransmetteurs se lient aux récepteurs de l'ACh (AChR) dans les plis jonctionnels de la membrane musculaire, également connus sous le nom de plaque terminale motrice, déclenchant un potentiel d'action qui entraîne la contraction musculaire. Les cellules de Schwann terminales sont des cellules non myélinisantes qui coiffent les terminaisons nerveuses présynaptiques et étendent leurs processus dans la fente synaptique. Elles sont essentielles à la formation, à la maturation, à la maintenance et à la régénération du JNM (Sanes, 1999; Alhindi, 2021). Les kranocytes sont des cellules de type fibroblaste qui recouvrent les cellules de Schwann terminales et l'ensemble de la plaque terminale, et ils contribuent également à la régénération synaptique (Sugiura, 2011). L'organisation spatio-temporelle précise de ces composants de la JNM est essentielle pour une transmission neuromusculaire efficace, les perturbations pouvant entraîner une déficience fonctionnelle, une dénervation, une faiblesse musculaire et/ou une paralysie.
Représentation schématique des principaux composants de la jonction neuromusculaire. Abréviations :Jonction neuromusculaire (JNM), acétylcholine (ACh), récepteurs de l'ACh (AChR).
La JNM est un modèle de synapse expérimentalement intéressant car elle est accessible dans une grande variété de modèles animaux, y compris les souris, les rats et les drosophiles. Contrairement au soma du motoneurone situé dans la moelle épinière, la JNM est située dans les tissus périphériques, ce qui la rend plus accessible pour l'imagerie, les biopsies et la manipulation expérimentale. En outre, de nombreux outils accessibles au public permettent de visualiser et de quantifier les JNM, ce qui en fait un système idéal pour étudier les mécanismes sous-jacents aux troubles neurodégénératifs (Murray, 2010).
Comment les JNM sont-elles affectées dans la SLA et les modèles animaux de la SLA?
Plusieurs études ont montré que la dégénérescence de la JNM se produit avant l'apparition des symptômes cliniques et la perte des motoneurones dans les modèles de SLA chez les rongeurs (Kennel, 1996; Frey, 2000; Verma, 2022). Ces observations ont conduit les chercheurs à proposer que la SLA soit probablement une neuropathie motrice de type « dying back », où la dégénérescence neuronale commence aux extrémités distales des axones avant d'affecter les corps cellulaires des motoneurones (Frey, 2000). Étant donné le rôle de la JNM en tant que site précoce et critique de la pathologie dans la SLA, elle représente une cible thérapeutique prometteuse pour préserver l'intégrité neuronale et potentiellement retarder ou prévenir la progression de la maladie.
Des changements morphologiques dans les JNM ont été observés dans les modèles animaux de la SLA. Une fragmentation axonale accrue et une perte d'innervation axonale sont couramment observées dans les JNM des modèles murins de la SLA (Pigna, 2019; Guerra San Juan, 2022; Alhindi, 2023). Bien que le bourgeonnement axonal et la réinnervation se produisent souvent comme des mécanismes compensatoires, ces réponses sont généralement incomplètes ou transitoires (Schaefer, 2005; Carrasco, 2016; Martineau, 2018). En outre, une altération de la morphologie des plaques terminales, telle que le rétrécissement des plaques terminales postsynaptiques et la perturbation de la disposition des récepteurs de l'acétylcholine, est fréquemment observée dans les modèles animaux de la SLA (Sakowski, 2012; Picchiarelli, 2019; Mejia Maza, 2021; Alhindi, 2022; Verma, 2022).
Chez l'homme, les études identifiant les changements précoces au niveau de la JNM sont limitées en raison de la difficulté d'obtenir des échantillons présymptomatiques. Ce problème rend difficile la validation des résultats obtenus à partir de modèles animaux. L'analyse post-mortem de tissus humains a cependant révélé une dénervation significative et une présence réduite de terminaisons nerveuses chez les patients atteints de SLA (Tsujihata, 1984; Maselli, 1993). Plus récemment, des chercheurs ont rapporté des résultats anormaux d'électromyographie (EMG), des gouttières synaptiques fragmentées, une arborisation axonale terminale peu ramifiée et une morphologie altérée des cellules de Schwann terminales chez les patients atteints de SLA (Bruneteau, 2015).
Quels sont les outils disponibles pour quantifier les changements morphologiques dans les JNM?
L'immunofluorescence multiplex (mIF) est l'outil privilégié pour analyser la morphologie des jonctions neuromusculaires en raison de sa capacité à fournir un marquage spécifique à haute résolution des différents sous-composants de la JNM. Il est compatible avec un large éventail de modèles expérimentaux, y compris les coupes de tissus, les préparations de montages entiers et même les cellules cultivées. En règle générale, l'architecture neuronale présynaptique de la JNM est marquée à l'aide d'anticorps ciblant le neurofilament et les vésicules synaptiques, tandis que les récepteurs d'acétylcholine postsynaptiques sont marqués à l'aide d'α-bungarotoxine.
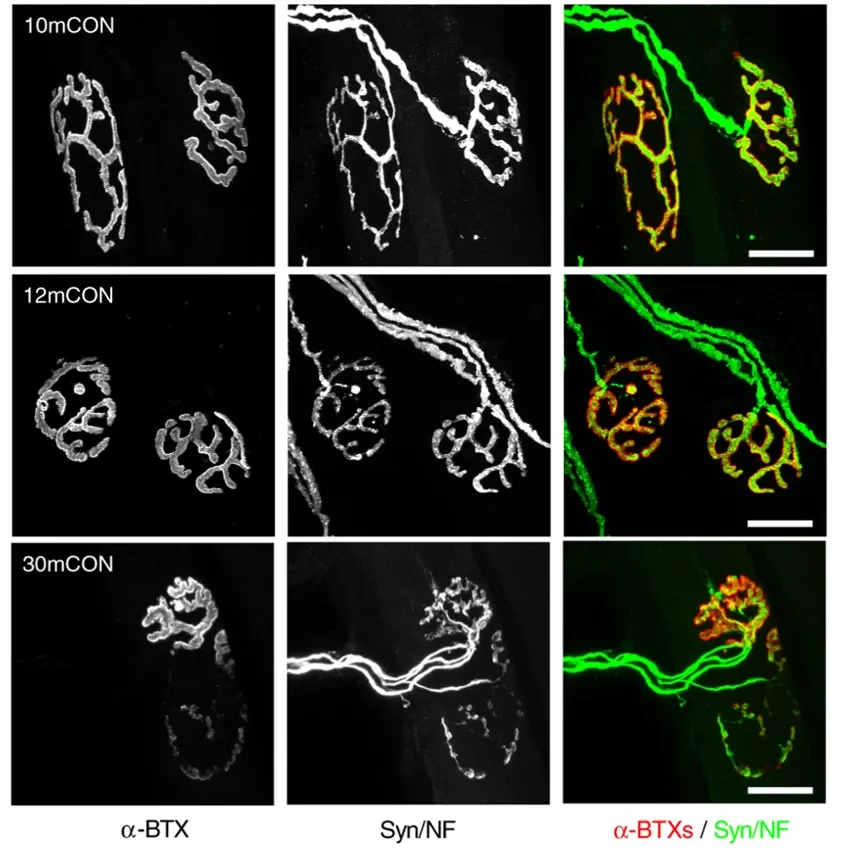
Images représentatives de montages entiers des muscles présynaptiques (neurofilament/synaptophysine) et postsynaptiques (récepteurs de l'acétylcholine [AChR] colorés à l'aide d'alpha-bungarotoxine) de l'extensor digitorum longus (EDL) chez des souris témoins âgées de 10 mois (10mCON), témoins âgées de 12 mois (12mCON) et souris âgées de 30 mois (30mCON). Figure et légende adaptées de Ham et al. (Ham, 2020) sous la Creative Commons Attribution License.
Facebook
Twitter
LinkedIn
Click to copy link
Les JNM peuvent être visualisées à l'aide de projections confocales en z ou de la microscopie à fluorescence à champ large, la première offrant généralement une meilleure résolution spatiale. En raison de la géométrie complexe des JNM, qui ressemble à une plaque, il faut veiller à n'analyser que les JNM en face et à rejeter les JNM obliques qui peuvent apparaître comprimées ou déformées en raison de l'angle d'observation, ce qui rend difficile l'évaluation de leur taille, de leur forme et de leur intégrité structurelle réelles.
Il existe plusieurs outils de traitement d'images accessibles au public pour quantifier la morphologie de la JNM. Un plugin ImageJ largement utilisé, « NMJ-morph », applique des algorithmes de seuillage simples pour segmenter les composants présynaptiques et postsynaptiques à partir des canaux de fluorescence. Il génère une série de mesures morphologiques pour les axones présynaptiques et la plaque terminale motrice, telles que la surface, le diamètre, la compacité et la fragmentation. NMJ-morph a été utilisé dans des études portant sur divers modèles pathologiques, notamment la maladie de Charcot-Marie-Tooth (Cipriani, 2018), la myopathie mitochondriale codée par CHCHD10 (Genin, 2019), le syndrome myasthénique (McMacken, 2019), des modèles de souris SLA (Pigna, 2019; Alhindi, 2023; Vieira de Sá, 2024), la cachexie cancéreuse (Boehm, 2020) et la sarcopénie (Ham, 2020). Plus récemment, le même groupe qui a développé le NMJ-morph a publié un algorithme mis à jour appelé « NMJ-morph automatisé » (aNMJ-morph), qui accélère l'acquisition des données pour améliorer le débit relativement faible du NMJ-morph et sa courbe d'apprentissage abrupte associée (Minty, 2020). Cet algorithme amélioré a été appliqué à des études sur la signalisation YAP1/TAZ-TEAD (Gessler, 2024), le muscle vocalis humain (Tracicaru, 2024), le microbiote intestinal (Cescon, 2024) et les lésions nerveuses périphériques (Mehrotra, 2024).
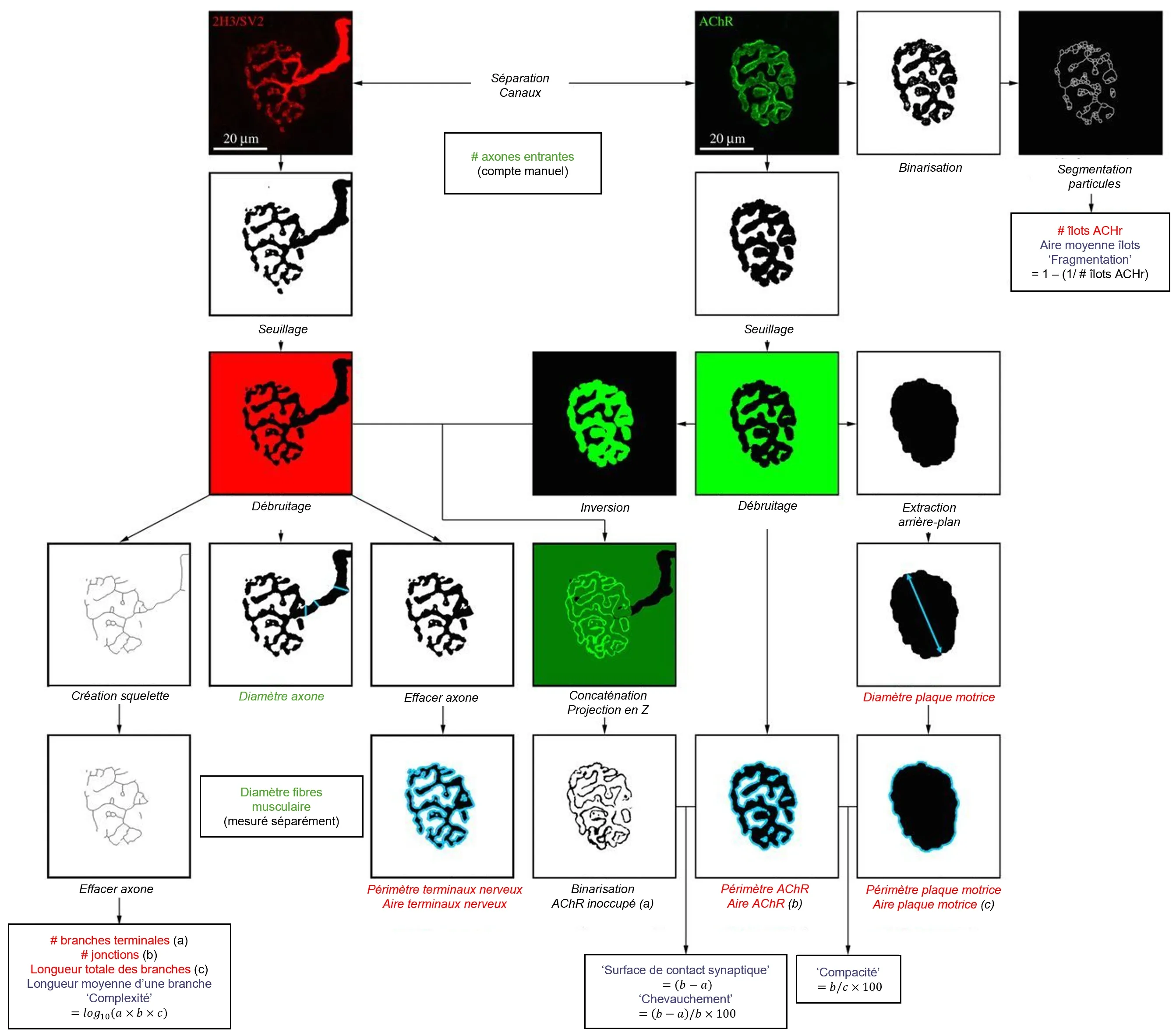
Vue d'ensemble de la plateforme NMJ-morph. Organigramme montrant la séquence des analyses pour chaque JNM. Le flux de travail comprend 21 variables morphologiques : les 11 « variables principales » sont représentées en rouge, les 7 « variables dérivées » en bleu et les 3 « variables associées aux nerfs et aux muscles » en vert. Les opérations spécifiques au sein de NMJ-morph sont indiquées en italique. Figure et légende reproduites de Jones et al. (Jones, 2016) sous la Creative Commons Attribution License.
Facebook
Twitter
LinkedIn
Click to copy link
Étant donné que NMJ-morph et les plugins ImageJ similaires reposent sur le seuillage manuel, ils sont sujets à la variabilité inter-laboratoires et inter-évaluateurs. Pour résoudre ce problème, Mejia Maza et al. (Mejia Maza, 2021) ont développé « NMJ-analyser », qui introduit des méthodes de normalisation à l'échelle de l'expérience pour minimiser les effets de lot et permet une sélection entièrement automatique des seuils. Contrairement à ses prédécesseurs, NMJ-analyser fonctionne sur des images brutes concatenées en 3D (z-slice) au lieu de projections maximales en 2D, ce qui permet d'analyser toutes les JNM plutôt que de se limiter aux vues en face. Il intègre également un algorithme d'apprentissage automatique Random Forest pour classer l'état d'innervation des JNM entre « totalement innervée », « partiellement innervée » et « dénervée » sur la base d'un large éventail de caractéristiques morphologiques qu'il calcule. Il a été démontré que NMJ-analyser détecte les changements au niveau de la JNM avec une plus grande sensibilité que NMJ-morph (Mejia Maza, 2021).
Notre équipe se tient à votre disposition pour répondre à vos questions sur la morphologie de la jonction neuromusculaire (JNM) ou pour vous fournir des informations spécifiques sur les modèles de SLA que nous utilisons pour les études d'efficacité thérapeutique.
Découvrez nos modèles ALS
Contenu connexe
Informations actualisées sur la morphologie de la jonction neuromusculaire (JNM) et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de la SLA.
Modèles de souris SLA et neurones moteurs spinaux
Aperçu de l'implication des motoneurones spinaux dans la progression de la maladie dans les modèles murins de sclérose latérale amyotrophique (SLA).
Modèles de souris SLA pour le développement de médicaments
Un guide pour l'utilisation la plus efficace possible des modèles animaux de recherche sur la sclérose latérale amyotrophique (SLA) pour les essais précliniques de produits thérapeutiques.
Morphologie de la microglie dans la SLA, la maladie d'Alzheimer et la maladie de Parkinson
Une vue d'ensemble de l'analyse morphologique des microglies et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.
Analyse de l'atrophie cérébrale dans les modèles murins de neurodégénérescence
Mesures quantitatives automatisées de l'atrophie cérébrale in vivo par IRM (volumes cérébraux régionaux et épaisseur corticale) dans des modèles murins de SLA et de maladie de Parkinson.
Souris TDP-43 ΔNLS (rNLS8) pour le développement de médicaments contre la SLA
Cette ressource fournit des informations sur l'utilisation du modèle de souris transgénique TDP-43 ΔNLS (deltaNLS, hTDP-43ΔNLS, hTDP-43DeltaNLS, dNLS, TDP43 NLS, rNLS8) de la SLA pour des études thérapeutiques précliniques.