EAE MSモデルとは何ですか?
実験的自己免疫性脳脊髄炎(EAE)は、多発性硬化症(MS)の動物モデルとして最も広く使用されています。EAEは、末梢の炎症および神経炎症、脱髄、軸索損傷など、ヒトのMSのいくつかの重要な側面を再現します。 以下のインフォグラフィックでは、マウスおよびラットモデルにおけるEAEの主な特徴のいくつかを強調しています。
EAEモデルは、自己免疫疾患、脱髄および再ミエリン化、炎症および神経変性(軸索損傷を含む)、運動障害、再発寛解型および/または進行性の疾患経過など、ヒトの多発性硬化症(MS)の主な側面を再現します。
クリックしてリンクをコピー
EAEは、アジュバント中のミエリンタンパク質またはペプチド(MBP、MOG、PLPなど)を用いた能動免疫、または活性化ミエリン標的CD4+ T細胞の受動移入により、マウスまたはラットに誘発することができます。EAEの主な症状は脊髄に現れ、Tリンパ球と単球の浸潤を特徴とし、局所的な炎症と脱髄病変の発生につながります。
現在市場に出回っている多発性硬化症治療薬のいくつかは、当初このモデルでテストされていたため、EAEはげっ歯類モデルの臨床応用の可能性を効果的に示しています。例えば、グラチラマー酢酸塩(GA、コパキソン)や、VLA-4インテグリンに対するモノクローナル抗体であるナタリズマブ(タイサブリ)、スフィンゴシン-1-リン酸(S1P)受容体モジュレーターであるフィンゴリモド(FTY-720、ジレニア)は、EAEモデルで評価されました。
EAEモデルの組織切片における軸索損傷は、通常どのように測定されるのでしょうか?
軸索の変性および損傷は、EAEマウスおよびラットの脊髄の組織切片で測定することができます。明視野免疫組織化学染色または多重免疫蛍光染色の 定量的画像解析を行うことで、脊髄の複数のレベル(頸部 、胸部、腰部など) における異なる関心領域(灰白質、白質など)の定量的データを得ることができます。軸索の完全性/損傷に関する一般的なIHC/IFマーカーには、リン酸化および非リン酸化ニューロフィラメント、ならびにアミロイド前駆体タンパク質(APP)が含まれます。 EAEモデルにおけるこれらのマーカーの使用例を以下に示します。
EAEマウスモデルの組織切片における軸索損傷を測定するプロセスの概要。
Aharoni氏と同僚らは、MOG35-55 EAE マウスの脊髄組織をニューロフィラメント軽量、中型、および重量タンパク質について染色しました。 彼らは、広範囲にわたる軸索の変形および損失が脱髄部位で明らかであることを発見しました。 これらのマウスをグラチラマー酢酸で治療したところ、軸索の損傷/損失および脱髄が減少しました。 Budde 氏らは、非リン酸化ニューロフィラメントに対する SMI-32 染色の定量的分析を軸索損傷のマーカーとして使用しました。彼らは、EAE マウスの脊髄におけるin vivo拡散テンソル画像(DTI)MRI によって測定された軸索拡散性との関連性を発見しました。
Herrero-Herranz氏らは、MOG-EAEマウスにおける急性軸索損傷のマーカーとして知られるAPPに対する免疫反応を調査しました。 その結果、病気の初期段階では多くの軸索がAPP陽性であることが分かりましたが、病気が進行するにつれてAPP陽性の軸索は著しく減少しました。 また、この研究では、脊髄組織切片をSMI-31でリン酸化ニューロフィラメント、SMI-32で非リン酸化ニューロフィラメントについて染色しました。MOG-EAEの初期段階では、SMI-32陽性軸索が増加する一方で、病変部におけるSMI-31陽性軸索の割合は減少しました。病気の進行後期には、SMI-32陽性軸索が大幅に増加し、SMI-31陽性軸索はわずかしか認められませんでした。これにより、MOG-EAEの経過とともに、リン酸化ニューロフィラメントの相対量が減少し、非リン酸化ニューロフィラメントが増加することが示されました。
血液および脳脊髄液中のニューロフィラメント軽鎖(NfL;NF-L)レベルは、EAEにおける軸索損傷の評価に使用できるでしょうか?
複数のグループが、EAEにおける軸索損傷の流動性バイオマーカーとして、血漿および脳脊髄液中のニューロフィラメント軽鎖(NfL)濃度を使用できることを実証しています。NfLの生体液濃度測定は、ヒトのMS研究 (MS臨床試験を含む)で有望な結果が得られていることから、EAEマウスにおいて魅力的な方法であり、潜在的な臨床バイオマーカーとしての役割を果たします。
Biospectiveでは、治療効果研究の一環として、MOG35-55 EAEマウスの血漿および脳脊髄液中のNfLレベルを日常的に測定しています。下の図に示すように、NfLは(EAE臨床スコアで測定した)ピーク疾患期の頃から著しく上昇しています。
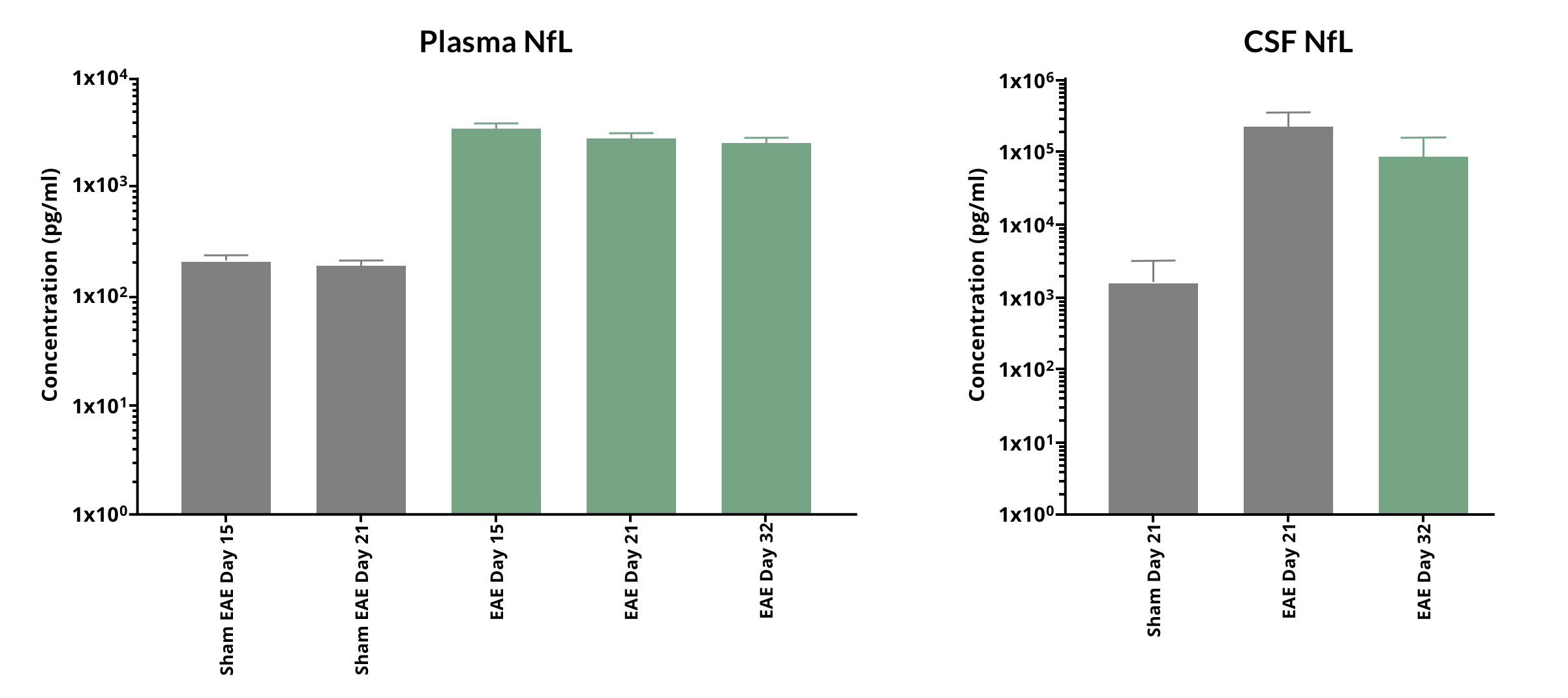
MOG35-55 EAE マウスの 血漿および脳脊髄液では、病気の経過に伴い、NfL の高い上昇レベル(平均 ± 標準偏差)が認められます。
Kieseier 氏らは、2年間にわたって実施された25件の独立したマウスEAE研究のメタ分析を行いました。C57BL/6JマウスにラットMOG28-152を完全フロイントアジュバントで投与してEAEを誘発したところ、血漿およびCSFのNfLレベルが疾患誘発後に有意に増加することが示されました。これらの値は1か月間上昇したままの状態が続き、発症から2か月後には約10分の1に減少しました。また、血漿中NfL値と脳脊髄液中NfL値、および血漿中または脳脊髄液中NfL値とEAEの臨床スコアとの間には、高い相関関係があることも分かりました。
Aharoni 氏らは、MOG誘発性EAAマウスモデルにおける神経変性変化と、これらの症状に対するグラチラマー酢酸塩(GA)[Copaxone]治療の効果を調査しました。 免疫組織化学(IHC)分析に加え、神経フィラメント軽鎖の血中への漏出に関する詳細な動態分析を、疾患期間の関数として行ったところ、このモデルでは軸索損傷が早期に発症することが明らかになりました。
ブルマー氏らは、MOG-EAEマウスにおけるNfLの血中への放出の時空間パターンは、ミクログリアや浸潤マクロファージなどのCNS-ミエロイド細胞(CMC)によって引き起こされる可能性があり、正常外観白質(NAWM)から白質病変(WML)へと、病期依存的に求心性に進行する可能性があることを発見しました。また、血清ニューロフィラメント軽鎖(sNfL)レベルがそれぞれの解剖学的病変部位と関連していることも示しており、これは多発性硬化症患者におけるsNfLレベルの個人間変動が大きいことの病態生理学的説明となる可能性があります。
Norgren 氏らは、遺伝子組み換え MOG1-125 を使用して暗色アグーチラットに EAE を誘発し、対照群と疾患ラットの脳脊髄液 NfL レベルに極めて有意な統計的差異があることを発見しました。同様に、Zuo氏らは、SJL/Jマウスにおける若いTh17細胞の養子移入により誘発された受動性EAEが、老若マウスのピーク時の疾患において、血清NfLレベルの増加と関連する、寛解のない臨床的表現型を生み出すことを発見しました。さらに、疾患の急性期後の段階では、老齢マウスのレシピエントでは、性別を一致させた若齢マウスのレシピエントと比較してNfLの増加が認められ、血清NfLレベルは、EAEスコアで測定した疾患の重症度と正の相関を示しました。
Zahoor 氏らは、再発寛解型(RR)(PLP139–151ペプチドで誘導したSJLマウス)および慢性型(B6)の血漿中のサイトカイン(IL6、IL17、IL12p70、IL10、TNFα)Simoaアッセイを使用して、再発寛解型(RR)(PLP139–151ペプチドで誘発したSJLマウス)および慢性型(MOG35–55で誘発したB6マウス)の異なる病期(急性期、慢性期、進行期)におけるEAEのマウスモデルの血漿中の神経マーカー(NfLおよびGFAP)を調べました。RR SJLおよび慢性B6マウスのEAEモデルの両方において、発症後、ピーク時、慢性期、進行期の段階で、血漿NfL(およびGFAP)が大幅に増加しました。
当社のチームは、EAEモデルに関するご質問にお答えしたり、治療効果研究で使用するモデルに関する具体的な情報をご提供したりいたします。
MSモデルについてもっと知ろう
関連コンテンツ
多発性硬化症に関する最新情報と、MS動物モデルにおける治療薬の評価に関するベストプラクティス。
キュプリゾンモデルにおける脱髄と再脱髄
多発性硬化症(MS)の銅線脱髄マウスモデルにおけるミエリンおよびオリゴデンドロサイトを測定する方法の概要。