Cette ressource décrit :
Pourquoi quantifier la morphologie des astrocytes ?
Les astrocytes sont des cellules gliales qui représentent environ 20 à 40 % des cellules du cerveau et jouent un rôle important dans de nombreux processus, notamment la régulation des synapses, l'homéostasie des lipides et des ions et la clairance des neurotransmetteurs (Baldwin, 2024). Les branches principales de leurs processus créent une morphologie en forme d'étoile, d'où leur nom. Ces branches principales se divisent ensuite en ramifications plus petites, puis en folioles qui entrent en contact avec les synapses. Les territoires couverts par les astrocytes tessellent complètement le système nerveux central, avec presque aucun chevauchement entre les cellules adjacentes.
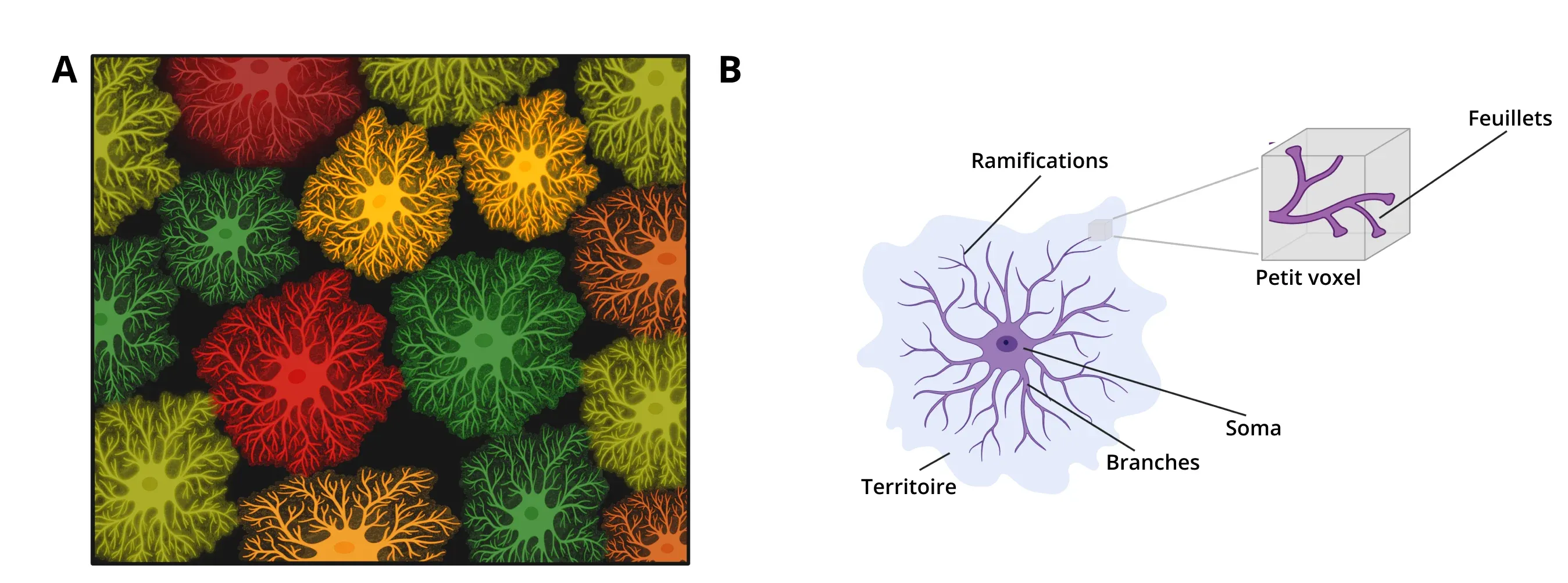
Morphologie des astrocytes. (A) Les astrocytes recouvrent entièrement le SNC, se séparant en territoires tridimensionnels distincts qui ne se chevauchent pratiquement pas. (B) Schéma représentant la morphologie d'un astrocyte. Les processus émanent du soma en branches principales, qui se divisent à leur tour en ramifications, puis en folioles. L'étendue 3D complète des processus astrocytaires est appelée territoire.
On pense que les astrocytes jouent un rôle important dans de nombreux troubles neurologiques, notamment la maladie d'Alzheimer, la sclérose latérale amyotrophique (SLA), la maladie de Huntington et la maladie de Parkinson (Pekny, 2016; Booth, 2017; Yun, 2018; Lee, 2022; Lawrence, 2023). Dans de nombreuses conditions de stress, les astrocytes peuvent devenir « réactifs » (Pekny, 2014; Escartin, 2021; Patani, 2023) avec différents profils d'expression génique et des changements morphologiques drastiques qui ont été observés très tôt par les neuroanatomistes (Andriezen, 1893). Dans ce contexte, on observe souvent une « hypertrophie » de la morphologie, les branches principales et les ramifications devenant plus épaisses, plus courtes et plus ramifiées.
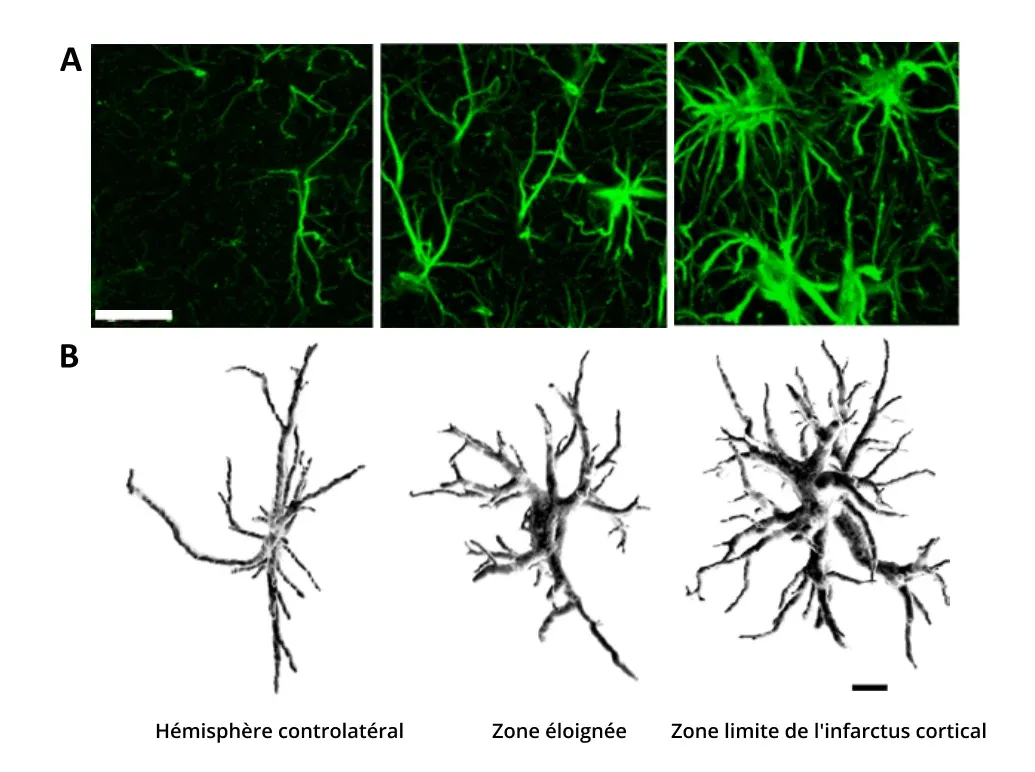
Hypertrophie des astrocytes due à une ischémie cérébrale. Les astrocytes sont représentés dans 3 régions : dans l'hémisphère controlatéral non affecté par l'accident vasculaire cérébral, dans l'hémisphère affecté mais éloigné de la lésion, et dans la zone corticale limitrophe de l'infarctus. (A) L'astrogliose réactive est observée à l'aide de l'immunomarquage GFAP, avec une densité et une intensité de coloration plus élevées plus près de la lésion. Barre d'échelle = 20 μm. (B) Reconstruction 3D d'astrocytes marqués à la GFAP imagés à l'aide de la microscopie confocale montrant l'augmentation des points de ramification, l'épaississement des processus et l'augmentation du volume. Barre d'échelle = 10 μm. Figures reproduites de Wagner et al. (Wagner, 2013) sous la Creative Commons Attribution License.
Les gènes liés à la morphologie des astrocytes se sont révélés enrichis dans de nombreuses maladies neurologiques, y compris la MA, la SLA et la sclérose en plaques (SEP) (Endo, 2022). Dans les modèles murins de la maladie d'Alzheimer, des changements morphologiques ont été détectés avant le dépôt significatif de plaques de bêta-amyloïde (Yeh, 2011; Beauquis, 2013). Chez Biospective, nous avons émis l'hypothèse que la quantification de la morphologie des astrocytes dans les études précliniques pourrait servir d'indicateur précoce et sensible de la progression de la maladie. Nos études utilisant un modèle de souris transgénique APP/PS1 ont montré que la quantification de la morphologie des astrocytes était plus sensible que la densité de la coloration GFAP pour mesurer l'état de la maladie.
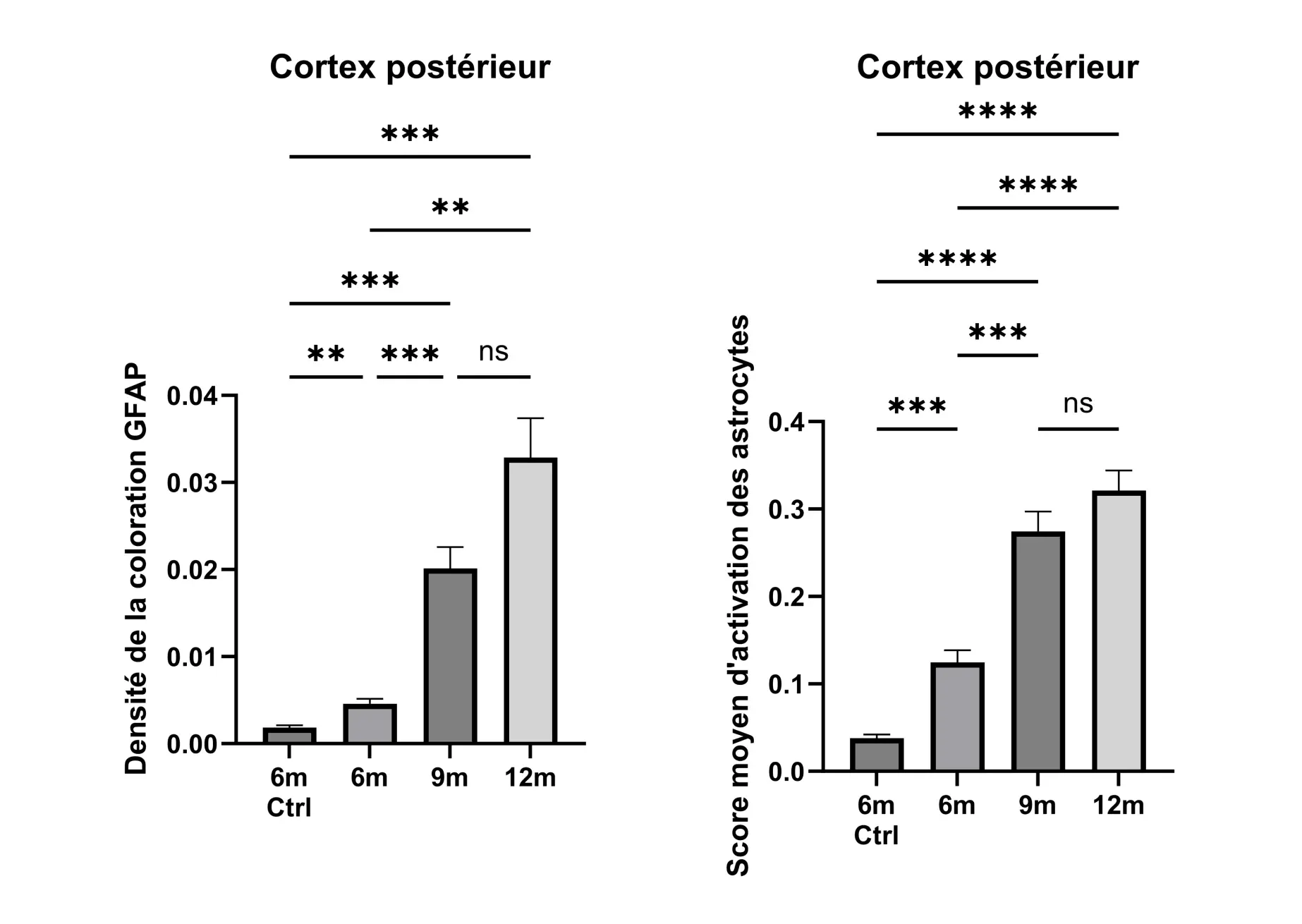
La quantification de la morphologie des astrocytes peut fournir une mesure sensible de l'état de la maladie. L'astrogliose est quantifiée dans le cortex postérieur de souris APP/PS1 à 6, 9 et 12 mois et comparée à des souris témoins (de type sauvage) à 6 mois. La densité de la coloration GFAP (c' est-à-dire la fraction des pixels positifs à la GFAP) augmente progressivement au cours de la progression de la maladie (à gauche). Le score moyen d'activation astrocytaire par ROI et par souris - obtenu à partir d'une analyse morphologique - augmente également au cours de la maladie, mais les changements sont plus significatifs sur le plan statistique (à droite). Les barres d'erreur représentent l'erreur standard de la moyenne (SEM). Les valeurs P ont été obtenues à l'aide du test de comparaisons multiples T3 de Dunnett, avec ** p<0,01, *** p<0,001, **** p<0,0001.
Comment quantifier la morphologie des astrocytes dans les coupes de tissus?
Conditions expérimentales
La quantification de la morphologie des astrocytes nécessite un marquage spécifique. La méthode classique consiste à réaliser un immunomarquage pour la protéine acide fibrillaire gliale (GFAP), qui marque les filaments intermédiaires de l'astrocyte et permet l'imagerie des processus primaires. Cependant, l'expression de la GFAP varie considérablement d'une région cérébrale à l'autre (Endo, 2022) et ne rend pas totalement compte de la morphologie des astrocytes (Baldwin, 2024). Pour visualiser des structures plus fines comme les ramifications, les feuillets et le territoire cellulaire, l'expression de la protéine fluorescente (FP) ou des techniques d'injection de colorant sont nécessaires (Bushong, 2002; Reeves, 2011). D'autre part, ces méthodes nécessitent soit un marquage épars, soit l'utilisation de plusieurs fluorophores pour séparer les cellules voisines. Il reste à déterminer dans quel contexte la quantification à haut débit de la morphologie générale des astrocytes ou la caractérisation détaillée des cellules peu marquées offre une plus grande sensibilité.
Les astrocytes peuvent alors être imagés en 2D à haut débit dans des tranches fines à l'aide d'un scanner de diapositives, ou en 3D à l'aide de la microscopie confocale sur des sections plus épaisses (40-100 μm). Il est important de noter que même avec la microscopie confocale, la résolution axiale est beaucoup plus faible que la résolution latérale, et qu'il faut être prudent lors de l'interprétation de la reconstruction 3D (Baldwin, 2024). Un compromis similaire entre le débit et l'évaluation morphologique 3D détaillée doit être considéré dans le contexte des objectifs de l'étude. Par exemple, la quantification automatisée de la morphologie des astrocytes imagée à l'aide d'un scanner de diapositives peut être utilisée dans des études précliniques de thérapeutiques potentielles, s'étendant à des millions de cellules et fournissant une métrique sensible de l'état de la maladie.
Étapes générales de la caractérisation morphologique
Le pipeline informatique pour l'analyse morphologique des astrocytes est parallèle à celui de la microglie, bien que les quelques outils publiés jusqu'à présent n'aient généralement pas exécuté toutes ces étapes (Labate, 2023). Les étapes clés comprennent l'identification et la séparation des cellules (détection d'objets), la segmentation des astrocytes et le squelettage des processus pour l'analyse des ramifications. De multiples mesures morphologiques (morphométriques) peuvent ensuite être obtenues pour chaque cellule, telles que la surface de la cellule, la surface du soma, le nombre de points de ramification dans le squelette, etc. Si les astrocytes ont été marqués avec un FP, des métriques supplémentaires peuvent être calculées, telles que la taille du territoire et le chevauchement (en cas d'utilisation de marqueurs multiples). Les astrocytes peuvent ensuite être classés en morphotypes spécifiques sur la base de leurs morphométries, bien que, contrairement à l'analyse de la morphologie de la microglie, cette étape n'ait pas été généralement réalisée.
Analyse quantitative entre les groupes
La morphométrie peut être agrégée par région d'intérêt (ROI), par animal et par groupe afin de détecter les changements dans la morphologie des astrocytes d'un groupe à l'autre. Cependant, la variabilité intra-groupe doit être soigneusement prise en compte lors de l'utilisation de cette approche, car les cellules multiples d'un même animal ne représentent pas des échantillons indépendants. Des techniques telles que le bootstrapping peuvent être utilisées pour estimer cette variabilité intragroupe tout en comparant la distribution des données morphométriques. En revanche, la quantification de la densité des cellules appartenant à des groupes morphologiques ou à des morphotypes spécifiques, comme dans l'analyse de la microglie, permet d'éviter ce problème.
Comment la quantification de la morphologie des astrocytes peut-elle être utilisée dans le développement de médicaments pour la maladie d'Alzheimer ?
Changements morphologiques dans les modèles murins de la maladie d'Alzheimer
Des modifications de la morphologie astrocytaire ont été observées dans de nombreux modèles murins de la maladie d'Alzheimer. Par exemple, dans un modèle de souris d'angiopathie amyloïde cérébrale (Tg-FDD, familial Danish Dementia), une ramification accrue, ainsi qu'une expression accrue d'un marqueur de réactivité (C3), ont été observées dans les astrocytes colorés à la GFAP (Taylor, 2020). Dans ce modèle, une astrogliose importante a été observée sans microgliose.
Endo et al. (Endo, 2022) ont observé des changements morphologiques dans les astrocytes corticaux en utilisant le modèle de souris APP/PS1 de la maladie d'Alzheimer. Dans cette étude, les astrocytes ont été marqués à l'aide de la PF pour quantifier la taille de leur territoire en plus d'autres paramètres morphométriques. Dans le cerveau sain, les auteurs ont corrélé la variation de l'expression génique entre les régions - obtenue par transcriptomique globale et unicellulaire - et les changements dans la morphométrie pour identifier des modules de gènes morphologiques putatifs. Deux gènes de ces modules, Ezrin et Fermt2, ont été validés par l'élimination de gènes, ce qui a entraîné une réduction de la taille du territoire des astrocytes et des changements dans une tâche cognitive pour les souris affectées. Tant dans leur modèle de souris que dans les tissus humains atteints de la MA, les gènes qui se sont avérés être significativement régulés à la baisse étaient positivement corrélés à la taille du territoire. La réduction de la taille du territoire des astrocytes corticaux a été observée par microscopie dans leur modèle de souris. Enfin, les gènes liés à la taille du territoire astrocytaire qui ont été identifiés se sont révélés enrichis dans de multiples troubles neurologiques, y compris la MA, la SEP et la SLA.
Yeh et al. (Yeh, 2011) ont quantifié la morphologie des astrocytes dans un modèle de souris à évolution lente de la MA (3xTg-AD). Une atrophie significative de la surface et du volume a été observée dans les astrocytes immunocolorés par la GFAP dès l'âge d'un mois dans le cortex entorhinal, bien avant la détection de plaques et d'agrégats extracellulaires (12 mois).
Les traitements affectent la morphologie des astrocytes
Dans un autre modèle murin de la MA (souris transgéniques PDAPP-J20), Beauquis et al. (Beauquis, 2013) ont étudié les effets du traitement par enrichissement environnemental (EE) sur la charge amyloïde-β et la morphologie des astrocytes dans l'hippocampe. Les souris bénéficiant de l'EE présentaient une charge de plaques amyloïdes significativement plus faible que les souris transgéniques non traitées. Les auteurs ont analysé séparément la morphologie des astrocytes associés à la plaque (PAA, défini comme < 50 μm de plaque dans cette étude) et des astrocytes non associés à la plaque. Ils ont constaté que, chez les souris transgéniques non traitées, les astrocytes éloignés des plaques présentaient une atrophie significative, tandis que les PAA présentaient une augmentation de volume. L'EE a réduit les changements morphologiques à la fois pour les AAP et les astrocytes éloignés des plaques. Une ramification croissante des astrocytes a également été observée avant l'accumulation significative des plaques.
En utilisant le modèle murin APP/PS1 de la MA, Chandra et al. (Chandra, 2023) ont étudié les effets des altérations du microbiome intestinal dues à un traitement antibiotique chez des souris mâles. Ils ont constaté que le traitement réduisait le nombre d'astrocytes et d'AAP par rapport aux animaux non traités. La morphologie des AAP colorés à la GFAP a également été affectée par le traitement, avec une diminution de la fraction de la zone dans le soma et une augmentation de la longueur moyenne du processus (ce qui suggère une diminution de l'hypertrophie). Les marqueurs fonctionnels ont également été modifiés, le traitement réduisant le C3 et augmentant l'Ezrin par rapport au véhicule. L'expression de l'ézrine est bien corrélée à de multiples morphométries. La réintroduction du microbiome par transplantation de matière fécale a annulé ces effets, tandis que les souris sans germe ont montré des changements similaires à ceux des souris traitées aux antibiotiques. En éliminant la microglie à l'aide d'inhibiteurs du CSF1R, les auteurs ont montré que les effets du traitement antibiotique sur la morphologie des AAP dépendaient de la présence de la microglie, mais que la diminution du nombre d'astrocytes se produisait de manière indépendante.
Canepa et al (Canepa, 2023) ont testé deux inhibiteurs de l'anhydrase carbonique, le méthazolamide et l'acétazolamide, en tant que thérapeutiques potentielles dans le modèle de souris TgSwDI de la MA. Ils ont constaté que le traitement réduisait la charge de la plaque amyloïde et l'hypertrophie des astrocytes. La morphologie de la microglie était également moins affectée dans les groupes traités par rapport au véhicule.
Nouvelle morphologie des astrocytes
Sokolova et al. (Sokolova, 2024) ont identifié un nouveau type de morphologie astrocytaire dans les modèles murins de la MA et dans les tissus humains de la MA. En utilisant l'expression FP pour visualiser la morphologie des astrocytes, ils ont identifié des astrocytes avec des processus « bulbeux » et des niveaux élevés d'expression de p62 présents avant l'accumulation de plaques robustes. Cette morphologie, localisée principalement dans l'hippocampe, n'a pas pu être visualisée avec la coloration GFAP, mais a également été observée avec la S100β. Ces astrocytes avaient également un territoire plus petit que les astrocytes voisins et n'étaient pas en corrélation spatiale avec les plaques amyloïdes. Les auteurs ont découvert que ces astrocytes « bulbeux » favorisaient l'engloutissement des synapses microgliales par la sécrétion de MFG-E8 (glycoprotéine milk fat globule-EGF factor 8) au cours des premiers stades de l'amyloïdose, une nouvelle découverte qui ouvre des voies potentielles d'intervention thérapeutique.
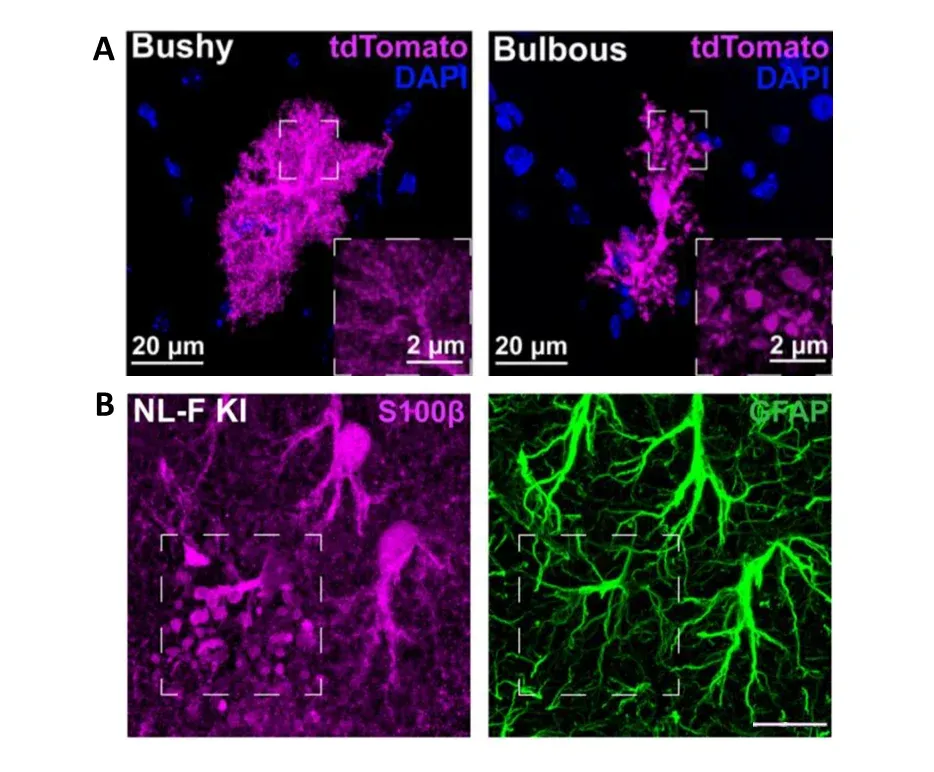
Identification d'une nouvelle morphologie astrocytaire, appelée « bulbeuse ». (A) Image microscopique comparant la morphologie des astrocytes typiques, touffus, à la morphologie « bulbeuse » dans le modèle murin NL-F knock-in de la MA. Les astrocytes sont marqués à l'aide d'un PF (tdTomato), montrant leur morphologie complète. Des protubérances sphériques peuvent être observées dans les processus des astrocytes « bulbeux ». (B) Ces protubérances ne peuvent pas être observées à l'aide de l'immunomarquage GFAP, mais peuvent être observées à l'aide de S100β. Barre d'échelle = 15 μm. Figures reproduites de Sokolova et al. (Sokolova, 2024) sous la Creative Commons Attribution License.
Notre équipe se fera un plaisir de répondre à vos questions sur la morphologie des astrocytes ou de vous fournir des informations spécifiques sur les modèles de maladie d'Alzheimer que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles pour la maladie d'Alzheimer
Contenu connexe
Informations actualisées sur la neuroinflammation et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans des modèles animaux de maladies neurodégénératives.
Amyloïde-β et microenvironnement inflammatoire chez la souris Alzheimer
Nous avons analysé les relations spatiales complexes entre les plaques β-amyloïdes, la microglie activée et au repos, et les astrocytes dans un modèle transgénique APP/PS1.
Morphologie de la microglie dans la SLA, la maladie d'Alzheimer et la maladie de Parkinson
Une vue d'ensemble de l'analyse morphologique des microglies et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.
Activation microgliale dans un modèle de souris PFF à α-synucléine
Nous avons quantifié l'activation microgliale, sur la base de la morphologie, dans un modèle murin d'ensemencement et d'étalement de fibrilles préformées d'α-synucléine (PFF) de la maladie de Parkinson.
Analyse des plaques amyloïdes-β dans la maladie d'Alzheimer
Aperçu des méthodes de classification et de quantification des plaques Aβ dans les coupes de tissus cérébraux provenant d'humains et de modèles animaux de la maladie d'Alzheimer (souris et rats transgéniques).