Pourquoi est-il important de caractériser et de quantifier les plaques Aβ?
Il est largement reconnu que la dysrégulation amyloïde joue un rôle central dans la progression de la maladie d'Alzheimer (Selkoe, 2016). Les caractéristiques neuropathologiques caractéristiques communément observées dans la MA comprennent les plaques extracellulaires d'amyloïde-β (Aβ), l'astrogliose et l'activation microgliale (Cohen, 2015). Les plaques amyloïdes présentent un large éventail de morphologies et de distributions neuroanatomiques. L'immunohistochimie (IHC) et l'immunofluorescence (IF) peuvent être utilisées pour obtenir des informations détaillées sur la localisation, la distribution et la morphologie des plaques Aβ dans des régions cérébrales spécifiques, offrant un niveau de détail qui ne peut être atteint avec d'autres méthodes de quantification (par exemple, l'imagerie cérébrale, les biomarqueurs de fluides).
En outre, les données cliniques suggèrent que l'étude de la seule charge amyloïde globale dans le cerveau peut ne pas donner une image complète de l'état de la pathologie. En effet, de nombreuses études post-mortem ont montré des patients avec d'abondants dépôts amyloïdes à la mort sans déficience cognitive significative (Katzman, 1988; Hulette, 1998; Aizenstein, 2008). De plus en plus, les scientifiques ont tenté d'établir un lien entre la présence de sous-types spécifiques de plaques bêta-amyloïdes et l'évolution clinique. Ils ont ainsi constaté que les plaques amyloïdes dépourvues de structures fibrillaires (également appelées « plaques diffuses ») sont souvent présentes chez les patients ne présentant pas de troubles cognitifs, contrairement aux plaques fibrillaires plus compactes qui sont plus susceptibles d'être associées à des troubles cognitifs. Il a également été démontré que la présence de neurites gonflés ou dystrophiques à proximité de la plaque est fortement corrélée aux troubles cognitifs et à la gravité de la maladie (Dickson, 2001; Ly, 2011). Ces résultats soulignent la nécessité d'une caractérisation précise des différents sous-types de plaques amyloïdes, ce qui pourrait nous aider à mieux comprendre l'hétérogénéité de la maladie.
Quels sont les différents sous-types de plaques amyloïdes-β?
Les plaques amyloïdes-bêta proviennent du clivage de la protéine précurseur de l'amyloïde (APP) par les enzymes β- et γ-sécrétase. Ce processus génère des peptides Aβ dont la longueur peut varier, les formes Aβ40 et Aβ42 étant les plus significatives dans la maladie d'Alzheimer. L'accumulation d'Aβ dans le cerveau suit un schéma spatiotemporel spécifique, apparaissant initialement dans le néocortex et se propageant ensuite aux régions sous-corticales, y compris l'hippocampe (Braak, 1991; Braak, 2006). Le peptide Aβ existe initialement à l'état monomérique, mais il peut s'auto-agréger sous diverses formes, telles que des oligomères fibrillaires courts, des oligomères globulaires non fibrillaires et des fibrilles amyloïdes qui forment des agrégats appelés plaques.
Schéma hypothétique de progression de la pathologie β-amyloïde (adapté de Braak, 1991).
Les plaques Aβ sont classées, en fonction de leur morphologie et de leur contenu en fibrilles, en types diffus et à noyau dense à l'aide de colorants qui ciblent la structure en feuillets β-plexes, tels que le rouge Congo ou la thioflavine-S (Serrano-Pozo, 2011). Les plaques diffuses négatives à la thioflavine-S présentent des formes et des tailles variables et n'ont pas de structure fibrillaire bien définie. Ces plaques diffuses sont généralement observées dans le cerveau de personnes âgées cognitivement intactes. Les plaques à noyau dense positives à la thioflavine-S, en revanche, ont un noyau compact composé d'un groupe de filaments extracellulaires entremêlés de processus neuronaux, astrocytaires et microgliaux environnants (Serrano-Pozo, 2011). Ces plaques neuritiques (PN) sont associées à une augmentation de la perte synaptique, de la perte de neurones, de l'astrogliose et de la microgliose (Dickson, 2001; Ly, 2011; Tsering, 2023). Les NP sont généralement observées aux stades avancés de la maladie d'Alzheimer et présentent une corrélation plus forte avec le déclin cognitif que les plaques diffuses (Haroutunian, 1998). Cette constatation souligne la nécessité de faire la distinction entre les plaques diffuses et les plaques névritiques lorsqu'on tente d'établir un lien entre la charge en β-amyloïde et la progression de la maladie.
Les agrégats Aβ peuvent également se déposer dans les parois des vaisseaux, ce que l'on appelle souvent l'Aβ vasculaire ou l'angiopathie amyloïde cérébrale (CAA). Ces dépôts sont généralement formés de peptides Aβ40, qui sont plus solubles que les peptides Aβ42 que l'on trouve généralement dans les plaques parenchymateuses typiques. Des études ont montré que l'ACA peut être un facteur contribuant au déclin cognitif observé dans la MA (Greenberg, 2004; Arvanitakis, 2011).
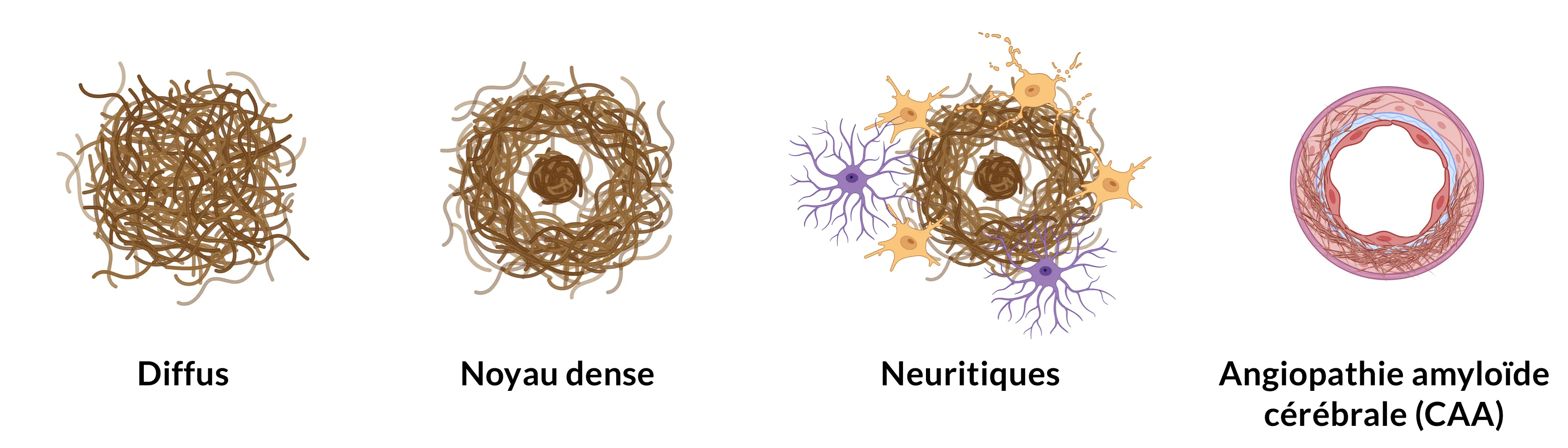
Illustration des différents types de plaques amyloïdes-β.
D'autres sous-types plus rares de plaques Aβ comprennent les plaques à noyau dense et à grains grossiers, qui sont associées aux premiers stades de la MA (Boon, 2020), et les plaques cotonneuses diffuses, que l'on trouve souvent chez les patients présentant des mutations génétiques spécifiques, telles que celles du gène PSEN1 (Crook, 1998).
Comment les plaques amyloïdes sont-elles caractérisées dans les images d'immunohistochimie et d'immunofluorescence multiplexe?
L'évaluation de la charge en plaques dans les données d'immunohistochimie (IHC) et d'immunofluorescence (IF) est traditionnellement effectuée manuellement à l'aide de critères semi-quantitatifs établis par le Consortium to Establish a Registry for Alzheimer's Disease (CERAD) (Mirra, 1991). Ces critères se concentrent sur l'évaluation de la plus forte densité de plaques neuritiques néocorticales et ne prennent pas en compte la présence de plaques diffuses dans le calcul du score.
Des efforts considérables ont été déployés pour mettre au point des approches quantitatives permettant d'évaluer la charge des plaques Aβ en tenant compte de la localisation anatomique, de la densité des plaques et du sous-type de plaque. Les méthodes couramment employées pour quantifier manuellement cette caractéristiques comprennent le comptage stéréologique non biaisé des plaques (Busch, 1997; Ohm, 1997) et le classement des densités de plaques à l'aide d'une échelle d'évaluation numérique (Arnold, 1991). Ces évaluations manuelles peuvent être fastidieuses, sujettes à la variabilité entre les évaluateurs et difficiles à adapter à des études de plus grande envergure. Des méthodes automatiques reposant sur des algorithmes classiques de vision par ordinateur (par exemple, seuillage, opérations morphologiques, etc.) ont été étudiées pour réduire la charge de travail des pathologistes et augmenter la fiabilité de la quantification (Byrne, 2009; Neltner, 2012; Samaroo, 2012; Kapasi, 2023). Cependant, une grande majorité de ces méthodes classiques nécessitent encore des entrées définies par l'homme, ce qui les rend sensibles aux variations des lots et à la variabilité des colorations observées dans des ensembles de données plus importants.
Notre groupe a procédé à la quantification des plaques amyloïdes dans un modèle de souris présentant une accumulation précoce et progressive de dépôts β-amyloïdes semblable à celle de la maladie d'Alzheimer. Cette lignée de souris transgéniques (ARTE10) est caractérisée par la surexpression de l'APP et de la PS1 mutées (Willuweit, 2009). La charge de la plaque Aβ a été évaluée à partir d'images IF de ces souris à différents moments en utilisant une combinaison de flou, de seuils d'hystérésis locaux et d'opérations morphologiques. Cette approche était entièrement automatisée et ne nécessitait pas d'entrées définies par l'homme pour quantifier la charge Aβ dans les coupes de tissus. Voir notre présentation - L'amyloïde-β et le microenvironnement inflammatoire dans un modèle de souris APP/PS1 de la maladie d'Alzheimer.
Images de microscopie
La visualisateur d'images interactif ci-dessous vous permet d'explorer l'ensemble de la section de tissu en immunofluorescence multiplexe.
Vous pouvez vous déplacer dans l'image à l'aide du bouton gauche de la souris. Vous pouvez effectuer un zoom avant et arrière à l'aide de la souris/du trackpad (haut/bas) ou des boutons + et - situés dans le coin supérieur gauche. Vous pouvez activer/désactiver, modifier la couleur et ajuster les paramètres de l'image pour les canaux et les segmentations dans le panneau de contrôle situé dans le coin supérieur droit.
Dans cette visualisation, un cerveau de souris APP/PS1 (ARTE10) est représenté avec les masques de segmentation « Plaques Aβ » (jaune), qui peuvent être cochés/décochés pour cacher/afficher la coloration « Amyloïde-β » sous-jacente (rouge).
Plus récemment, des groupes de recherche ont signalé avoir utilisé des approches d'apprentissage profond pour la classification automatisée des plaques de la MA en sous-types de plaques, en tirant parti de la performance de niveau expert de ces modèles pour reconnaître des modèles complexes dans les images. Par exemple, Tang et ses collègues (Tang, 2019) ont développé un pipeline d'apprentissage profond de preuve de concept qui analyse les images de diapositives entières et classifie les pathologies Aβ entre les plaques diffuses, les plaques à noyau dense et la CAA. Le même groupe a ensuite développé ces résultats en montrant que ces modèles d'apprentissage automatique étaient robustes aux variations de cohorte dans les études multicentriques (Vizcarra, 2020; Wong, 2022). D'autres groupes ont signalé avoir utilisé des approches similaires pour différencier les tauopathies (Signaevsky, 2019; Koga, 2022; Wong, 2022). Dans l'ensemble, des efforts considérables ont été déployés pour former ces modèles d'apprentissage profond sur un large éventail de paramètres d'entrée (région du cerveau, méthodologie de coloration, caractéristiques pathologiques) afin de les rendre adaptables et généralisables.
Notre équipe se fera un plaisir de répondre à vos questions sur l'analyse des plaques amyloïdes-β ou de vous fournir des informations spécifiques sur les modèles de la maladie d'Alzheimer que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles pour la maladie d'Alzheimer
Contenu connexe
Informations actualisées sur la maladie d'Alzheimer et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de la maladie d'Alzheimer.
Autophagie et maladies neurodégénératives
An overview of how cellular autophagy plays a role in brain health and neurodegeneration.
Morphologie des astrocytes dans la maladie d'Alzheimer
Une vue d'ensemble de l'analyse morphologique des astrocytes et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.
Amyloïde-β et microenvironnement inflammatoire chez la souris Alzheimer
Nous avons analysé les relations spatiales complexes entre les plaques β-amyloïdes, la microglie activée et au repos, et les astrocytes dans un modèle transgénique APP/PS1.
Morphologie de la microglie dans la SLA, la maladie d'Alzheimer et la maladie de Parkinson
Une vue d'ensemble de l'analyse morphologique des microglies et des applications à la recherche sur les maladies neurodégénératives et à la découverte et au développement de médicaments.