Cette ressource décrit:
- Qu'est-ce que le modèle EAE de la SP?
- Comment les lésions axonales sont-elles généralement mesurées sur des coupes de tissus provenant de modèles d'EAE?
- Les niveaux de neurofilament à chaîne légère (NfL ; NF-L) dans le sang et le LCR peuvent-ils être utilisés pour évaluer les lésions axonales dans l'EAE?
Qu'est-ce que le modèle EAE de la sclérose en plaques?
L'encéphalomyélite auto-immune expérimentale (EAE) est le modèle animal le plus utilisé pour la sclérose en plaques (SP). L'EAE reproduit plusieurs aspects clés de la SP humaine, notamment l'inflammation périphérique et la neuroinflammation, la démyélinisation et les lésions axonales. L'infographie ci-dessous met en évidence plusieurs des principales caractéristiques de l'EAE dans les modèles de souris ou de rats.
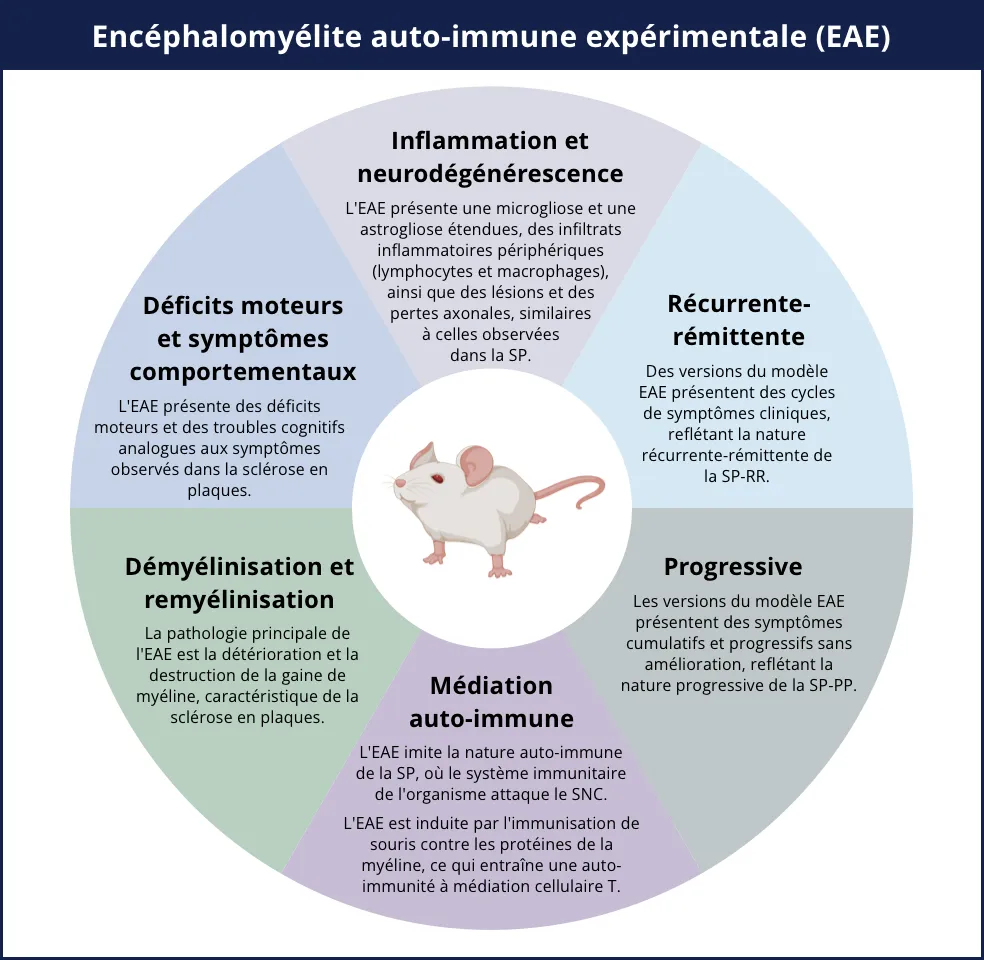
L'EAE modélise les principaux aspects de la sclérose en plaques (SP) humaine, notamment la maladie auto-immune, la démyélinisation et la remyélinisation, l'inflammation et la neurodégénérescence (y compris les lésions axonales), les déficits moteurs et l'évolution récurrente-rémittente et/ou progressive de la maladie.
Cliquez pour copier le lien
L'EAE peut être induite chez la souris ou le rat par immunisation active avec des protéines ou des peptides de la myéline (par exemple MBP, MOG, PLP) dans un adjuvant, ou par transfert passif de cellules T CD4+ activées ciblant la myéline. Les manifestations primaires de l'EAE se produisent dans la moelle épinière et se caractérisent par une infiltration de lymphocytes T et de monocytes, conduisant à une inflammation localisée et au développement de lésions démyélinisantes.
L'EAE illustre bien le potentiel translationnel des modèles de rongeurs, puisque plusieurs médicaments contre la SP actuellement sur le marché ont été initialement testés dans ce modèle. Par exemple, l'acétate de glatiramère (GA ; Copaxone) et le natalizumab (Tysabri), un anticorps monoclonal contre l'intégrine VLA-4, et le fingolimod (FTY-720, Gilenya), un modulateur du récepteur de la sphingosine-1-phosphate (S1P), ont été évalués dans des modèles d'EAE.
Comment les lésions axonales sont-elles généralement mesurées sur des coupes de tissus provenant de modèles EAE?
La dégénérescence et les lésions des axones peuvent être mesurées sur des coupes de tissus provenant de la moelle épinière de souris et de rats EAE. En effectuant une analyse quantitative des images de la coloration immunohistochimique sur fond clair ou de la coloration par immunofluorescence multiplexe, il est possible d'obtenir des données quantitatives provenant de différentes régions d'intérêt (par exemple, matière grise, matière blanche) à plusieurs niveaux de la moelle épinière (par exemple, cervical, thoracique, lombaire). Les marqueurs IHC/IF courants de l'intégrité/lésion de l'axone comprennent les neurofilaments phosphorylés et non phosphorylés, ainsi que la protéine précurseur de l'amyloïde (APP). Des exemples illustrant l'utilisation de ces marqueurs dans les modèles d'EAE sont présentés ci-dessous.
Overview of the process for measuring axonal damage on tissue sections from EAE rodent models.
Aharoni et ses collègues ont coloré le tissu de la moelle épinière de souris EAE MOG35-55 pour les protéines légères, moyennes et lourdes du neurofilament. Ils ont constaté une déformation et une perte axonales importantes dans les sites de démyélinisation. Lorsque ces souris ont été traitées avec de l'acétate de glatiramère, les lésions/pertes axonales et la démyélinisation ont été réduites. Budde et al. ont utilisé l'analyse quantitative de la coloration SMI-32 pour les neurofilaments non phosphorylés comme marqueur des lésions axonales. Ils ont trouvé une association avec la diffusivité axonale mesurée par l'imagerie du tenseur de diffusion (DTI) IRM in vivo dans la moelle épinière des souris EAE.
Herrero-Herranz et ses collègues ont étudié l'immunoréactivité de l'APP, qui a été décrite comme un marqueur de lésions axonales aiguës, chez les souris MOG-EAE. Ils ont constaté que de nombreux axones étaient positifs à l'APP au début de l'évolution de la maladie, mais que leur nombre diminuait de manière significative aux stades ultérieurs de la maladie. Dans cette étude, les chercheurs ont également coloré des coupes de tissus de la moelle épinière avec le SMI-31 pour les neurofilaments phosphorylés et le SMI-32 pour les neurofilaments non phosphorylés. Dans la phase précoce de la MOG-EAE, les axones positifs au SMI-32 augmentaient, tandis que le pourcentage d'axones positifs au SMI-31 diminuait dans la lésion. Aux derniers stades de la progression de la maladie, on a observé une forte augmentation des axones positifs au SMI-32 et seulement quelques axones positifs au SMI-31, ce qui indique que la quantité relative de neurofilaments phosphorylés diminue, tandis que les neurofilaments non phosphorylés augmentent au cours de l'évolution de la MOG-EAE.
Les taux de neurofilament à chaîne légère (NfL ; NF-L) dans le sang et le LCR peuvent-ils être utilisés pour évaluer les lésions axonales dans l'EAE?
Plusieurs groupes ont démontré l'utilisation des niveaux de neurofilament à chaîne légère (NfL) dans le plasma et le LCR comme biomarqueurs liquides des lésions axonales dans l'EAE. La mesure des concentrations de NfL dans les liquides biologiques est intéressante chez les souris EAE car elle est prometteuse dans les études sur la SP humaine, y compris les essais cliniques sur la SP, servant ainsi de biomarqueur translationnel potentiel.
Chez Biospective, nous mesurons régulièrement les niveaux de NfL dans le plasma et le LCR chez les souris EAE MOG35-55 dans le cadre de nos études d'efficacité thérapeutique. Comme le montre la figure ci-dessous, le taux de NfL est significativement élevé à partir du pic de la maladie (tel que mesuré par le score clinique de l'EAE).
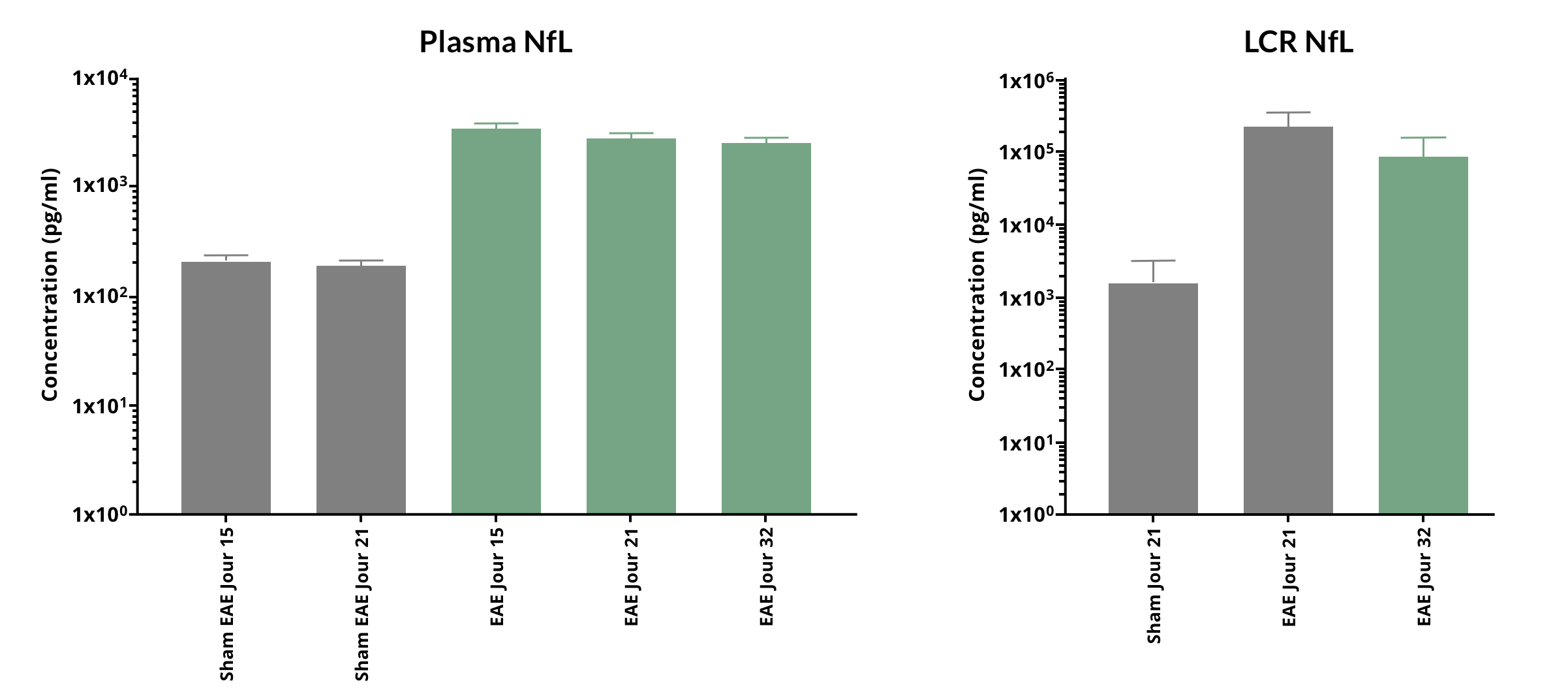
Highly elevated levels of NfL (mean ± s.d.) are found in the plasma and CSF of MOG35-55 EAE mice over the disease course.
Kieseier et al. ont réalisé une méta-analyse de vingt-cinq études indépendantes sur l'EAE chez la souris, menées sur une période de deux ans. Chez des souris C57BL/6J atteintes d'EAE induite par le MOG28-152 de rat dans l'adjuvant complet de Freund, ils ont montré que les niveaux de NfL dans le plasma et le LCR augmentaient de manière significative après l'induction de la maladie. Ces niveaux sont restés élevés jusqu'à un mois et ont diminué d'environ 10 fois deux mois après l'induction de la maladie. Ils ont également constaté que les corrélations entre les niveaux de NfL dans le plasma et le LCR, ainsi qu'entre les niveaux de NfL dans le plasma ou le LCR et les scores cliniques de l'EAE, étaient très significatives.
Aharoni et al. ont étudié les changements neurodégénératifs dans le modèle de souris EAE induit par le MOG et l'effet du traitement à l'acétate de glatiramère (GA) [Copaxone] sur ces manifestations. Ils ont constaté l'apparition précoce de lésions axonales dans ce modèle, comme l'a révélé une analyse cinétique détaillée de la fuite de NfL dans le sang en fonction de la durée de la maladie, ainsi qu'une analyse immunohistochimique (IHC).
Brummer et ses collègues ont découvert qu'une patte spatio-temporelle de libération de NfL dans le sang chez les souris MOG-EAE peut être pilotée par les cellules myéloïdes du SNC (CMC), telles que la microglie et les macrophages infiltrants, et peut progresser de manière centripète en fonction du stade de la maladie, de la substance blanche d'apparence normale (NAWM) aux lésions de la substance blanche (WML). Ils ont également démontré que les taux sériques de neurofilament à chaîne légère (sNfL) étaient associés à la localisation des lésions anatomiques respectives, ce qui pourrait fournir une explication physiopathologique à la forte variance interindividuelle des taux de sNfL chez les patients atteints de sclérose en plaques.
Norgren et al. ont induit une EAE chez des rats Agouti sombres à l'aide de MOG1-125 recombinant et ont constaté une différence statistique hautement significative dans les niveaux de NfL du LCR entre le groupe de contrôle et les rats malades. De même, Zuo et ses collègues ont constaté que l'encéphalomyélite auto-immune expérimentale passive (EAE), induite par un transfert adoptif de jeunes cellules Th17 chez des souris SJL/J, générait un phénotype clinique sans rémission qui était associé à des niveaux accrus de NfL sérique au pic de la maladie chez les souris jeunes et âgées. En outre, à la phase post-aiguë de la maladie, les souris âgées receveuses présentaient une augmentation de la NfL par rapport aux souris jeunes receveuses appariées par sexe, et les niveaux de NfL sériques étaient positivement corrélés avec la gravité de la maladie mesurée par le score de l'EAE.
Zahoor et al. ont étudié le profil des analytes sanguins, y compris les cytokines (IL6, IL17, IL12p70, IL10 et TNFα) et les marqueurs neuraux (NfL et GFAP) dans le plasma des modèles de souris EAE à poussées-rémissions (RR) (souris SJL induites avec le peptide PLP139-151) et chroniques (souris B6 induites avec MOG35-55) pendant différentes phases (aiguës, chroniques et progressives) de l'évolution de la maladie à l'aide du test Simoa. La NfL plasmatique (ainsi que la GFAP) a montré une augmentation substantielle après l'apparition de la maladie lors des phases aiguës, chroniques et progressives dans les modèles RR SJL et chronique EAE de souris B6.
Notre équipe se fera un plaisir de répondre à vos questions sur les modèles EAE ou de vous fournir des informations spécifiques sur les modèles que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de SP
Contenu connexe
Informations actualisées sur la sclérose en plaques et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de la sclérose en plaques.
Démyélinisation et remyélinisation dans le modèle Cuprizone
Aperçu des méthodes disponibles pour mesurer la myéline et les oligodendrocytes dans le modèle murin de démyélinisation par la cuprizone de la sclérose en plaques (SP).