Qu'est-ce que l'autophagie?
Le terme autophagie, dérivé du mot grec signifiant « se manger », a été inventé par le biochimiste belge Christian de Duve en 1966 pour décrire un processus de dégradation à médiation lysosomale au sein des cellules eucaryotes qui élimine et recycle les débris cellulaires - depuis les bactéries et les virus jusqu'aux protéines anormales et aux organites endommagés (Cai, 2022). Ces composants sont utilisés pour la synthèse de nouvelles molécules, ce qui permet aux cellules de se réparer et de se reconstruire afin de survivre et de fonctionner plus efficacement (Nixon, 2013).
Dans les cellules eucaryotes, trois voies autophagiques principales ont été identifiées : la macro-autophagie, la micro-autophagie et l'autophagie médiée par les chaperons. Bien que ces voies convergent vers la dégradation lysosomale, elles diffèrent par le type de cargaison cellulaire qu'elles ciblent et les mécanismes sous-jacents qu'elles utilisent pour ce processus (Nakatogawa, 2009; Kesidou, 2013).
Pour en savoir plus sur l'impact du dysfonctionnement lysosomal dans les microglies et les astrocytes sur les maladies neurodégénératives, consultez: Dysfonctionnement lysosomal dans les microglies et les astrocytes
En raison de la nature post-mitotique des neurones, l'autophagie semble jouer un rôle protecteur dans l'homéostasie et l'intégrité neuronales (Bhukel, 2019; Stavoe, 2019). Des voies d'autophagie inhérentes et induites par le stress sont présentes dans les neurones, ces dernières étant déclenchées par l'hypoxie, l'excès de radicaux libres nocifs et les dommages mitochondriaux (Lee, 2011; Stavoe, 2019). Au-delà de ces voies, l'autophagie joue d'autres rôles spécialisés dans le système nerveux central : elle contribue au processus de myélinisation, qui est essentiel pour la signalisation neuronale, et régule la réponse inflammatoire de la microglie. La dérégulation de ces processus peut entraîner des dommages irréversibles dans le SNC et la mort des neurones (Su, 2016).
Pour plus d'informations sur la manière dont l'autophagie microgliale altérée contribue aux maladies neurodégénératives, consultez: Altération de l'autophagie de la microglia dans les maladies neurodégénératives
Pour étudier le rôle de l'autophagie dans les neurones, les chercheurs utilisent des techniques, comme la microscopie électronique (ME), qui permettent de visualiser les compartiments autophagiques, tels que les vésicules liées à la membrane qui acheminent les composants cellulaires vers le lysosome. L'analyse par immunoblot de la protéine LC3 associée aux microtubules, en particulier LC3-II, est une autre approche largement utilisée pour quantifier l'autophagie dans les cellules, car ses niveaux sont en corrélation avec la formation d'autophagosomes (Klionsky, 2016). Des études in vivo avec des souris transgéniques GFP-LC3 permettent également d'observer et d'analyser systématiquement les processus autophagiques (Mizushima, 2004).

Dans les cellules eucaryotes, trois voies autophagiques principales - la macro-autophagie, la micro-autophagie et l'autophagie médiée par les chaperons - sont responsables de l'élimination et du recyclage des débris cellulaires. Malgré les mécanismes distincts impliqués, ces voies convergent vers le lysosome.
Facebook
Twitter
LinkedIn
Cliquez pour copier le lien
Quelles sont les maladies neurodégénératives associées à une altération de l'autophagie?
L'altération de l'autophagie est étroitement associée à la pathologie de plusieurs maladies neurodégénératives, qui se caractérisent par l'agrégation de protéines anormales à l'intérieur des neurones (Kesidou, 2013). Des mutations dans les principaux gènes liés à l'autophagie codant pour des protéines essentielles aux voies autophagiques ont été impliquées dans la maladie d'Alzheimer, la maladie de Parkinson, la sclérose latérale amyotrophique (SLA) et la maladie de Huntington (Nah, 2015; Deng, 2017; Menzies, 2017).
Les modèles de souris ont permis de mieux comprendre ce lien. Par exemple, lorsque Hara et al. (Hara, 2006) ont étudié le rôle de l'autophagie dans les cellules neuronales en l'absence de protéines mutantes associées à la maladie en utilisant des souris knock-out Atg5 spécifiques des cellules neuronales, l'analyse histologique des cerveaux de ces souris a révélé une perte neuronale, une dégénérescence des cellules de Purkinje cérébelleuses et l'accumulation de corps d'inclusion positifs à l'ubiquitine.
La protéine Beclin-1, un régulateur bien connu de l'autophagie, a été impliquée dans plusieurs maladies neurodégénératives (Pickford, 2008; Son 2012). Dans la maladie d'Alzheimer, les niveaux de Beclin-1 sont réduits dans le cerveau au début du processus de la maladie, ce qui perturbe le flux autophagique (Pickford, 2008). Dans la maladie de Huntington, le gène mutant Huntingtin se lie à la Bécline-1, ce qui nuit à sa fonction (Shibata 2006; Wu, 2012). La Bécline-1 facilite également la dégénérescence de l'alpha-synucléine, qui forme des agrégats toxiques à l'intérieur des neurones dans la maladie de Parkinson. Lorsque Spencer et al. (Spencer, 2009) ont administré de la Bécline-1 exprimée par lentivirus dans le cerveau de souris transgéniques atteintes d'alpha-synucléine, le groupe a observé une amélioration de la pathologie synaptique et dendritique, ainsi qu'une réduction de l'accumulation d'alpha-synucléine dans le système limbique.
Des mutations dans les gènes liés à la SLA - SOD1 et TDP-43 - ont été associées à des défaillances à différents stades du processus d'autophagie (Lee, 2015). Rudnick et al. (Rudnick, 2017) ont exploré le rôle de l'autophagie dans les motoneurones à différents stades du processus pathologique de la SLA en croisant des souris knock-out Atg7 avec un modèle de souris SLA. L'inhibition de l'autophagie des motoneurones chez les souris SOD1-G93A a accéléré la dénervation des fibres musculaires rapides et l'apparition des tremblements, ce qui suggère que l'autophagie joue un rôle protecteur dans le maintien des connexions muscle-nerf pendant les premiers stades de la SLA.
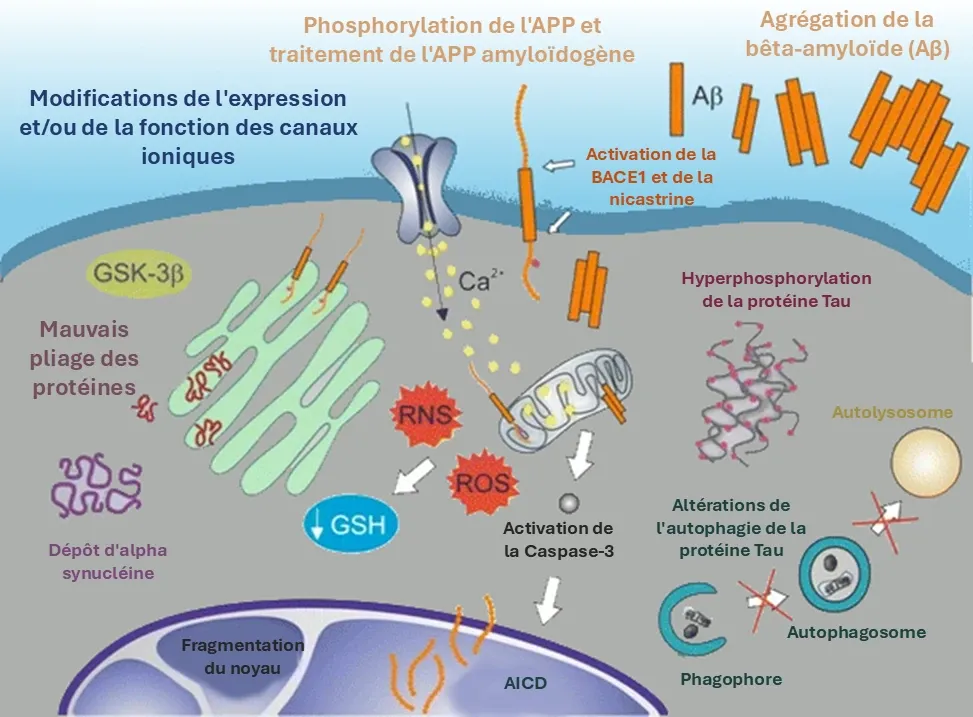
Représentation des caractéristiques moléculaires de la neurodégénérescence : mauvais repliement des protéines, agrégats de protéines, perturbations de l'autophagie, stress oxydatif, dysfonctionnement des neurones et mort cellulaire apoptotique. La figure et la légende sont reproduites de De Chiara et al. (De Chiara, 2012) sous la licence Creative Commons Attribution.
Facebook
Twitter
LinkedIn
Cliquez pour copier le lien
Quelle est la relation entre l'autophagie et les protéines mal repliées?
L'autophagie joue un rôle complémentaire à celui du protéasome dans la dégradation des protéines mal repliées. Les perturbations de l'activité autophagique sont étroitement liées à l'accumulation d'agrégats de protéines toxiques dans les neurones, ce qui conduit à la neurodégénérescence (Nixon, 2006; Williams, 2006; Zhang, 2007; Son 2012). Des études menées sur des modèles murins de maladies neurodégénératives ont montré que l'augmentation de l'activité autophagique par la rapamycine favorise l'élimination de ces agrégats de protéines pathologiques (Caccamo, 2010). Cependant, il est important de noter que la relation entre les protéines mal repliées et l'autophagie est bidirectionnelle - les protéines mal repliées peuvent interférer avec les voies autophagiques, créant une boucle de rétroaction qui exacerbe la progression de la maladie (Cuervo, 2004; Orenstein, 2013).
Amyloïde-bêta
L'autophagie joue un rôle clé dans la production, la sécrétion et l'élimination de la bêta-amyloïde intracellulaire. Les peptides amyloïdes-bêta sont générés dans les autophagosomes lors de la dégradation des organites riches en protéine précurseur de l'amyloïde (APP), comme les vésicules et les endosomes dérivés du Golgi (Nixon, 2007). Des études sur des modèles murins suggèrent que la sécrétion de ces peptides par les neurones est facilitée par l'autophagie. Lorsque Nillson et al. (Nillson, 2013) ont croisé des souris transgéniques APP avec des souris dépourvues de mécanismes d'autophagie critiques dans leur cerveau antérieur, les souris présentaient moins de plaques de bêta-amyloïde que celles dont l'autophagie était fonctionnelle. Selon l'équipe, cette réduction est due à l'incapacité des neurones à sécréter de la bêta-amyloïde en l'absence d'autophagie.
Tau
Cette protéine associée aux microtubules, impliquée dans la maladie d'Alzheimer, est un régulateur clé de l'autophagie. Une phosphorylation accrue de Tau déstabilise les microtubules, entravant leur capacité à transporter des cargaisons cellulaires en vue de leur dégradation par autophagie (Esteves, 2019). En outre, l'accumulation de tau bloque la fusion autophagosome-lysosome, inhibant le flux autophagique et perpétuant sa propre accumulation - un cercle vicieux dans la MA (Feng, 2019).
Alpha-synucléine
L'alpha-synucléine est dégradée non seulement par le protéasome, mais aussi par l'autophagie et la macroautophagie médiées par des chaperons (Vogiatzi, 2008 ; Vidal, 2014; Frake, 2015). Les mutations des protéines régulant l'autophagie, telles que LRRK2, PINK1 et PARKIN, favorisent le mauvais repliement et l'accumulation de l'alpha-synucléine (Beilina, 2015; Hou, 2021; Zhang, 2022).
Pour en savoir plus sur le rôle de l'autophagie dans la maladie de Parkinson, consultez: Autophagie, maladie de Parkinson et neurones dopaminergiques
TDP-43
La protéine TAR de liaison à l'ADN 43 (TDP-43) est une protéine de liaison à l'ARN/ADN. La stimulation de l'autophagie dans les neurones peut augmenter le renouvellement de la TDP-43 et réduire sa mauvaise localisation du noyau vers le cytoplasme dans les neurones et la microglie - une caractéristique de la pathologie de la SLA et de la DFT (Barmada, 2014).
Notre équipe se fera un plaisir de répondre à vos questions sur l'autophagie dans les maladies neurodégénératives ou de vous fournir des informations spécifiques sur les modèles de MA, SLA et MP que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles de maladies neurodégénératives
Contenu connexe
Informations actualisées sur l'autophagie dans les maladies neurodégénératives et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de maladies neurodégénératives.
Altération de l'autophagie de la microglia dans les maladies neurodégénératives
Comment l'altération de l'autophagie microgliale contribue à la progression des maladies neurodégénératives.
Dysfonctionnement lysosomal dans les microglies et les astrocytes
Un aperçu du dysfonctionnement lysosomal dans la microglie et les astrocytes, et de son rôle dans les maladies neurodégénératives.
Autophagie et facteur de transcription EB (TFEB)
Aperçu du facteur de transcription EB (TFEB) et de son rôle dans l'autophagie et les maladies neurodégénératives.
Autophagie, maladie de Parkinson et neurones dopaminergiques
Une vue d'ensemble de la façon dont une autophagie déficiente peut conduire à des changements pathologiques et à la neurodégénérescence des neurones dopaminergiques dans la maladie de Parkinson.
