이 자료는 다음을 설명합니다:
TDP-43이란 무엇인가?
TDP-43(Transactive Response DNA Binding Protein)은 RNA와 DNA에 결합하는 고도로 보존된 단백질입니다. 이 단백질은 TARDBP 유전자에 의해 암호화되며 핵 내 이종 핵 리보핵단백질(hnRNP) 가족에 속합니다(Cohen, 2011; de Boer, 2020; Jo, 2020; Corbet, 2021; Tziortzouda, 2021).
정상적인 생리학적 조건에서 TDP-43은 주로 핵에서 발견되지만, 핵과 세포질 사이를 활발하게 이동합니다. 세포질로 잘못 위치할 경우, TDP-43은 근위축성 측삭 경화증(ALS) 및 전두측두엽 치매(FTD)와 같은 단백질 병증을 유발할 수 있습니다. 이러한 병리학에서, 그것은 신경 퇴화에 기여하는 유해한 응집체를 형성합니다 (de Boer, 2020; Jo, 2020; Chhangani, 2021; Scialo, 2025).
TDP-43의 기능
TDP-43은 핵 내에서 유전자 발현과 RNA 처리를 조절하는 데 중요한 역할을 합니다.
TDP-43의핵 기능은 다음과 같습니다 (de Boer, 2020; Corbet, 2021; Dykstra, 2025):
- 스플라이싱 과정에서 숨겨진 엑손의 포함을 억제함으로써 RNA 전사 조절
- mRNA의 유지, 대사 및 수송
- 마이크로RNA(miRNA)의 성숙
TDP-43은 세포질로 이동하여 다양한 기능을 수행하며, 이는 부정적 피드백 메커니즘을 통해 조절됩니다.
TDP-43의세포질 기능은 다음과 같습니다 (Cohen, 2011; Jo, 2020; Corbet, 2021; Tziortzouda, 2021):
- mRNA의 안정성 및 번역
- 두 가지 구조의 형성:
- 산화 스트레스로부터 신경세포를 보호하는 데 필수적인 스트레스 과립
- 리보핵단백질 과립(mRNA 수송 및 miRNA 생성에 중요)
또한 TDP-43은 미토콘드리아 게놈과 결합하며 호흡 사슬 관련 경로에 관여합니다. 이 단백질은 배아 발생 초기 단계에서 중추 신경 세포의 정상적 발달에 필수적입니다. 실제로 마우스 모델에서 TDP-43 기능 상실은 배아 치사적임이 입증되었습니다(Cohen, 2011; de Boer, 2020).
TDP-43의 다양한 기능은 그 여러 영역에서 비롯됩니다(Cohen, 2011; de Boer, 2020; Jo, 2020; Tziortzouda, 2021; Corbet, 2021):
- N-말단 도메인(NTD)은 TDP-43의 자가 올리고머화를 촉진합니다. 이 도메인에는 핵 내 수송에 중요한 핵 국소화 신호(NLS)도 포함됩니다.
- RNA 인식 모티프(RRM1 및 RRM2)는 RNA와 DNA를 포함한 핵산에 결합하는 역할을 담당합니다.
- 핵수출 신호(NES)는 TDP-43의 수송을 촉진합니다.
- C-말단 도메인(CTD)은 단백질 용해성을 조절하고 병리학적 응집을 매개하며, 스트레스 과립으로 TDP-43을 모집하는 데 기여합니다.
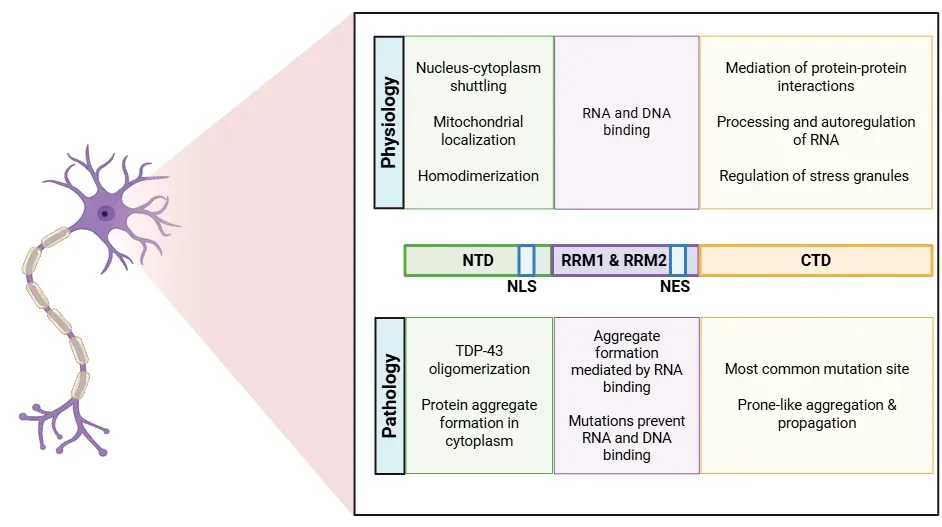
TDP-43 단백질의 구조, 각 부위의 생리적 및 병리적 역할 상세 설명.
TDP-43 병리가 ALS 및 FTD에서 갖는 의의는 무엇인가?
TDP-43 단백질병증은 ALS 및 FTD를 포함한 여러 신경퇴행성 질환의 특징입니다. TDP-43 단백질의 응집은 질병 진행 및 중증도와 밀접하게 연관되어 있습니다. TDP-43 응집체는 알츠하이머병(AD) 환자의 20~50%에서도 발견되며, 이 경우 기억력 저하 및 뇌 위축 증가와 상관관계가 있습니다(Prasad, 2019).
TDP-43 단백질 병증과 관련된 병인 과정에는 독성 기능 획득 및 기능 상실 메커니즘이 모두 포함됩니다. TDP-43의 절단, 과인산화 및 유비퀴틴화는 핵과 세포질 모두에서 독성 응집체의 형성을 초래합니다 (Mackenzie, 2008; Xu, 2014; Yang, 2014; Scotter, 2015; Meneses, 2021).
TDP-43 병리학에서는 다양한 유전자 돌연변이가 보고되었으며, 이들 중 상당수는 CTD 영역에 국한되어 있습니다. 예를 들어, 유전자 스플라이싱 오류로 인해 은닉 엑손이 포함되면서 핵 내 TDP-43이 소실되어 TDP-43 병리가 발생할 수 있습니다. 이러한 돌연변이의 영향을 받는 두 가지 관련 유전자는 다음과 같습니다:
- UNC13A: 기능적 TDP-43의 상실은 UNC13A mRNA 내 은닉 엑손의 포함을 초래하며, 이는 시냅스 전달에 중요한 UNC13A 단백질 발현 감소로 이어진다 (Garcia-Montojo, 2024).
- Stathmin2 (STMN2): STMN2는 운동 뉴런의 성장과 회복에 중요합니다. TDP-43 기능 상실은 은닉 엑손 포함 및 폴리아데닐화(polyadenylation)로 인해 STMN2의 스플라이싱 오류와 고갈을 초래합니다(Suk, 2020; Ma, 2022).
TDP-43 병리와 연관된 다른 주요 돌연변이는 C9orf72 유전자(전형적 ALS 및 FTD와 연관), TARDBP 및 ALS2 유전자와 관련됩니다(de Boer, 2020; Jo, 2020).
병리학적 상황에서 TDP-43은 여러 메커니즘을 통해 핵에서 세포질로 점점 더 많이 수송됩니다 (Yang, 2014; Prasad, 2019; Suk, 2020; Garcia-Montojo, 2024):
- NTD 내 NLS의 돌연변이.
- 스트레스 과립 조절 장애: 산화 스트레스나 열 충격 후 TDP-43, RNA 및 기타 단백질이 세포질에 축적됩니다. 생리적 조건에서는 세포 스트레스가 해소되면 TDP-43이 일반적으로 핵으로 재이동합니다.
- 핵공 복합체(NPC) 기능 장애: (G4C2)30 RNA 수준 감소는 TDP-43의 핵 국소화를 조절하는 Ran 발현을 저하시킵니다. Nup62 및 Kpnb1과 같은 다른 단백질들도 이 수송 과정에 기여합니다.
- 세포질 응집체: TDP-43의 세포질 응집체 형성은 악순환을 초래하여 핵-세포질 수송과 핵공 복합체를 더욱 교란시키고, 결과적으로 더 많은 TDP-43이 핵을 빠져나가게 합니다.
이러한 병리학적 변화는 다음과 같은 결과를 초래합니다:
- 기능 상실 (Yang, 2014; de Boer, 2020; Suk, 2020; Garcia-Montojo, 2024):
- RNA 대사 조절 장애
- 핵 내 TDP-43 고갈
- 자식작용 장애
- 미토콘드리아 기능 장애
- 독성 기능 획득 (Xu, 2014; Prasad, 2019; Suk, 2020; Meneses, 2021):
- 병리학적 중합체 형성으로 인한 단백질 응집 증가 및 신경독성
- 엑소좀 또는 시냅스 전달을 통한 프리온 유사 전파. 미세아교세포, 성상세포 및 올리고도교세포는 TDP-43을 식균하여 뉴런으로 전달할 수 있음
- 참고 자료: 미세아교세포-뉴런 상호작용 및 신경퇴행성 질환
- 궁극적으로 TDP-43 응집체의 존재는 신경세포 사멸에 기여한다
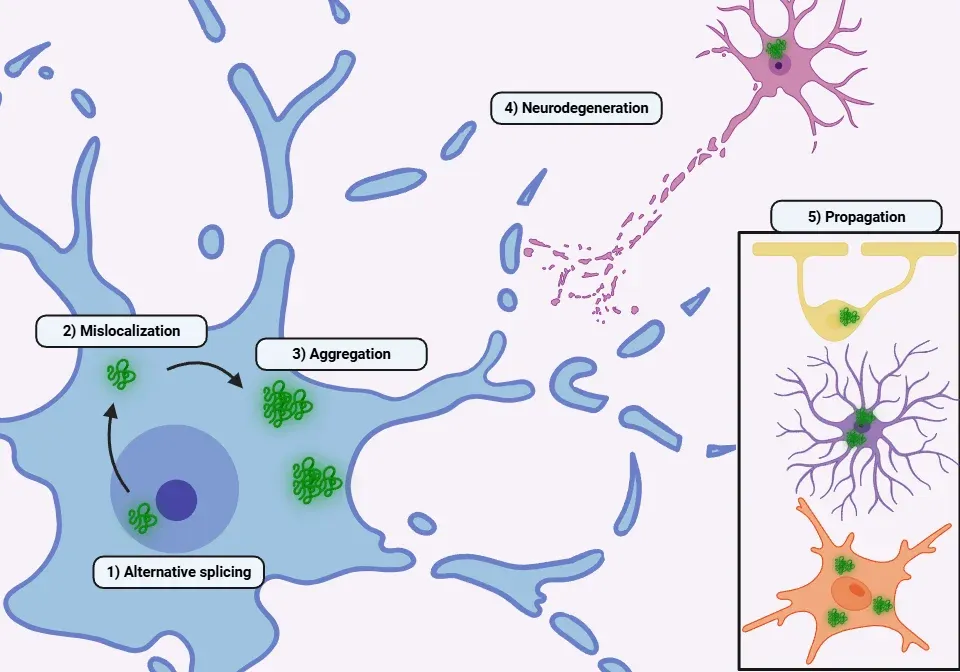
TDP-43 단백질병증의 병리생리학적 기전에 대한 개요
ALS
TDP-43의 세포질 내 응집은 ALS의 주요 병리학적 특징으로 간주된다(Xu, 2014; Scotter, 2015; Prasad, 2019; de Boer, 2020; Suk, 2020; Hu, 2024):
- 산발성 및 가족성 ALS 환자의 90% 이상에서 TDP-43 응집체가 관찰됩니다.
- SOD1 또는 FUS 돌연변이로 인한 ALS는 일반적으로 TDP-43 병리를 보이지 않지만, TARDBP 돌연변이는 TDP-43 병리를 유발하며 가족성 ALS의 직접적인 원인이다.
- 그러나 TARDBP 돌연변이는 가족성 ALS 사례의 약 4%에서만 발견되며, 이는 전체 ALS 사례의 10% 미만에 해당합니다.
- ALS에서 TDP-43 응집과 관련된 다른 유전자 돌연변이로는 A90V (NLS 영역에 위치), G294V 및 A315T가 있습니다 .
- TDP-43 병리의 위치에 따라 실행 기능 장애, 언어 장애, 행동 이상 등의 증상이 나타날 수 있습니다.
ALS에서는 세 가지 유형의 TDP-43 병리가 확인되었습니다(de Boer, 2020):
- 혼합 신경세포 및 신경교세포 병리
- 아교세포 병리(특히 성상세포)
- 신경 세포 병리
TDP-43 병리는 대뇌 피질 V층 뉴런과 척수 운동 뉴런에서 가장 두드러지게 나타납니다. ALS 환자의 조직에서는 침착된 TDP-43의 종류에 따라 지역적 차이가 관찰됩니다(Scotter, 2015; Wu, 2024):
- C-말단 절단 단편은 뇌에서 풍부하게 존재함
- 척수 내포물에서는 전체 길이 TDP-43이 우세함
마우스 모델에서 TDP-43 기능의 부분적 상실만으로도 신경퇴행, 진행성 운동 기능 장애, 마비, 그리고 궁극적으로 사망을 유발하기에 충분하다 (Xu, 2014; Yang, 2014).
참조: 근위축성 측삭 경화증(ALS)의 TDP-43 마우스 모델
FTD
병리학적 관점에서 전두측두엽 퇴화증(FTLD)으로도 알려진 FTD는 뉴런과 신경교 세포에 TDP-43, 타우 또는 FUS 단백질 응집체가 존재하는 것이 특징입니다 (Prasad, 2019; Ho, 2024; Hu, 2024).
- TDP-43 돌연변이는 FTD 사례 중 극히 일부에만 관련되어 있습니다.
- 예를 들어, C9orf72 돌연변이는 FTD 사례의 약 13%를 차지합니다.
- 그러나 TDP-43 응집체는 FTD 환자의 최대 50%에서 발견됩니다.
- 또 다른 중요한 돌연변이는 GRN 유전자(프로그라눌린)로, 기능 상실을 초래하며 상염색체 우성 방식으로 유전됩니다.
TDP-43과 관련된 FTD의 증상으로는 공감 능력 상실, 부적절한 사회적 행동, 의사소통의 어려움 등 성격, 행동 및 언어 능력의 변화가 있습니다 (Prasad, 2019; de Boer, 2020; Jo, 2020).
참고 자료: 전두측두엽 치매의 신경 영상 및 임상 시험
FTD 환자에서 총 혈청 TDP-43 수치는 건강한 대조군에 비해 현저히 낮은 경우가 많으며, 특히 C9orf72 반복 확장 보균자나 운동뉴런병 증상을 동반한 FTD 환자에서 두드러집니다. 이러한 수치 감소는 단백질이 불용성 응집체로 격리되기 때문으로 추정됩니다(Katisko, 2022).
FTLD에서는 세 가지 다른 병리 유형이 보고됩니다: FTLD-tau (35-50%), FTLD-FUS (10%), FTLD-TDP (약 50%). FTLD-TDP는 다음과 같은 하위 유형으로 추가 구분됩니다 (Prasad, 2019; de Boer, 2020; Meneses, 2021):
- 유형 A: 일반적으로 신피질에서 발견되는 조밀하거나 초승달 모양의 신경세포질 내포체(NCI).
- B형: 확산형 또는 과립형 NCI로, 대뇌피질 및 피질하 올리고도교세포에 위치하며 운동신경세포 질환과 연관됨.
- C형: 주로 신피질에 위치한 다수의 위축성 신경돌기.
- 유형 D: 다수의 신경세포 내핵 내포체.
혁신 기술 보기: 확산 MRI 및 전두측두엽 치매(FTD) 및 전두측두엽 치매(FTD) 및 MRI 뇌 위축
TDP-43은 잠재적 치료 표적이 될 수 있는가?
현재 치료 전략은 세 가지 주요 접근법을 강조합니다: 독성 단백질 제거, 기능 회복, 그리고 그 고갈의 하류 효과 해결입니다.
벡터화된 항체
- ACI-5891은 AAV9를 이용해 전달되는 벡터화된 단일클론 항체로, 병리학적 TDP-43을 특이적으로 표적합니다. ALS 및 FTD 마우스 모델에서, 단일 뇌실 내 주사로 병리학적 인산화 TDP-43 신호를 최대 68%까지 감소시키는 데 성공했습니다(Val, 2025).
- 항체 3B12A는 잘못 접힌 TDP-43 응집체에서 잔기 E246 및 D247의 비정상적인 노출을 감지하며, TDP-43의 프로테아좀 분해를 촉진하도록 설계되었습니다(Francois-Moutal, 2021).
- VH7Vk9는 RRM1 도메인에 집중하여 프로테아좀 또는 자가포식 기반 분해를 촉진합니다(Francois-Moutal, 2021).
소분자
- 바이칼린은 구조 교정제 역할을 하여 기존의 잘못 접힌 단백질을 기능적인 형태로 변형시키는 데 도움을 줍니다 (Chang, 2024).
- M102는 핵 인자 적혈구 2 관련 인자 2(NRF2) 및 열 충격 인자 1(HSF-1) 경로의 활성화제로, 산화 스트레스와 TDP-43 응집의 영향을 감소시켜 ALS 동물 모델에서 유망한 결과를 보였습니다 (San Gil, 2025).
- 파리 모델에서 추가 분자들이 탐구되었습니다(Francois-Moutal, 2021):
- RRM1 핵산 결합 인터페이스를 표적으로 하는 rTRD0
- nTRD22: N-말단 도메인을 표적하여 TDP-43 제거 촉진
안티센스 올리고뉴클레오티드(ASO)
- QRL-201은 TDP-43 병리에서 비정상적 스플라이싱이 발생하는 단백질 STMN2를 표적하여 운동 뉴런 기능 개선을 돕습니다. 이 치료법은 현재 산발성 및 C9orf72-ALS에 대한 1상 임상시험 중입니다(Liu, 2024).
- Qalsody는 SOD1 돌연변이가 있는 ALS 환자에 대해 FDA 승인을 받았지만, TDP-43 병리학은 다루지 않습니다 (San Gil, 2025).
유전자 치료
- UNC13a와 같은 다른 관련 유전자의 비정상적 스플라이싱을 교정하기 위한 전임상 개발 단계에 있습니다(San Gil, 2025).
샤페론 표적 치료법
- J-도메인 단백질(DNAJB1, DNAJB2a, DNAJB4, DNAJB5)의 과발현은 세포 모델에서 불용성 TDP-43을 현저히 감소시킵니다 (San Gil, 2025).
14-3-3θ
- ALS 마우스 모델에서 잘못 접힌 TDP-43을 표적으로 하여 행동 장애를 개선합니다 (San Gil, 2025).
자가포식 유도
- 단백질 응집체 제거를 개선합니다(Hayes, 2022):
- 라파마이신과 같은 mTOR 억제제
- 트레할로스 및 이부딜라스트와 같은 TFEB 유도제
- 관련 자료 참조: 신경퇴행성 질환에서의 미세아교세포 오토파지 장애 및 오토파지와 전사인자 EB(TFEB)
C-말단 글리신 풍부 도메인과 RRM2 도메인은 상분리 및 응집을 유도하는 데 핵심적 역할을 하여 특정 항체의 매력적인 표적이 됩니다(Riemenschneider, 2023). 저자들이 언급한 바와 같이, 필수 도메인을 표적으로 삼을 때는 주의가 필요합니다. 일부 N-말단 펩타이드를 이용한 능동 면역은 생리적 역할로 인해 핵 내 TDP-43의 기능과 관련되어 생쥐에서 치사율을 유발할 수 있기 때문입니다 (Riemenschneider, 2023).
여러 연구 그룹이 TDP-43 ΔNLS ALS 마우스 모델에서 치료적 개입을 통한 질병 수정 효과를 입증했습니다. 주목할 만한 결과는 다음과 같습니다:
- AIT-101: PIKfyve를 억제하는 소분자 화합물입니다. 이 치료법은 체중 감소 감소, 운동 기능 장애 개선, 혈장 및 뇌척수액(CSF) 내 신경섬유 경량(NfL) 수치 저하, TDP-43 응집체 감소 효과를 보였습니다(Young, 2023).
- VRG50304: 이 화합물은 혈장 및 뇌척수액 내 NfL 수치를 감소시키고, 원인 피질에서의 산성 스핑고미엘리나제 활성을 저하시키는 것으로 확인되었습니다(Stomakhina, 2021).
- AAV9/NF242: 로 구아닌 뉴클레오티드 교환 인자의 N-말단 단편을 뇌실 내 주사한 결과, 생쥐의 수명과 운동 능력이 모두 개선되었습니다 (Droppelmann, 2024).
자세한 내용은 리소스를 참조하십시오: ALS 약물 개발을 위한 TDP-43 ΔNLS (rNLS8) 마우스
아리모클로몰, 페닐부티레이트 나트륨, 우르소독시콜타우린, 콜히친, BIIB105 등 TDP-43을 표적으로 한 여러 치료법이 ALS 임상 시험에서 실패했음에도(San Gil, 2025), TDP-43은 현재 진행 중인 연구에서 여전히 중요한 표적으로 남아 있습니다. 아직 인간 대상에서 TDP-43 기반 치료제가 질병 진행을 늦추는 능력을 성공적으로 입증한 사례는 없지만, 다수가 전임상 개발 단계에 있어 향후 진전을 위한 강력한 기반을 제공하고 있습니다. 효과적인 치료법으로 나아가기 위해서는 TDP-43 응집과 기능 상실 모두를 해결하는 혁신적인 전략이 필요하며, 이는 ALS 치료 분야의 잠재적 돌파구를 마련할 것입니다(San Gil, 2025).
저희 팀은 TDP-43에 관한 모든 질문에 기꺼이 답변해 드리며, 치료 효능 연구에 사용하는 모델에 대한 구체적인 정보도 제공해 드릴 수 있습니다.
관련 콘텐츠
다발성 경화증에 관한 최신 정보 및 다발성 경화증 동물 모델에서 치료제 평가와 관련된 모범 사례.
미세아교세포-신경세포 상호작용 및 신경퇴행성 질환
미세아교세포와 신경세포 간의 직접적인 상호작용에 대한 간결한 검토, 그리고 이러한 세포 간 상호작용이 신경퇴행성 질환에서 어떻게 영향을 받을 수 있는지.
ALS 마우스 모델의 신약 개발
근위축성 측삭 경화증(ALS) 치료제의 전임상 시험을 위한 연구용 동물 모델(마우스 및 랫드 모델)의 가장 효과적인 사용에 대한 안내서.
ALS 신약 개발을 위한 TDP-43 ΔNLS (rNLS8) 마우스
이 자료는 임상 전 치료 연구를 위한 ΔNLS(deltaNLS, hTDP-43ΔNLS, hTDP-43DeltaNLS, dNLS, TDP43 NLS, rNLS8) TDP-43 ALS 유전자 변형 마우스 모델의 사용에 대한 정보를 제공합니다.
전두측두치매의 신경 영상 및 임상 시험
전두측두엽 치매(FTD) 변종에 대한 이해와 FTD 임상 시험의 종결점으로 활용되는 MRI 및 PET 영상 바이오마커의 유용성.