Cette ressource décrit:
- Pourquoi mesurer le neurofilament à chaîne légère dans les modèles animaux de la maladie de Parkinson?
- Comment mesure-t-on le neurofilament à chaîne légère?
- Dans quels modèles animaux de la maladie de Parkinson les niveaux de neurofilament à chaîne légère dans le sang et le LCR ont-ils été rapportés?
Pourquoi mesurer le neurofilament à chaîne légère dans les modèles animaux de la maladie de Parkinson?
Le neurofilament à chaîne légère (NfL ; NF-L) est la chaîne légère d'une famille de protéines de filaments intermédiaires qui se localisent dans le cytoplasme axonal des neurones. Lorsque l'axone est blessé ou dégénère, la NfL est libérée dans le liquide extracellulaire et peut ensuite être mesurée dans le liquide céphalo-rachidien (LCR) et dans le sang (plasma, sérum). Ainsi, les niveaux de NfL servent de biomarqueur fluidique des lésions axonales et/ou de la neurodégénérescence.
Notre groupe a démontré une forte corrélation entre les niveaux de NfL dans le plasma et le LCR et les volumes du cerveau entier mesurés par imagerie par résonance magnétique (IRM) in vivo dans un modèle de souris d'ensemencement et de propagation de fibrilles préformées d'α-synucléine (PFF) de la maladie de Parkinson. Cette analyse indique l'utilité de ce biomarqueur liquide pour refléter l'atrophie cérébrale. Il convient de noter que les niveaux de NfL reflètent les dommages neuronaux globaux dans l'ensemble du système nerveux sans spécificité neuroanatomique. En revanche, l'IRM peut mesurer les changements régionaux dans des structures spécifiques (régions corticales et sous-corticales distinctes, moelle épinière, etc.), y compris les altérations non seulement du volume mais aussi de l'épaisseur corticale et de la section transversale de la moelle épinière. Ainsi, les niveaux de NfL dans le sang et le LCR et les mesures structurelles par IRM doivent être considérés comme des modalités complémentaires.
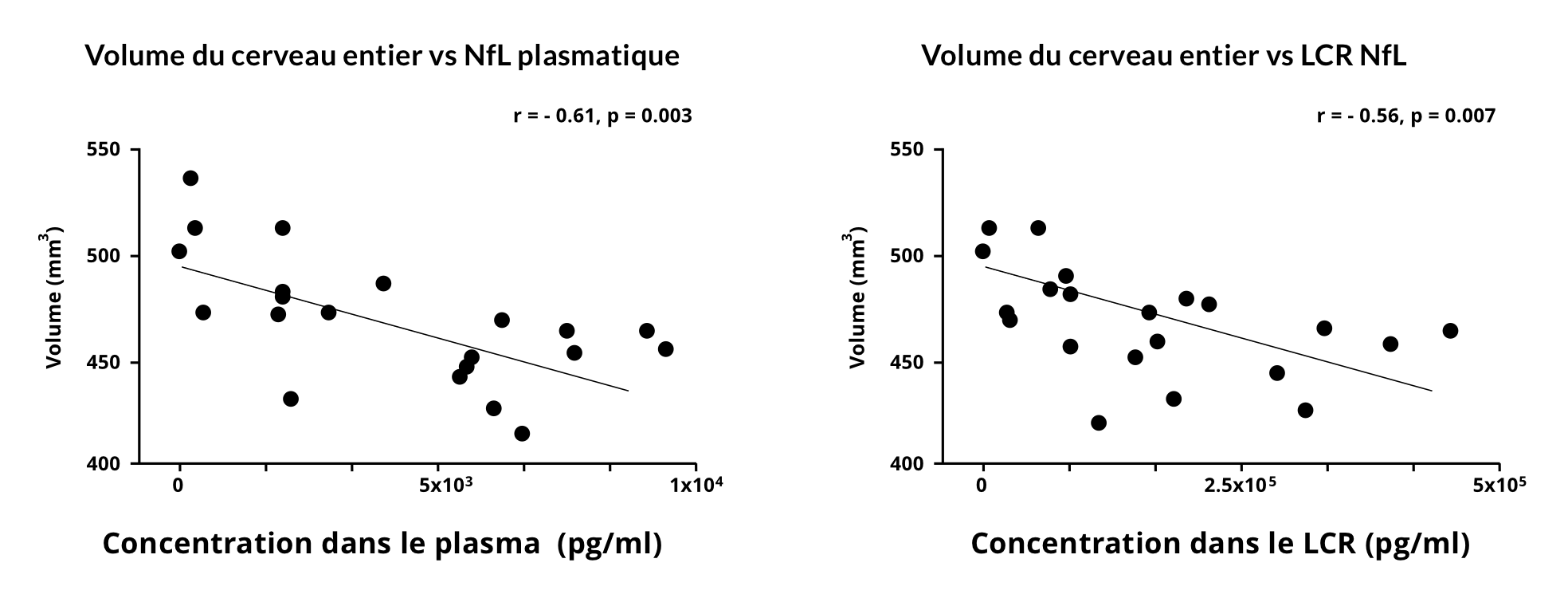
Corrélations entre les niveaux de NfL dans le plasma et le LCR et les volumes du cerveau entier mesurés par IRM.
Les niveaux de NfL peuvent être mesurés à plusieurs moments au cours d'une étude préclinique d'efficacité thérapeutique, ce qui permet une évaluation longitudinale chez le même animal. Il est facile d'effectuer des prélèvements sanguins multiples au cours de l'étude. Chez Biospective, nous avons également la capacité de collecter plusieurs échantillons de LCR en vie, ce qui permet une analyse complète du profil temporel des niveaux de NfL pour surveiller la progression de la maladie et l'effet de l'intervention thérapeutique dans les modèles de la maladie de Parkinson.
Comment mesure-t-on le neurofilament à chaîne légère?
Le neurofilament à chaîne légère est généralement évaluée dans des échantillons de liquide à l'aide d'un test immuno-enzymatique (ELISA) ou du test ultrasensible Simoa (single molecular array). Le test Simoa, tel qu'il est décrit dans sa publication originale, dépasse de plus de 1 000 fois la sensibilité du test ELISA. Le test Simoa est une technologie avancée de détection de protéines à molécule unique qui utilise des billes paramagnétiques modifiées par des anticorps à des concentrations exceptionnellement élevées par rapport aux très faibles concentrations de l'analyte cible. Cette configuration garantit que chaque bille capturera au maximum un complexe immun. Ensuite, l'analyte cible est marqué avec un second anticorps ciblé complexé à un système de détection, tel que la Streptavidine-β-Galactosidase (SβG), ou de multiples réactifs de détection biotinylés pour l'analyse multiplex. Lors de l'introduction d'un substrat, le réactif de détection produit un produit fluorescent. L'aspect crucial de la sensibilité de Simoa réside dans la concentration de l'intensité de fluorescence résultant d'une bille magnétique individuelle, confinée dans un micropuits recouvert d'huile qui n'accueille qu'une seule bille. La lumière fluorescente captée dans les puits individuels par un dispositif à couplage de charge (CCD) est utilisée pour acquérir les signaux. Le calcul de la proportion de puits générant un signal à partir du réseau permet de quantifier la concentration des protéines cibles.
La grande sensibilité et le faible volume du test Simoa en font un outil idéal pour l'analyse d'échantillons de LCR et de sang (plasma ou sérum) de souris. Le LCR ne peut être prélevé qu'en très petites quantités et les concentrations de NfL dans le sang sont très faibles. Cette méthode très sensible peut détecter des niveaux de NfL aussi bas que le femtogramme (fg/mL).
Vue d'ensemble du processus de collecte et d'analyse Simoa des niveaux de NfL dans les biofluides de souris.
Les progrès récents de la Simoa ont élargi ses capacités pour inclure une stratégie de multiplexage, facilitant ainsi l'évaluation simultanée de divers marqueurs associés à la maladie. Le multiplexage est réalisé grâce à plusieurs techniques, telles que l'utilisation de billes paramagnétiques marquées par fluorescence en conjonction avec des anticorps ciblés et des réactifs de détection pour générer un signal fluorescent complexe capable de distinguer plusieurs marqueurs. Par exemple, la protéine acide fibrillaire gliale (GFAP), un filament intermédiaire présent dans les astrocytes, peut être mesurée en même temps que la NfL. La GFAP sert de biomarqueur de l'astrogliose et apporte des informations complémentaires à la NfL, qui sert de biomarqueur de l'intégrité neuronale. Cette technique Simoa multiplex a été utilisée avec succès pour évaluer les niveaux plasmatiques de NFL, GFAP, UCHL1 et tau chez les patients atteints de la maladie de Parkinson.
Dans quels modèles animaux de la maladie de Parkinson les niveaux de neurofilament à chaîne légère dans le sang et le LCR ont-ils été rapportés?
Notre groupe effectue régulièrement des mesures de NfL dans le modèle de souris d'ensemencement et d'étalement de fibrilles préformées d'α-synucléine (PFF). Pour générer ce modèle, nous inoculons des PFF d'α-synucléine humaine recombinante dans des régions spécifiques du cerveau de la souris par injection stéréotaxique afin d'initier la formation d'agrégats d'α-synucléine qui se propagent le long de voies de connexion anatomiques (ce que l'on appelle la «propagation de type prion»). Afin de générer un phénotype robuste de la maladie, nous injectons généralement les fibrilles unilatéralement dans le noyau olfactif antérieur (AON) pour générer un modèle de système limbique ou dans le faisceau médian du cerveau (MFB) pour produire un modèle de système moteur. Nous injectons les fibrilles dans des souris transgéniques M83 qui surexpriment l'α-synucléine humaine avec une mutation A53T sous le promoteur de la protéine prion de souris (Prnp). Nous avons démontré une neurodégénérescence étendue dans ce modèle de souris de la maladie de Parkinson. Nous observons régulièrement des niveaux très élevés de NfL dans le plasma et le LCR de ces souris.
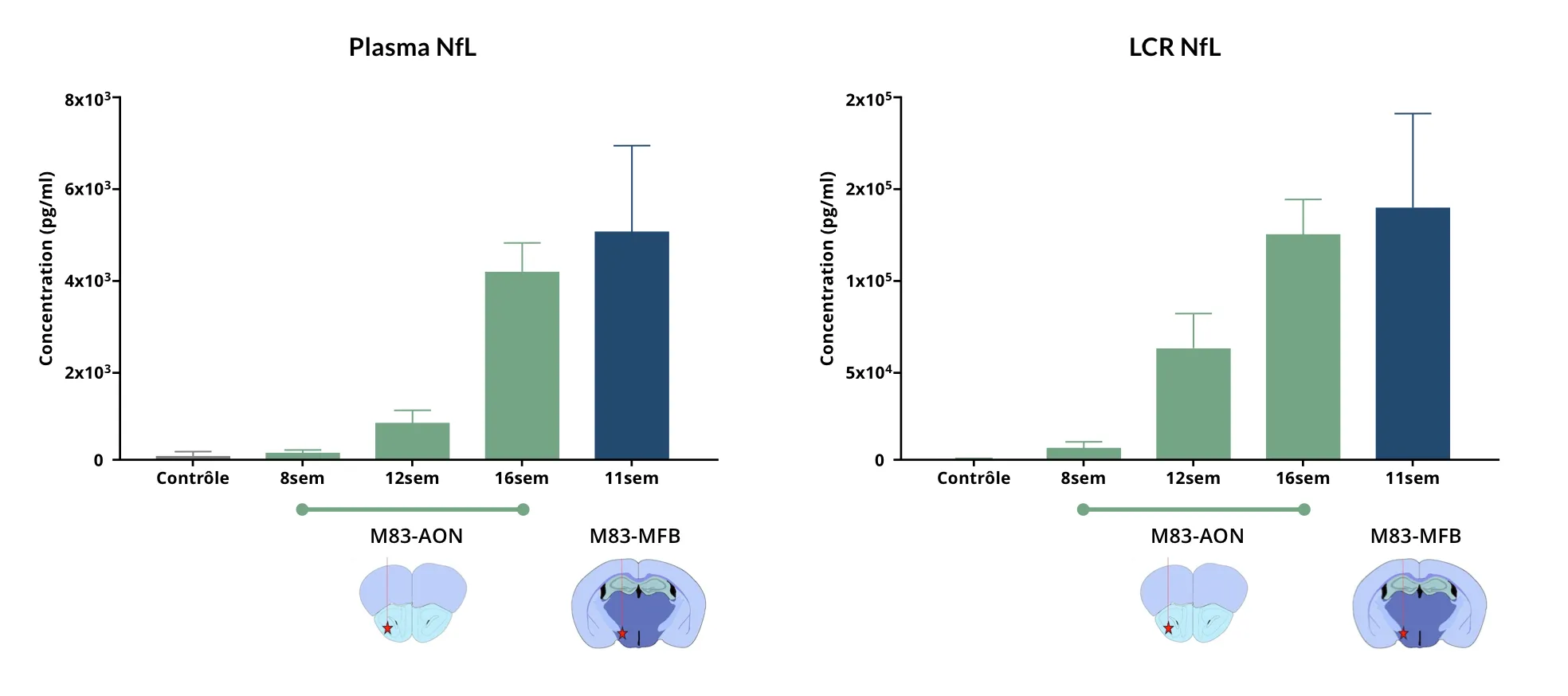
Des niveaux très élevés de NfL (moyenne ± s.d.) sont trouvés dans le plasma et le LCR de souris transgéniques M83+/- injectées avec des PFFs d'α-synucléine humaine recombinante dans l'AON et le MFB.
Kasanga et al. ont constaté que les taux sériques de NfL augmentaient de 40 % après une lésion à la 6-hydroxydopamine (6-OHDA) chez les rats Sprague-Dawley par rapport aux animaux sham. Ce groupe a également montré que l'exercice aérobique d'intensité modérée réduisait significativement les niveaux sériques de NfL dans les groupes sham et 6-OHDA, avec une réduction de 42 % dans le groupe sham et de 25 % dans le groupe 6-OHDA.
Bacioglu et ses collègues ont évalué les niveaux de NfL chez les souris Thy1-hA53T-αS (A53T-αS). Chez les souris A53T-αS, ils ont constaté qu'une augmentation significative, supérieure à 10 fois, de la NfL dans le LCR par rapport aux témoins non transgéniques était déjà observée chez les souris non symptomatiques âgées de 2 à 4 mois. Les taux de NfL ont ensuite augmenté et étaient 1 000 fois plus élevés que chez les souris témoins non transgéniques appariées à l'âge, à l'âge de 8 à 10 mois. Les taux plasmatiques de NfL n'ont pas montré d'augmentation significative à l'âge de 2 à 4 mois, mais ont été multipliés par plus de 100 au stade symptomatique.
Ce groupe a également évalué les niveaux de NfL chez des souris Thy1-hA30P-αS (A30P-αS) auxquelles on a inoculé un extrait de cerveau dérivé de souris transgéniques A30P-αS âgées et symptomatiques. Les mesures de NfL dans le plasma et le LCR de souris A30P-αS non injectées (contrôle) ont montré une augmentation robuste des niveaux de NfL liée à l'âge, similaire à celle des souris A53T-αS à l'âge de 18-22 mois. Cependant, l'injection d'un extrait de cerveau transgénique aux souris A30P-αS a décalé cette augmentation à l'âge de 7-8 mois. Les auteurs ont donc suggéré un lien mécanique entre la pathologie de l'α-synucléine et les niveaux de NfL.
Loeffler et al. ont évalué les niveaux de NfL dans le modèle transgénique d'alpha-synucléine Line 61. Le plasma de souris mâles Line 61 a été analysé pour déterminer les niveaux de NfL à 3, 6, 9 et 12 mois. Ils n'ont constaté qu'une augmentation mineure des niveaux de NfL par rapport aux compagnons de lit non transgéniques, avec un degré élevé de variabilité chez les animaux plus âgés.
Clement et al. ont évalué les niveaux de plasma et de LCR dans le modèle de souris MitoPark, mais n'ont pas trouvé d'augmentation significative par rapport aux témoins de la portée.
Notre équipe se fera un plaisir de répondre à vos questions sur les modèles de la maladie de Parkinson ou de vous fournir des informations spécifiques sur les modèles que nous utilisons pour les études d'efficacité thérapeutique.
En savoir plus sur nos modèles pour la maladie de Parkinson
Contenu connexe
Informations actualisées sur la maladie de Parkinson et les meilleures pratiques liées à l'évaluation des agents thérapeutiques dans les modèles animaux de la maladie de Parkinson.
Autophagie, maladie de Parkinson et neurones dopaminergiques
Une vue d'ensemble de la façon dont une autophagie déficiente peut conduire à des changements pathologiques et à la neurodégénérescence des neurones dopaminergiques dans la maladie de Parkinson.
Activation microgliale dans un modèle de souris PFF à α-synucléine
Nous avons quantifié l'activation microgliale, sur la base de la morphologie, dans un modèle murin d'ensemencement et d'étalement de fibrilles préformées d'α-synucléine (PFF) de la maladie de Parkinson.
Analyse de l'atrophie cérébrale dans les modèles murins de neurodégénérescence
Mesures quantitatives automatisées de l'atrophie cérébrale in vivo par IRM (volumes cérébraux régionaux et épaisseur corticale) dans des modèles murins de SLA et de maladie de Parkinson.
Modèles AAV d'α-synucléine pour le développement de médicaments contre la maladie de Parkinson
Vue d'ensemble des modèles de souris et de rats à α-synucléine induite par un vecteur du virus adéno-associé (AAV), à utiliser dans les études précliniques de thérapeutiques modificatrices de la maladie.